
Билет №21
1)Биотрансформация — метаболическое превращение эндогенных и экзогенных химических веществ в более полярные (гидрофильные) соединения.
Фазы биотрансформации

Реакции 1-й фазы Реакции 2-й фазы(реакции синтеза)
гидролиз, -глюкуронирование,
восстановление, -сульфатирование,
окисление. -ацетилирование,
-метилирование,
конъюгация(соединение) с:
а) глутатионом (синтез меркаптуровой кислоты) б) аминокислотами (глицином,таурином и глутаминовой кислотой).
Основные пути биотрансформации чужеродных соединений.
1. Окисление:
а) микросомальное
– алифатичекое или ароматическое гидроксилирование,
– эпоксидирование,
– N-гидроксилирование,
– N, S-окисление,
– дезалкилирование,
– дезаминирование,
– десульфирование;
б) немикросомальное
– окислительное дезаминирование,
– окисление спиртов, альдегидов,
– ароматизация алициклических соединений.
2. Восстановление:
а) восстановление нитросоединений, азотсоединений микросомальными ферментами;
б) микросомальное восстановительное галогенирование;
в) немикросомальное восстановление.
3. Гидролиз с участием микросомальных и немикросомальных ферментов.
4. Синтез (реакции коньюгирования):
а) образование коньюгатов с глюкуроновой кислотой;
б) образование сложных эфиров с серной и фосфорной кислотами;
в) метилирование;
г) ацетилирование;
д) пептидная коньюгация.
Классическим примером биотрансформации ксенобиотиков является метаболизм бензола в организме

Рис. Метаболизм бензола
В ходе l фазы метаболизма обеспечивается превращение жирорастворимого субстрата в полярный продукт путем включения в молекулу гидроксильной группы. В ходе ll фазы образовавшийся фенол взаимодействует с эндогенным сульфатом, в результате полярность образующегося продукта еще более возрастает. Фенилсульфат прекрасно растворяется в воде и легко выделяется из организма.
Далеко не всегда преобразования молекулы представляет собой простое чередование 1 и 11 фаз метаболизма. Возможна и более сложная последовательность реакций биопревращений.
Ферменты 1-й фазы биотрансформации ксенобиотиков
l фаза метаболизма в широком смысле может быть определена, как этап биотрансформации, в ходе которого к молекуле соединения либо присоединяются полярные функциональные группы, либо осуществляется экспрессия таких групп, находящихся в субстрате в скрытой форме
Разнообразие чужеродных химических веществ, способных подвергаться в организме метаболическим превращениям, является следствием многообразия энзимов, участвующих в l фазе биотрансформации и их низкой субстратной специфичности. Многие из энзимов существуют в нескольких формах (изоферменты), различающихся по своим физико-химическим свойствам (молекулярная масса, электрофоретическая подвижность, абсорбцией света с разними длинами волн), отношению к индукторам и ингибиторам (см. ниже) и активностью в отношении субстратов различного строения.
Энзимы l фазы, участвующие в процессе биотрансформации ксенобиотиков, можно классифицировать в соответствии с типом активируемой ими реакции:
1. Оксидазы смешанной функции: цитохромР-450 (Р-450) и флавинсодержащие монооксигеназы (ФМО);
2. Простогландинсинтетазы - гидропероксидазы (ПГС) и другие пероксидазы;
3. Алкогольдегидрогеназы и альдегиддегидрогеназы;
4. Флавопротеинредуктазы;
5. Эпоксидгидролазы;
Восстановление при биотрансформации
Некоторые металлы и ксенобиотики, относящиеся к классам альдегидов, кетонов, дисульфидов, сульфоксидов, хинонов, алкенов, азо- и нитросоединений, подвергаются в организме ферментативному восстановлению с участием коферментов — никотинамидадениндинуклеоти-да (НАД+/НАДН, НАДФ+/НАДФН) и флавинадениндинуклеотида (ФАД/ФАДН2). В некоторых случаях реакции восстановления протекают без участия ферментов под воздействием глутатиона.
В осстановление
азо- и нитросоединений происходит
под воздействием
кишечной микрофлоры и с участием двух
ферментов печени: цитохрома
Р450 и НАДФН-хинон оксидоредуктазы:
осстановление
азо- и нитросоединений происходит
под воздействием
кишечной микрофлоры и с участием двух
ферментов печени: цитохрома
Р450 и НАДФН-хинон оксидоредуктазы:
Эти реакции ингибируются кислородом, поэтому анаэробная среда нижнего отдела ЖКТ благоприятствует восстановлению.
Восстановление карбонильных соединений. Восстановление некоторых альдегидов до первичных, а кетонов до вторичных спиртов катализируется алкогольдегидрогеназой и группой ферментов — карбонильных редуктаз:

Карбонильные редуктазы — мономерные НАДФН-зависимые ферменты, которые присутствуют в крови и цитозоле клеток различных тканей.
Восстановление дисульфидов:
![]()
глутатионом происходит с участием глутатионредуктазы, глутатион - S-трансферазы или неферментативно.
Восстановление сульфоксидов. В печени и почках протекает ферментативное восстанавление сульфоксидов при участии цитохрома Р450 и НАДФН.
![]()
Восстановление хинонов до гидрохинонов:
+2e, +2H+
происходит при участии НАДФН-хиноноксидоредуктаз, флавопротеи-нов цитозоля в отсутствие кислорода. Двухэлектронное восстановление хинонов также может катализироваться карбонилредуктазой. Этот путь восстановления хинона не опасен для организма и не связан с оксида-тивным стрессом.
Второй путь восстановления катализируется микросомальной НАДФН-цитохром Р450 редуктазой и сопровождается присоединением одного электрона к молекуле хинона с образованием активного анион -радикала семихинона:
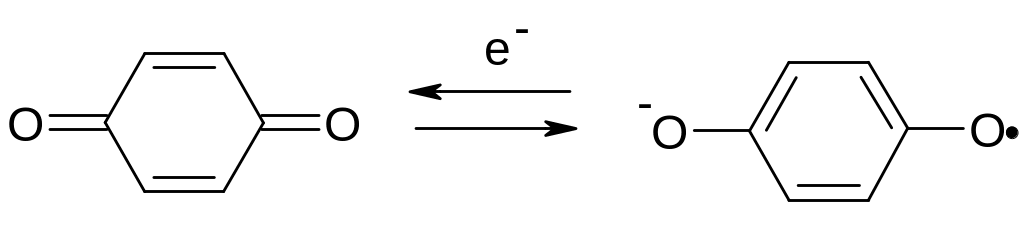
Окисление анион-радикала семихинона приводит к образованию чрезвычайно цитотоксичных активных форм кислорода (см. гл.1, ч.2), вызывающих оксидативный стресс.
Д![]() егалогенирование.
Удаление
галогенов (F,
C1,
Вг и I)
из молекулы ксенобиотика
алифатического ряда происходит по
различным механизмам. Возможно
окислительное дегалогенирование,
сопровождаемое заменой галогена
и водорода у одного и того же атома
углерода на кислород:
егалогенирование.
Удаление
галогенов (F,
C1,
Вг и I)
из молекулы ксенобиотика
алифатического ряда происходит по
различным механизмам. Возможно
окислительное дегалогенирование,
сопровождаемое заменой галогена
и водорода у одного и того же атома
углерода на кислород:
Двойное дегалогенирование (элиминация) сопровождается удалением двух атомов галогена с образованием двойной связи:

Р азновидностью
механизма элиминации является
дегидрогалогени-рование
— удаление водорода и галогена от
соседних углеродных атомов
с образованием двойной связи между
ними:
азновидностью
механизма элиминации является
дегидрогалогени-рование
— удаление водорода и галогена от
соседних углеродных атомов
с образованием двойной связи между
ними:
