
- •Часть III
- •1. Введение
- •2. Основные понятия и законы, используемые при решении задач
- •2.1. Масса атомов и молекул
- •2.2. Моль, молярная масса
- •2.3. Концентрация вещества
- •3. Основные типы расчетных задач
- •3.1. Алгоритм решения задач
- •3.2. Вычисление массы вещества по его количеству и количества по массе
- •3.3. Определение массовой доли () элемента в веществе и компонента в смеси
- •3.4. Вычисление массы и объема газов
- •3.5. Вывод формул соединений
- •3.6. Расчеты по уравнениям реакций
- •3.6.1. Расчет массы (объема, количества) продуктов реакции по массе (объему, количеству вещества) исходных веществ и обратные вычисления
- •Решение
- •3.6.2. Расчет массы (объема, количества) продуктов реакции при условии, что одно из реагирующих веществ взято в избытке
- •Решение
3.6. Расчеты по уравнениям реакций
Расчеты, связанные с уравнениями реакций, называются стехиометрическими. Они основаны на законе сохранения массы веществ и позволяют решать следующие задачи:
вычислить массу (объем, количество вещества) продуктов реакции по массе (объему, количеству вещества) одного из реагирующих веществ или двух (задачи на "избыток" и "недостаток"),
определить массовые (объемные) доли примесей в исходном веществе,
рассчитать массовую (объемную) долю выхода продукта,
выполнить расчеты с учетом концентраций веществ.
Стехиометрические расчеты используются также для решения задач, обратных вышеперечисленным.
В расчетах по уравнениям реакций важно уметь правильно расставить стехиометрические коэффициенты. Для уравнивания реакций можно использовать прикладную программу, составленную студентом химического факультета Самарского госуниверситета А.Скугаревым.
Вид рабочего окна этой программы:
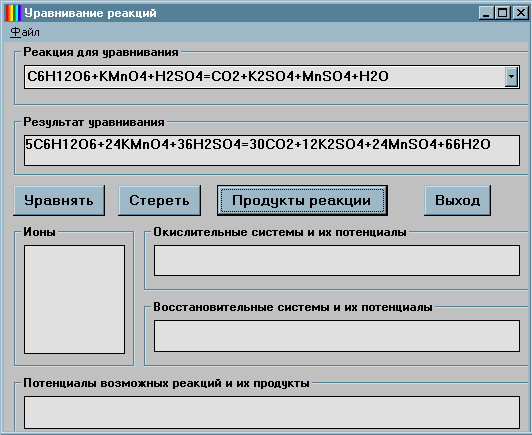
Эта программа на данном web-сайте не размещена. Ее можно найти в интерактивном компьютерном учебнике на CD ROM (см. описание учебного комплекса
3.6.1. Расчет массы (объема, количества) продуктов реакции по массе (объему, количеству вещества) исходных веществ и обратные вычисления
Задача. Какую массу углекислого газа можно получить, если сжечь 3,2 г метана? Определите объем, который займет углекислый газ, образовавшийся в этой реакции при нормальных условиях.
Краткие условия в данном случае целесообразно записать, учитывая уравнение реакции сгорания метана, следующим образом:
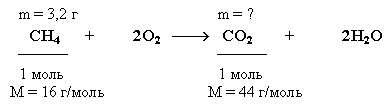
Решение
1. Находим количество вещества метана, вступившего в реакцию:
![]()
2. Количество углекислого газа согласно уравнению реакции равно количеству метана:
(CO2) = (CH4) = 0,2 моль
3. Определяем массу CO2:
m(CO2) = (CO2) M(CO2) = 0,2 моль 44 г/моль = 8,8 г
Ответ: m(CO2) = 8,8 г
3.6.2. Расчет массы (объема, количества) продуктов реакции при условии, что одно из реагирующих веществ взято в избытке
Задача. Какой объем метана (н.у.) выделится при взаимодействии 10 г карбида алюминия (Al4C3) с 10 г воды ?
Краткие условия:
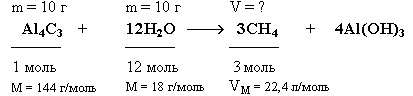
Решение
1. Находим количества вступивших в реакцию веществ:
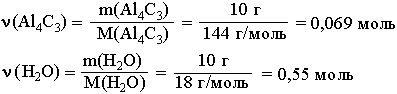
Так как на 1 моль Al4C3 требуется в 12 раз большее количество вещества воды, то на 0,069 моль Al4C3 необходимо 0,828 моль воды. Следовательно, 0,55 моль воды недостаточно для реакции с 0,069 моль Al4C3, который взят в избытке и прореагирует неполностью.
2. Определим (CH4) по веществу, взятому в недостатке:
![]()
3. Рассчитаем объем метана, образовавшегося в реакции:
V(CH4) = (CH4) Vm = 0,137 моль 22,4 л/моль = 3,07 л
Ответ: V(CH4) = 3,07 л
3.6.3. Расчет массы, объема и количества исходных веществ или продуктов реакции с учетом примесей
Задача. Определить массу образца технического углерода, содержащего 3% примесей, необходимого для получения 67,2 л (н.у.) метана.

3.6.4. Расчет массы, объема и количества исходных веществ или продуктов реакции с учетом концентрации их в растворе (смеси)
Задача. Сколько грамм бромной воды с массовой долей брома 3,2% потребуется для реакции с 10 л смеси этана и этилена, в которой объемная доля этилена равна 28%?

3.6.5. Расчет массы, объема и количества веществ с учетом выхода продукта реакции
Задача. Бензол количеством вещества 0,5 моль прореагировал с избытком брома (в присутствии катализатора). При этом получили бромбензол массой 70 г. Определите массовую долю выхода бромбензола.

3.7. Задачи повышенной трудности
На олимпиадах и вступительных экзаменах в вузы предлагаются более сложные задачи, чем рассмотренные нами ранее. Обычно в них сочетаются различные типы расчетов – как по формулам веществ, так и по уравнениям реакций. Решение таких задач требует не только глубоких знаний химии, но и развитого логического мышления, владения алгебраическим аппаратом (системы уравнений с несколькими неизвестными, неравенства, степенные и логарифмические функции и т.п.).
Рассмотрим решение одной из олимпиадных задач (г.Самара).
Задача. При дегидрировании смеси циклогексана и циклогексена в бензол выделился водород массой, достаточной для полного восстановления 36,9 г нитробензола в анилин. Найти %-ный (по массе) состав исходной смеси, если известно, что такая же масса этой смеси может обесцветить 480 г 10%-ного раствора брома в CCl4.

1. Определим m(Br2) в растворе СCl4:
m(Br2) = m(раствора) (Br2) = 480 г 0,1 = 48 г
2. Из углеводородов исходной смеси с Br2 реагирует только циклогексен С6Н10, являющийся ненасыщенным соединением.
По уравнению этой реакции рассчитаем массу С6Н10.

(С6Н10) = (Br2) = 0,3 моль
m(C6Н10) = (С6 Н10) M(С6 Н10) = 0,3 моль 82 г/ моль = 24,6 г
3. Рассчитаем количество вещества Н2, использованного на восстановление нитробензола:
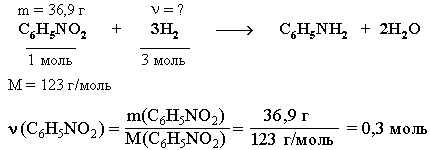
(Н2) = 3 (С6Н5NO2) = 0,9 моль
4. Массу циклогексана рассчитаем из уравнений реакций дегидрирования углеводородов.
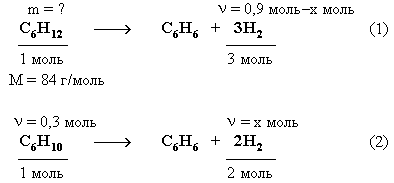
Из уравнения (2) следует, что x = (H2) = 0,6 моль.
Тогда количество водорода, выделившегося в реакции (1) равно:
(Н2) = 0,9 моль – 0,6 моль = 0,3 моль.
![]()
m(C6H12) = (C6H12) M(C6H12) = 0,1 моль 84 г/моль = 8,4 г
5. Определим массу исходной смеси углеводоров:
m(смеси) = m(C6H12) + m(C6H10) = 8,4 г + 24,6 г = 33,0 г
6. Рассчитаем массовые доли углеводородов в исходной смеси:

Ответ: (С6Н10) = 0,745 (74,5%) (С6Н12) = 0,255 (25,5%)
4. КОНТРОЛЬНЫЕ ЗАДАЧИ Примечание: знаком * отмечены задачи повышенной трудности. Калькулятор
1. Какое количество вещества составляет 92 г этанола С2Н5ОН? Ответ 1 : 1 моль Ответ 2 : 2 моль Ответ 3 : 2.5 моль Ответ 4 : 1.5 моль
2. Определите массу глюкозы, содержащей 0,6 моль атомного углерода. Ответ 1 : 3,6 г Ответ 2 : 7,2 г Ответ 3 : 14,4 г Ответ 4 : 18 г
3. Определите массовую долю кислорода (в %) в метиловом спирте, состав которого выражен формулой СН3ОН. Ответ 1 : 50 Ответ 2 : 25 Ответ 3 : 15 Ответ 4 : 10
4. Какой объем водорода (н.у.) может присоединить смесь газов массой 15,4 г, которая содержит этилен ( = 54,5%), пропилен ( = 27,3%) и бутилен ( = 18,2%). Ответ 1 : 5 л Ответ 2 : 10 л Ответ 3 : 15 л Ответ 4 : 20 л
5. Природный газ одного из месторождений содержит метан ( = 92%), этан ( = 3%), пропан ( = 1,6%), бутан ( = 0,4%), азот ( = 2%), другие газы ( = 1%). Определите массу органических веществ, входящих в состав 20 л (н.у.) природного газа. Ответ 1 : 5,3 г Ответ 2 : 10,1 г Ответ 3 : 14,8 г Ответ 4 : 20,2 г
6. При сгорании алкана массой 3,6 г образуется оксид углерода (IV) объемом 5,6 л (н.у). Плотность алкана по водороду равна 36. Установите молекулярную формулу алкана. Ответ 1 : С2Н6 Ответ 2 : С3Н8 Ответ 3 : С4Н10 Ответ 4 : С5Н12
7. Вывести молекулярную формулу вещества, если оно содержит С ( = 39,97%), Н ( = 6,73%) и О ( = 53,3%) и 300 мл паров этого вещества (н.у.) имеют массу, равную 2,41 г. Ответ 1 : С12Н22О11 Ответ 2 : С6Н12О6 Ответ 3 : С2Н6О Ответ 4 : С3Н8О
8. Сколько г хлора потребуется для превращения 19 г бензола С6Н6 в гексахлоран С6Н6Сl6 ? Ответ 1 : 10,3 г Ответ 2 : 32,4 г Ответ 3 : 51,9 г Ответ 4 : 68,1 г
9. При нагревании иодметана СH3I массой 2,84 г с металлическим натрием массой 0,69 г получили этан С2Н6 объемом 179,2 мл при н.у. Определите объемную долю выхода продукта реакции. Ответ 1 : 60% Ответ 2 : 70% Ответ 3 : 80% Ответ 4 : 90%
10. Сколько граммов 80% - го технического карбида кальция CaC2 потребуется для получения 2,8 л ацетилена при н.у.? Ответ 1 : 10 г Ответ 2 : 20 г Ответ 3 : 30 г Ответ 4 : 40 г
11. Сколько граммов толуола С7Н8 потребуется для получения 113,5 г тринитротолуола С7Н5(NO2)3, если массовая доля выхода продукта составляет 80% от теоретически возможного? Ответ 1 : 35,4 г Ответ 2 : 64,3 г Ответ 3 : 81,2 г Ответ 4 : 93,4 г
12. Какую массу бромной воды с массовой доле брома 1,6% может обесцветить пропилен объемом 1,12 л (н.у.)? Ответ 1 : 200 г Ответ 2 : 300 г Ответ 3 : 400 г Ответ 4 : 500 г
13. Какой объем воздуха потребуется для сжигания 30 л ацетилена С2Н2 (н.у.), содержащего 5% негорючих примесей? Содержание кислорода в воздухе считать равным 20% по объему. Ответ 1 : 356,25 л Ответ 2 : 428,50 л Ответ 3 : 282,45 л Ответ 4 : 648,35 л
14. Сколько л водорода (н.у.) выделится при каталитическом дегидрировании 49 г метилциклогексана в толуол, если объемная доля выхода продукта равна 75% от теоретически возможного? Ответ 1 : 15,5 л Ответ 2 : 25,2 л Ответ 3 : 22,4 л Ответ 4 : 4,48 л
15*. При сгорании 13,44 л (н.у.) смеси монооксида углерода, метана и ацетилена образовалось 17,99 л СО2 (н.у.) и 9 г Н2О. Сколько литров каждого газа содержится в смеси? Ответ 1 : V(CO) = 10 л; V(CH4) = 1,72 л; V(C2H2) = 1,72 л Ответ 2 : V(CO) = 5,04 л; V(CH4) = 3,16 л; V(C2H2) = 5,24 л Ответ 3 : V(CO) = 2,5 л; V(CH4) = 3 л; V(C2H2) = 7,94 л Ответ 4 : V(CO) = 5 л; V(CH4) = 2,5 л; V(C2H2) = 4,94 л
16*.
При взаимодействии 11,2 г алкена с
бромоводородом получено 27,4 г вещества.
Напишите формулы всех возможных изомеров
алкена.
Ответ
1
:
![]() Ответ
2
:
Ответ
2
:
![]() Ответ
3
:
Ответ
3
:
![]() Ответ
4
:
Ответ
4
:
![]()
17*. Анализ смеси метана и ацетилена показал, что общее содержание углерода в смеси по массе равно 88, 46%. Определите состав смеси в % по массе. Ответ 1 : (CH4) = 30%; (C2H2) = 70% Ответ 2 : (CH4) = 25,5%; (C2H2) = 74,5% Ответ 3 : (CH4) = 20,8%; (C2H2) = 79,2% Ответ 4 : (CH4) = 40%; (C2H2) = 60%
18*. При сгорании 14,6 г хлорсодержащего органического вещества было получено 13,44 л СО2 и 3,6 г Н2О. Весь хлор, содержавшийся в навеске, вдвое меньшей, чем исходная, переведен в AgCl массой 14,3 г. Плотность по водороду исследуемого хлорорганического вещества равна 74. Определите молекулярную формулу этого вещества. Ответ 1 : C2H4Cl2 Ответ 2 : C4H8Cl2 Ответ 3 : C3H6Cl2 Ответ 4 : C6H4Cl2
19*. Какой объем хлороводорода может прореагировать с 15 г смеси, состоящей из триметиламина, пропиламина и метилэтиламина? Ответ 1 : 2,24 л Ответ 2 : 5,7 л Ответ 3 : 4,48 л Ответ 4 : 6,72 л
20*. При окислении одноатомного спирта m = 11,2 г кислородом воздуха в присутствии катализатора при 500°С образовалась кислота, на нейтрализацию которой потребовалось 59,4 мл 20% раствора КОН (=1,18 г/мл). Какова формула исходного спирта? Ответ 1 : C4H9ОН Ответ 2 : C3H7ОН Ответ 3 : C2H5ОН Ответ 4 : CH3ОН
