
- •5 Коррозия меди и ее сплавов, способы их защиты.
- •16 Влияние температуры, рН, скорости течения жидкости на коррозионные процессы
- •17 Виды коррозии по поражению поверхности металлов и сплавов
- •18) Структурная и компонентная коррозия
- •19 Влияние электрохимического потенциала на коррозионное разрушение металлов и сплавов
- •20) Влияние концентрации соляных растворов на скорость коррозии
- •8 Жидкостная химическая коррозия металлов
5 Коррозия меди и ее сплавов, способы их защиты.
Коррозия меди - это ее разрушение под воздействием окружающей среды. Медь обладает высокой коррозионной стойкостью, теплопроводностью, электропроводностью, отлично обрабатывается механически, пается. Значительная коррозия меди наблюдается в окислительных кислотах, аэрированных растворах, которые содержат NH4+? CN- и другие ионы, способные с медью образовывать комплексы.
Медь устойчива в средах: атмочфера, морская вода, в определенных условиях в контакте с галогенами, неокислительных кислотах.
Медь неустойчива в средах: сера, сероводород, окислительные кислоты, растворы окислительных солей тяжелых металлов (Fe2(SO4)3, FeCl3), быстро движущихся водных растворах (подвергается ударной коррозии), амины, NH4OH (содержащим кислород.
Скорость протекания ударной коррозии меди в воде сильно зависит от кол-ва растворенного кислорода, наличием на поверхности оксидных пленок.
На сухом воздухе поверхность меди почти не меняется. А при контакте с влажным воздухом образуется нерастворимая плнка, состоящая с продуктов коррозии меди типа CuCO3∙Cu(OH)2.
Коррозия меди в почве сильно зависит от значения pH грунта. Чем грунт щелочнее либо кислее, тем быстрее проходит коррозия меди в почве.При сильном насыщении почвы микроорганизмами усиливается коррозия меди и ее сплавов.
Луженная медь отличается превосходной коррозионной стойкостью. Качественное оловянное покрытие продлевается срок службы луженной меди до 100 лет и более.
16 Влияние температуры, рН, скорости течения жидкости на коррозионные процессы
Влияние концентрации ионов водорода в коррозионной среде на скорость коррозии металлов определяется или их непосредственным участием в электродном процессе, или их способностью влиять на растворимость продуктов коррозии, или возможностью образовывать защитные оксидные
пленки при изменении рН раствора. Увеличение концентрации ионов водорода влияет на скорость коррозии особенно сильно в том случае, когда процесс коррозии контролируется не диффузионными стадиями, а процессом разряда ионов водорода.
рН=-lg[H+] рН<7 – кислая рН=7 – нейтральная рН>7 – щелочная
Каждый Ме имеет свое оптимальное значение рН.
Р ис.1.
Влияние рН раствора на характер
зависимости скорости коррозии для
различных металлов:1 – железа; 2 –
благородных; 3 – цинка и алюминия; 4 –
никеля и кадмия.
ис.1.
Влияние рН раствора на характер
зависимости скорости коррозии для
различных металлов:1 – железа; 2 –
благородных; 3 – цинка и алюминия; 4 –
никеля и кадмия.
С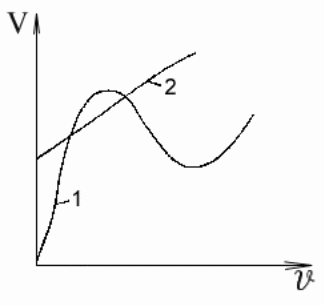 корость
движения агрессивной среды в значительной
степени определяет коррозионное
поведение металлов. С увеличением
скорости движения водопроводной воды,
не содержащей значительных количеств
солей, сначала происходит повышение
скорости коррозии железа
из-за увеличения
подвода кислорода к микрокатодам
поверхности (рис. 2, кривая 1).
Последующее снижение скорости коррозии
при достаточно быстром течении воды
объясняется тем, что обилие кислорода
приводит к пассивации анодных участков
(кислород выступает как замедлитель
коррозии). Наконец, при очень больших
скоростях движения воды снова наблюдается
увеличение скорости коррозии металла
вследствие эрозии, т. е. механического
разруше- ния защитных пленок или даже
структуры самого металла. При наличии
в растворе значительного количества
активных анионов пассивация может не
наступить, т. е. происходит постоянное
возрастание скорости коррозии металла
с увеличением скорости движения
коррозионной среды, например в морской
воде (рис. 2, кривая 2).
корость
движения агрессивной среды в значительной
степени определяет коррозионное
поведение металлов. С увеличением
скорости движения водопроводной воды,
не содержащей значительных количеств
солей, сначала происходит повышение
скорости коррозии железа
из-за увеличения
подвода кислорода к микрокатодам
поверхности (рис. 2, кривая 1).
Последующее снижение скорости коррозии
при достаточно быстром течении воды
объясняется тем, что обилие кислорода
приводит к пассивации анодных участков
(кислород выступает как замедлитель
коррозии). Наконец, при очень больших
скоростях движения воды снова наблюдается
увеличение скорости коррозии металла
вследствие эрозии, т. е. механического
разруше- ния защитных пленок или даже
структуры самого металла. При наличии
в растворе значительного количества
активных анионов пассивация может не
наступить, т. е. происходит постоянное
возрастание скорости коррозии металла
с увеличением скорости движения
коррозионной среды, например в морской
воде (рис. 2, кривая 2).
С повышением температуры скорость электрохимической коррозии, как правило, возрастает. Однако зависимость скорости коррозии от температуры довольно сложная, так как при этом приходится учитывать уменьшение растворимости кислорода с повышением температуры, изменение структуры образующихся продуктов коррозии и др. условий.
