
Вопрос 10.
Способы выражения концентрации растворов
Концентрация
– величина, выражающая относительное
содержание данного компонента в
растворе. Существуют следующие основные
способы выражения концентрации
растворов. Массовая
доля –
величина, показывающая, какую долю от
массы раствора составляет масса
растворенного вещества:
![]() или в процентах:
или в процентах:
![]() Массовая
доля растворенного вещества
показывает число г растворенного
вещества (mв)
в 100 г раствора (mр),
выражается в %:
Массовая
доля растворенного вещества
показывает число г растворенного
вещества (mв)
в 100 г раствора (mр),
выражается в %:
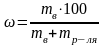
молярность – величина, показывающая, сколько молей растворенного вещества содержится в 1 литре раствора: Молярная концентрация (С) показывает число моль растворенного вещества (n) в 1 дм³ раствора (V): Молярная концентрация эквивалента – это число молей-эквивалентов растворенного вещества в 1 дм³ раствора (V): Общие свойства растворов Рассмотрим законы идеальных растворов неэлектролитов. Первый закон Рауля (1887): относительное понижение давления насыщенного пара растворителя над раствором нелетучего неэлектролита равно мольной доле растворенного вещества в растворе. Второй закон Рауля: абсолютное понижение температуры замерзания или абсолютное повышение температуры кипения разбавленных растворов неэлектролитов прямо пропорционально его моляльной концентрации Закон Вант-Гоффа: осмотическое давление растворенного вещества в разбавленном растворе равно тому газовому давлению, которое производило бы это вещество, если бы оно в виде газа при той же температуре, занимало бы тот же объем, что и раствор Активность (а) связана с концентрацией Его вычисляют по экспериментальным данным или, используя теоретические методы расчета, с некоторыми из них познакомимся далее. Таким образом, общие свойства растворов выражаются законами Рауля и Вант-Гоффа. В реальных растворах вместо концентраций используется активность.
Вопрос 11.
Теория электролитической диссоциации. Современное содержание этой теории можно свести к следующим трем положениям: 1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы - положительные и отрицательные. Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома - это простые ионы (Na+, Mg2+, Аl3+ и т.д.) - или из нескольких атомов - это сложные ионы (NО3-, SO2-4, РОЗ-4и т.д.). 2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицатель¬но заряженные - к аноду. Поэтому первые называются катионами, вторые - анионами. Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами. 3. Диссоциация - обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. Количественная характеристика диссоциации электролитов называется степенью диссоциации (обозначение α); для веществ-электролитов всегда больше нуля (α = 0 в случае неэлектролитов). Степень диссоциации может выражаться как в долях от 1, так и в процентах. Для сильных электролитов в водном растворе по определению α = 1: диссоциация таких электролитов протекает необратимо (до конца), и степень превращения растворенного вещества в ионы полная. Для слабых электролитов степень диссоциации (отношение молярной концентрации продиссоциировавшего вещества cд к общей концентрации вещества cB в растворе): α = cд / cB всегда меньше единицы, но больше нуля (0 < α < 1). При растворении в воде или других растворителях, состоящих из полярных молекул, электролиты подвергаются диссоциации, т.е. в большей или меньшей степени распадаются на положительно и отрицательно заряженные ионы – катионы и анионы. Электролиты можно поделить на две группы: слабые и сильные. Слабыми электролитами называют электролиты, диссоциирующие в растворах не полностью, т.е. не на сто процентов. В их растворах устанавливается равновесие между молекулами, которые подверглись диссоциации и продуктами их диссоциации – ионами. Для данной системы можно применить закон действующих масс. Для процесса диссоциации кислоты
НА Н+ + А-
Вопрос
12.Константа
равновесия КС
в общем виде равна
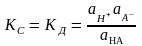 где аН+,
аА-,
аНА
– активность ионов и кислоты. Константа
равновесия для процесса диссоциации
называется
константой диссоциации КД.
Например, константа диссоциации уксусной
кислоты равна СH3COOH
CH3COO-
+ H+
где аН+,
аА-,
аНА
– активность ионов и кислоты. Константа
равновесия для процесса диссоциации
называется
константой диссоциации КД.
Например, константа диссоциации уксусной
кислоты равна СH3COOH
CH3COO-
+ H+
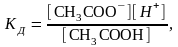 где в
квадратных скобках указаны равновесные
концентрации. Для
процесса диссоциации слабого основания
ROH
R+
+ OH-
Константа
диссоциации равна
где в
квадратных скобках указаны равновесные
концентрации. Для
процесса диссоциации слабого основания
ROH
R+
+ OH-
Константа
диссоциации равна
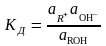 Для слабых электролитов константа
диссоциации зависит от природы
диссоциирующего вещества и растворителя,
температуры, но не зависит от концентрации.
Константа диссоциации является
характеристикой силы электролита. По
величине константы диссоциации слабые
электролиты делятся на умеренно слабые
(КД = 10-2
– 10-4),
слабые (КД
= 10-5 –
10-9)
и очень слабые (КД
≤ 10-10).
Чем константа диссоциации соединения
больше, тем сильнее данный электролит.
Константа диссоциации имеет постоянное
значение (при данной температуре) только
для слабых электролитов. Для многоосновных
слабых электролитов константа диссоциации
расписывается для каждой ступени
диссоциации. Для расчетов удобно
пользоваться не константой диссоциации
КД,
а показателем
константы диссоциации
рК, который
представляет собой отрицательный
десятичный логарифм КД:
рК = -lgКД
Если степень диссоциации значительно
меньше единицы, то при приближенных
вычислениях можно принять, что (1-α)
1. При разбавлении раствора (т. е. при
уменьшении концентрации электролита
С) степень диссоциации электролита
возрастает.
Для слабых электролитов константа
диссоциации зависит от природы
диссоциирующего вещества и растворителя,
температуры, но не зависит от концентрации.
Константа диссоциации является
характеристикой силы электролита. По
величине константы диссоциации слабые
электролиты делятся на умеренно слабые
(КД = 10-2
– 10-4),
слабые (КД
= 10-5 –
10-9)
и очень слабые (КД
≤ 10-10).
Чем константа диссоциации соединения
больше, тем сильнее данный электролит.
Константа диссоциации имеет постоянное
значение (при данной температуре) только
для слабых электролитов. Для многоосновных
слабых электролитов константа диссоциации
расписывается для каждой ступени
диссоциации. Для расчетов удобно
пользоваться не константой диссоциации
КД,
а показателем
константы диссоциации
рК, который
представляет собой отрицательный
десятичный логарифм КД:
рК = -lgКД
Если степень диссоциации значительно
меньше единицы, то при приближенных
вычислениях можно принять, что (1-α)
1. При разбавлении раствора (т. е. при
уменьшении концентрации электролита
С) степень диссоциации электролита
возрастает.
Билет №13
Рассмотрим
произведение
растворимости
соединений. В насыщенном растворе
малорастворимого электролита
устанавливается равновесие между
осадком (твердой фазой) электролита и
ионами электролита в растворе например:
ВаSO4
Ва+2
+ SO4-2
в осадке в
растворе Поскольку в растворах
электролитов состояние ионов определяется
их активностями, то константа равновесия
последнего процесса имеет вид:
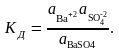 Активность
твердого сульфата бария есть величина
постоянная, а,
следовательно,
произведение КДаВаSO4
тоже является при данной температуре
константой. Отсюда следует, что
произведение активностей ионов Ва+2
и SO4-2
так
же представляет собой постоянную
величину, называемую произведением
растворимости (ПР):а(Ва+2)а(SO4-2)
= ПР(ВаSO4)
= 1,08.10-10
Произведение
активностей ионов малорастворимого
электролита содержащихся в его насыщенном
растворе (произведение растворимости)
есть величина постоянная при данной
температуре – это правило
произведения растворимости.
Если электролит
очень мало растворим, то ионная сила
его насыщенного раствора близка к нулю,
а коэффициенты активности ионов мало
отличаются от единицы. В подобных
случаях произведение активностей ионов
в уравнении (7.32) можно заменить
произведением их концентраций: ПРВаSO4
= [Ba+2][SO4-2]
Если какой-либо трудно растворимый
электролит диссоциирует с образованием
нескольких одинаковых ионов (например,
КnАm
nК+m
+ mА-n),
то уравнение для ПР примет вид: ПР(КnАm)
= (а(К+m))n
(а(А-n))m
С учетом
того, что а = С
(
– коэффициент активности): ПР(КnАm)
= (nС(К+m))n
(mС(А-n))m
При увеличении
концентрации одного из ионов электролита
в его насыщенном
растворе (например, путем введения
другого электролита, содержащего тот
же ион) произведение концентраций ионов
электролита станет больше ПР. При этом
равновесие между твердой средой и
раствором смещается в сторону образования
осадка. Таким образом, условием
образования осадка является концентрация
ионов малорастворимого электролита
над его произведением растворимости.
В результате осадка концентрация
другого иона, входящего в состав
электролита, тоже изменяется.
Устанавливается новое равновесие, при
котором произведение
концентраций ионов электролита вновь
становится равным ПР. Напротив, если в
насыщенном растворе электролита
уменьшить концентрацию одного из ионов
(например, связав его каким-либо ионом),
произведение концентраций ионов будет
меньше значения ПР, раствор станет
ненасыщенным, а его равновесие между
жидкой фазой и осадком сместится в
сторону растворения осадка. Следовательно,
равновесие осадка малорастворимого
электролита происходит при условии,
что произведение концентраций ионов
меньше значения ПР. Исходя из значений
ПР, можно вычислить растворимость
малорастворимых электролитов в воде
и растворах, содержащих другие
электролиты. Значения ПР для большинства
электролитов – табличные величины.
Закон действующих масс применяют также
при рассмотрении равновесий с участием
комплексных ионов и при гидролизе
солей.
Активность
твердого сульфата бария есть величина
постоянная, а,
следовательно,
произведение КДаВаSO4
тоже является при данной температуре
константой. Отсюда следует, что
произведение активностей ионов Ва+2
и SO4-2
так
же представляет собой постоянную
величину, называемую произведением
растворимости (ПР):а(Ва+2)а(SO4-2)
= ПР(ВаSO4)
= 1,08.10-10
Произведение
активностей ионов малорастворимого
электролита содержащихся в его насыщенном
растворе (произведение растворимости)
есть величина постоянная при данной
температуре – это правило
произведения растворимости.
Если электролит
очень мало растворим, то ионная сила
его насыщенного раствора близка к нулю,
а коэффициенты активности ионов мало
отличаются от единицы. В подобных
случаях произведение активностей ионов
в уравнении (7.32) можно заменить
произведением их концентраций: ПРВаSO4
= [Ba+2][SO4-2]
Если какой-либо трудно растворимый
электролит диссоциирует с образованием
нескольких одинаковых ионов (например,
КnАm
nК+m
+ mА-n),
то уравнение для ПР примет вид: ПР(КnАm)
= (а(К+m))n
(а(А-n))m
С учетом
того, что а = С
(
– коэффициент активности): ПР(КnАm)
= (nС(К+m))n
(mС(А-n))m
При увеличении
концентрации одного из ионов электролита
в его насыщенном
растворе (например, путем введения
другого электролита, содержащего тот
же ион) произведение концентраций ионов
электролита станет больше ПР. При этом
равновесие между твердой средой и
раствором смещается в сторону образования
осадка. Таким образом, условием
образования осадка является концентрация
ионов малорастворимого электролита
над его произведением растворимости.
В результате осадка концентрация
другого иона, входящего в состав
электролита, тоже изменяется.
Устанавливается новое равновесие, при
котором произведение
концентраций ионов электролита вновь
становится равным ПР. Напротив, если в
насыщенном растворе электролита
уменьшить концентрацию одного из ионов
(например, связав его каким-либо ионом),
произведение концентраций ионов будет
меньше значения ПР, раствор станет
ненасыщенным, а его равновесие между
жидкой фазой и осадком сместится в
сторону растворения осадка. Следовательно,
равновесие осадка малорастворимого
электролита происходит при условии,
что произведение концентраций ионов
меньше значения ПР. Исходя из значений
ПР, можно вычислить растворимость
малорастворимых электролитов в воде
и растворах, содержащих другие
электролиты. Значения ПР для большинства
электролитов – табличные величины.
Закон действующих масс применяют также
при рассмотрении равновесий с участием
комплексных ионов и при гидролизе
солей.
Билет №14
Рассмотрим
ионное
произведение воды.
Химически чистая вода является очень
слабым электролитом, который при
диссоциации образует ионы водорода
(Н+)
и гидроксид-ионы (ОН-):
Н2О
Н+
+ ОН-.
Этому процессу соответствует константа
диссоциации
 Поскольку степень диссоциации воды
мала, то активность ионов в уравнении
могут быть заменены их концентрациями,
а концентрацию не распавшихся ионов
можно считать равной общей концентрации
молекул воды и считать ее постоянной
величиной. Поэтому уравнение можно
записать в виде: КД[Н2О]
= [H+][OH-]
= КW
где КW
– ионное произведение воды. При 295 К КW
= 10-14,
поэтому [H+]
= [OH-]
= 10-7
моль/дм³. С увеличением температуры КW
увеличивается. Если прологарифмировать
уравнение и умножить на -1, то получим
-рКW
= рН + рОН = 14. где рКW
– показатель ионного произведения
воды; рН – водородный показатель или
кислотность раствора; рОН – показатель
гидроксид-ионов. Величина рН используется
для определения характера реакции
раствора. Если рН = 7, то реакция
нейтральная; если рН < 7, то реакция
среды кислая; если рН > 7, то реакция
щелочная. Величина
рН может служить критерием силы кислоты
или основания. В ряду кислот более
сильной будет та, у которой при одинаковой
молярной концентрации активность ионов
Н+
выше (рН ниже). Для оснований подобная
зависимость имеет обратный характер.
Поскольку степень диссоциации воды
мала, то активность ионов в уравнении
могут быть заменены их концентрациями,
а концентрацию не распавшихся ионов
можно считать равной общей концентрации
молекул воды и считать ее постоянной
величиной. Поэтому уравнение можно
записать в виде: КД[Н2О]
= [H+][OH-]
= КW
где КW
– ионное произведение воды. При 295 К КW
= 10-14,
поэтому [H+]
= [OH-]
= 10-7
моль/дм³. С увеличением температуры КW
увеличивается. Если прологарифмировать
уравнение и умножить на -1, то получим
-рКW
= рН + рОН = 14. где рКW
– показатель ионного произведения
воды; рН – водородный показатель или
кислотность раствора; рОН – показатель
гидроксид-ионов. Величина рН используется
для определения характера реакции
раствора. Если рН = 7, то реакция
нейтральная; если рН < 7, то реакция
среды кислая; если рН > 7, то реакция
щелочная. Величина
рН может служить критерием силы кислоты
или основания. В ряду кислот более
сильной будет та, у которой при одинаковой
молярной концентрации активность ионов
Н+
выше (рН ниже). Для оснований подобная
зависимость имеет обратный характер.
Билет №15
Термодинамика – наука, изучающая превращения различных форм энергии друг в друга и устанавливающая законы этих превращений. Теплота (Q) – это внешнее проявление энергообмена частиц в результате хаотичных столкновений между ними. Горячие частицы сталкиваются с холодными и отдают им часть энергии. Это происходит до тех пор, пока полностью не выравнивается энергия между частицами. Ее выражают в Дж/моль или Дж/кг. В термодинамике теплоту, поглощаемую системой, пишут со знаком плюс, а выделяемую – со знаком минус (в термохимии принята противоположная система знаков). Работа (А) – это перенос энергии движущейся материей. Формы ее различны: механическая работа, электрическая и т.д. Работу выражают в Дж и считают положительной, если она совершается системой над окружающей средой или над другой системой, и отрицательной, если внешние силы совершают работу над системой. Понятие теплоты и работы справедливо только для тел, состоящих из множества молекул. Для одной молекулы, либо для совокупности немногих молекул понятия теплоты и работы теряют смысл. Внутренняя энергия (U) – это энергия, которая в скрытом виде заключена в каждом теле и зависит от его внутреннего состояния. Это та энергия, которая в общем случае представляет собой полный запас энергии тела. Эту энергию можно представить в виде суммы отдельных составляющих: 1) энергии поступательного движения молекул; 2) энергии вращательных движений молекул; 3) энергии внутримолекулярных колебаний атомов; 4) энергии взаимодействия электронов с ядром; 5) внутриядерной энергии; 6) энергии взаимодействия молекул (потенциальной энергии) Первый закон термодинамики. Первый закон имеет несколько равноценных формулировок, но все они выражают и ту же суть: неуничтожимость и эквивалентность энергии при взаимных переходах различных ее видов друг в друга. Другая формулировка: в изолированной системе сумма всех видов энергии есть величина постоянная.
Билет №16
Термохимия. Тепловые эффекты химических реакций
Любые химические процессы, а также ряд физических превращений веществ (испарение, плавление) всегда сопровождаются изменением запаса внутренней энергии систем. Термохимия – это раздел химии, который занимается изучением изменения количества теплоты в ходе протекания процесса. Тепловым эффектом химической реакции называется теплота, которая выделяется или поглощается в ходе химической реакции. Стандартным тепловым эффектом химической реакции называется теплота, которая выделяется или поглощается в ходе химической реакции при стандартных условиях. Все химические процессы можно разделить на две группы: экзотермические и эндотермические. Экзотермические – это реакции, при которых происходит выделение теплоты в окружающую среду. При этом запас внутренней энергии исходных веществ больше, чем образующихся продуктов. Эндотермические это реакции, при которых происходит поглощение теплоты из окружающей среды. При этом запас внутренней энергии исходных веществ меньше, чем образующихся продуктов. Изохорным (QV) тепловым эффектом называют количество теплоты, которое выделяется или поглощается в ходе данного процесса при постоянном объеме (V = const) и равенстве температур конечного и начального состояния (Т1 = Т2). Изобарным (Qр) тепловым эффектом называют количество теплоты, которое выделяется или поглощается в ходе данного процесса при постоянном давлении (р = const) и равенстве температур конечного и начального состояния (Т1 = Т2). Теплотой образования данного соединения называется количество выделяющейся или поглотившейся теплоты при образовании 1 моля его из простых веществ в кДж. Теплоты образования простых веществ, находящихся при стандартных условиях в устойчивом состоянии, принимают за нуль Теплотой сгорания называется теплота, выделяющаяся при полном сгорании 1 моля вещества в токе кислорода. Закон Гесса Г. И. Гессом был открыт основной закон термохимии – закон постоянства сумм теплот реакций (закон Гесса): суммарный тепловой эффект реакции не зависит от промежуточных состояний и пути перехода, а зависит только от начального и конечного состояний системы. Закон Гесса точен при условии, что все процессы протекают либо при постоянном объеме, либо при постоянном давлении. Закон Гесса является частной формулировкой закона сохранения энергии и первого закона термодинамики применительно к химическим процессам.
Билет №17
Основные формулировки второго закона термодинамики
Первый закон термодинамики характеризует количественное и качественное преобразование внутренней энергии, но не позволяет определить возможность и направленность химического процесса.Второй закон термодинамики устанавливает, какие из процессов в системе при данных условиях могут протекать самопроизвольно, то есть, без затраты энергии извне; позволяет определить, каков предел самопроизвольного течения процесса; какая полезная работа при этом может быть получена и каковы должны быть внешние условия, чтобы процесс мог протекать в нужном направлении и требуемой степени. Основные формулировки второго начала термодинамики: Постулат Клаузиуса: теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому. Формулировка Оствальда: вечный двигатель второго рода невозможен, то есть, невозможен процесс, единственным результатом которого было бы превращение теплоты в работу. Формулировка Планка: невозможно построить такую машину, действия которой сводились бы к производству работы только за счет соответствующего охлаждения теплового источника. Постулат Планка: любая форма энергии может полностью преобразовываться в теплоту, но теплота преобразуется в другие виды энергии лишь частично. Второй закон термодинамики носит статистический характер, т. е. справедлив лишь для систем, состоящих из большого числа частиц. Энтропия – это термодинамическая функция состояния, которая служит мерой неупорядоченности (беспорядка) состояния системы. Состояние системы можно характеризовать микросостояниями составляющих ее частиц, то есть, их мгновенными координатами и скоростями различных видов движения в различных направлениях. Число микросостояний системы называется термодинамической вероятностью системы (W). Для одного моля вещества S = RlnW, поэтому энтропия имеет ту же размерность, что и молярная постоянная R – Дж/(мольК). В отличие от других термодинамических функций, можно определить не только изменение, но и абсолютное значение энтропии. Это вытекает из постулата М. Планка (1911), получившего название третьего закона термодинамики: при абсолютном нуле энтропия идеального кристалла равна нулю. Именно поэтому в справочной литературе для стандартных условий приведены величины S0 любого вещества. Для систем, которые не обмениваются с окружающей средой ни веществом, ни энергией справедливо: в изолированных системах самопроизвольно идут только такие процессы, которые сопровождаются возрастанием энтропии: S > 0. Это одна из формулировок второго начала термодинамики. Химические реакции не бывают изолированными, так как они сопровождаются изменением внутренней энергии системы (тепловым эффектом реакции) и могут протекать самопроизвольно без возрастания энтропии, но при этом увеличивается энтропия окружающей среды. Для реакции общего вида аA + вB = сC + dD + ∆S0реакции изменение энтропии реакции при стандартных условиях равно: ∆S0реакции = (сS0C + d S0D) – (аS0А + вS0B). В общем случае, если S 0, то процесс идет самопроизвольно в прямом направлении; если S 0, то процесс идет самопроизвольно в обратном направлении; если S = 0, то это состояние равновесия и система достигает максимума энтропии. Таким образом, в химических процессах проявляется две тенденции: а) стремление к образованию прочных связей между частицами, к возникновению более сложных веществ сопровождающееся понижением энергии системы (U или Н); б) стремление к разъединению частиц, к беспорядку, характеризуемое возрастанием энтропии (S).
Билет №18
Энергия Гиббса
Энергия Гиббса – это максимальная работа, которую может совершить система при равновесном проведении процесса при постоянных давлении и температуре, то есть, в изобарно-изотермических условиях. Используя аналитическое выражение первого закона термодинамики, с учетом того, что А = рV, получаем Gp,T = Н – ТS или Gp,T = Н – ТS Энергия Гиббса служит критерием самопроизвольного протекания химической реакции при изобарно-изотермических процессах. Химическая реакция принципиально возможна, если G (F) 0. Уравнение является условием возможности самопроизвольного течения реакции в прямом направлении. Химическая реакция не может протекать самопроизвольно, если свободная энергия возрастает G (F) 0 Уравнение является условием невозможности самопроизвольного течения реакции в прямом направлении, но служит термодинамическим условием возможности самопроизвольного протекания обратной реакции. Наконец, если G (F) = 0 то реакция может протекать как в прямом, так и в обратном направлениях, то есть, реакция обратима. Таким образом, энергия Гиббса зависит от характера реакций, а для многих реакций – и от температуры. Зная величины (U) и S, можно рассчитать и, соответственно, предсказать возможность или невозможность самопроизвольного течения реакции, а также влияние температуры на направление процесса.
Билет№ 19
Факторы,
влияющие на скорость химических реакций.
Закон действующих массНа
скорость химических реакций оказывают
влияние следующие факторы: природа и
концентрации реагирующих веществ;
температура, природа растворителя,
присутствие катализатора и т.д.
Зависимость скорости химических реакций
от концентрации устанавливает закон
действующих (действия) масс,
сформулированный Гульдбергом и Вааге
(1867), этот закон и является основным
законом кинетики: скорость химической
реакции при постоянной температуре
пропорциональна произведению концентраций
реагирующих веществ, взятых в степени
стехиометрического коэффициента
данного вещества в уравнении реакции.
Для гомогенной реакции общего вида аA
+ вB
→ сC
+ dD
пр
= k1CАа
CВв,
обр
= k2Cсс
CDd,
где пр
– скорость прямой реакции; обр
– скорость
обратной реакции; СА,CB,CC
и CD
– концентрации
реагирующих веществ, например, моль/дм3;
а, в, с,
и d
–
стехиометрические коэффициенты
участников реакции; k1
и k2
– коэффициенты пропорциональности,
названные константой скорости химической
реакции. Для газов вместо концентрации
можно использовать давления пр
= k1РАа
РВв.
Определим физический смысл константы
скорости. Примем концентрации веществ
А и В равными 1 моль/дм3
(СА
= CB
= 1 моль/дм3),
тогда пр
= k1.
Таким образом, константа
скорости
– это
скорость реакции, если концентрации
реагирующих веществ равны 1 моль/дм3.
Константа скорости зависит от тех же
факторов, что и скорость, за исключением
концентрации веществ. Причем, чем больше
величина константы скорости, тем больше
скорость процесса. Константу скорости
можно найти опытным путем или посчитать,
используя уравнения, описывающие
механизм химической реакции. Зависимость
константы скорости (и скорости) процесса
от температуры определяет приближенное
правило Вант-Гоффа:
увеличение температуры на каждые 10 ОС
увеличивает скорость процесса в 2 - 4
раза. Аналитическое выражение этого
правила в общем виде:
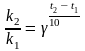 где k1
и k2
– константы скорости при температуре
t1
и
t2,
γ – температурный коэффициент Вант-Гоффа
(γ = 2
4). Правило Вант-Гоффа применяют при
изменении температуры ниже 30 ºС. При
более высоких изменениях температуры
используют уравнение Аррениуса lnk
= B
–
где k1
и k2
– константы скорости при температуре
t1
и
t2,
γ – температурный коэффициент Вант-Гоффа
(γ = 2
4). Правило Вант-Гоффа применяют при
изменении температуры ниже 30 ºС. При
более высоких изменениях температуры
используют уравнение Аррениуса lnk
= B
–
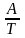 ,где
А и В – постоянные величины для данной
реакции. Скорость
гетерогенных реакций
имеет ряд особенностей. Гетерогенные
реакции идут на поверхности раздела
фаз, которая и служит реакционным
пространством (поверхностью). Поэтому
первой
особенностью
кинетики этих реакций является влияние
площади реакционной поверхности на
скорость реакции. Вместо концентрации
твердой фазы в уравнение вводят площадь
поверхности этого вещества (S)
пр
= k1CАа
SВ
Второй
особенностью
гетерогенных процессов является
зависимость скорости реакции от скорости
подвода реагента в зону химической
реакции, то есть, от скорости диффузии
реагентов. Скорость диффузии увеличивают
перемешиванием реакционной среды.
Скорость гетерогенной обратимой реакции
определяется разностью скоростей
прямой и обратной реакции (реакции
= пр
- обр)
– это
третья
особенность
гетерогенных процессов.
,где
А и В – постоянные величины для данной
реакции. Скорость
гетерогенных реакций
имеет ряд особенностей. Гетерогенные
реакции идут на поверхности раздела
фаз, которая и служит реакционным
пространством (поверхностью). Поэтому
первой
особенностью
кинетики этих реакций является влияние
площади реакционной поверхности на
скорость реакции. Вместо концентрации
твердой фазы в уравнение вводят площадь
поверхности этого вещества (S)
пр
= k1CАа
SВ
Второй
особенностью
гетерогенных процессов является
зависимость скорости реакции от скорости
подвода реагента в зону химической
реакции, то есть, от скорости диффузии
реагентов. Скорость диффузии увеличивают
перемешиванием реакционной среды.
Скорость гетерогенной обратимой реакции
определяется разностью скоростей
прямой и обратной реакции (реакции
= пр
- обр)
– это
третья
особенность
гетерогенных процессов.
Билет №20
Теория активизации молекул. Уравнение Аррениуса
Скорость любой химической реакции зависит от числа столкновений реагирующих молекул, так как число столкновения пропорционально концентрациям реагирующих веществ. Однако не все столкновения молекул приводят их взаимодействия, а повышение температуры на 10 0С приводит к увеличению скорости в 2-4 разакак. Очевидно, что скорость реакции зависит не только от числа столкновений, но и от каких-то свойств сталкивающихся молекул. Это явление находит объяснение в теории активации С. Аррениуса (1889). Согласно этой теории, реакционноспособны только те молекулы, которые обладают запасом энергии, необходимым для осуществления той или иной реакции, то есть, избыточной энергией по сравнению со средней величиной энергии молекул. Такие молекулы получили название «активных» молекул. Переход неактивной молекулы в активную называется активацией. А избыточная энергия активной молекулы, благодаря которой становится возможной химическая реакция, носит название энергии активации (Ea). Единица измерения Ea Дж/моль или кДж/моль. Энергия активации бывает меньше энергии разрыва связей в молекуле, так как для того чтобы молекула прореагировала, вовсе не требуется полного разрыва связей, их достаточно лишь ослабить. Величина энергии активации зависит от того, в какую реакцию эта молекула вступает. Иными словами, каждая химическая реакция характеризуется свойственной ей величиной энергии активации. Если реакция идет между атомами или свободными радикалами, то обычно она не превышает 40 кДж/моль, а если между молекулами, то – 150-250 кДж/моль, в полимерах она может достигать 400 кДж/моль. Если Ea выше наибольшей величины, то такая реакция невозможна. Энергия активации молекул может быть снижена под воздействием внешних факторов: повышение температуры, лучистой энергии, катализаторов и др. Энергия активации проявляется в активных молекулах по-разному: активные молекулы могут обладать большей скоростью движения, повышенной энергией колебания атомов в молекуле и др. Следовательно, скорость химической реакции зависит от величины энергии активации: чем она больше, тем медленнее будет протекать данная реакция. Особенности каталитических реакций. Теории катализа Скорость химической реакции можно регулировать с помощью катализатора. Вещества, которые участвуют в реакциях и изменяют (чаще всего увеличивают) ее скорость, оставаясь к концу реакции в первоначальном виде и количестве, называются катализаторами. Само изменение скорости химической реакции в присутствии катализаторов получило название катализа. Если от добавления катализатора к реагирующей смеси скорость реакции увеличивается, катализ называют положительным, если же реакция замедляется, то катализ называют отрицательными, а катализатор ингибитором. Катализаторами могут быть самые разнообразные вещества в любом из трех агрегатных состояний: кислоты, соли, основания, оксиды, металлы, их атомы, молекулы или ионы, различные органические и органоминеральные соединения, газообразные вещества. В ряде случаев каталитическое действие оказывают всевозможные примеси (например, пыль), поверхность стенок сосуда, а также продукты реакции. Катализ идет за счет перераспределения химических связей или сил электростатического взаимодействия участников реакции, механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений или образования активированного комплекса, при этом скорость процесса увеличивается в 2-3 раза. Участие катализатора в реакции не отражается на стехиометрических коэффициентах и величине теплового эффекта химической реакции, а по сравнению с массой реагирующих веществ масса катализатора мала, но к концу реакции он выделяется в неизменном виде. Катализатор в одинаковой мере действует как на скорость прямой, так и обратной реакции. Он ускоряет лишь наступление состояния химического равновесия.
Билет №21
Обратимые и не обратимые реакции. Признаки химического равновесия Все реакции можно поделить на две группы: обратимые и необратимые. Необратимые реакции сопровождаются выпадением осадка, образованием малодиссоциирующего вещества или выделением газа. Обратимые реакции никогда не доходят до конца, то есть, до полного исчезновения исходных веществ и превращения их в продукты реакции. Пределом протекания обратимых реакций при заданных условиях является достижение состояния химического равновесия, которое характеризуется следующими основными признаками: 1) в момент химического равновесия скорость протекания прямой реакции равна скорости протекания обратной реакции, а концентрации всех участвующих веществ в этой реакции достигают определенного значения и называются равновесными. Равновесные концентрации остаются неизменными сколь угодно долго при постоянных внешних условиях; 2) химическое равновесие подвижно, т. е. незначительное изменение внешних условий (температуры, давления или концентрации) приводит к сдвигу химического равновесия. Однако через некоторое время устанавливается новое состояние равновесия, которое отвечает измененным внешним условиям; 3) к одному и тому же химическому равновесию можно подойти с двух сторон: осуществляя процесс слева направо и наоборот. Если внешние условия в обоих случаях одинаковы, то и равновесные концентрации будут между собой равны; 4) в момент достижения химического равновесия запас свободной энергии минимален, а энтропия достигает своего максимального значения, изменение этих функций будет равно нулю (F = 0 или G = 0, S = 0). Переход системы из равновесного состояния в неравновесное всегда сопровождается увеличением свободной энергии и понижением устойчивости системы. Константа равновесия показывает во сколько раз скорость прямой реакции больше или меньше скорости обратной реакции. Константа равновесия – это отношение произведения равновесных концентраций продуктов реакции, взятых в степени их стехиометрических коэффициентов к произведению равновесных концентраций исходных веществ, взятых в степени их стехиометрических коэффициентов. Величина константы равновесия зависит от природы реагирующих веществ и температуры, и не зависит от концентрации в момент равновесия, поскольку их отношение – всегда величина постоянная, численно равная константе равновесия.
Билет №22
Факторы, влияющие на химическое равновесие. Принцип Ле-Шателье
При внешнем воздействии на систему происходит смещение химического равновесия, т. е. изменяются равновесные концентрации исходных веществ и продуктов реакции. Если в результате внешнего воздействия увеличиваются равновесные концентрации продуктов реакции, то говорят о смещении равновесия вправо (в сторону прямой реакции). Если вследствие внешнего воздействия увеличиваются равновесные концентрации исходных веществ, то говорят о смещении равновесия влево (в сторону обратной реакции). Влияние различных факторов на смещение химического равновесия отражает принцип Ле-Шателье: если на систему, находящуюся в устойчивом химическом равновесии воздействовать извне, изменяя температуру, давление или концентрацию, то химическое равновесие смещается в том направлении, при котором эффект произведенного воздействия уменьшается. Необходимо отметить, что катализатор не смещает химическое равновесие, а только ускоряет его наступление. Рассмотрим влияние каждого фактора на смещение химического равновесия для реакции общего вида: аA + вB = сC + dD Q. Влияние изменения концентрации. Согласно принципу Ле-Шателье, увеличение концентрации одного из компонентов равновесной химической реакции приводит к сдвигу равновесия в сторону усиления той реакции, при которой происходит химическая переработка этого компонента. И наоборот, уменьшение концентрации одного из компонентов приводит к сдвигу равновесия в сторону образования этого компонента. Таким образом, увеличение концентрации вещества А или В смещает равновесие в прямом направлении; увеличение концентрации вещества С или D смещает равновесие в обратном направлении; уменьшение концентрации А или В смещает равновесие в обратном направлении; уменьшение концентрации вещества С или D смещает равновесие в прямом направлении. (Схематично можно записать: CА или CВ ; CС или CD ; CА или CВ ; CС или CD ). Влияние температуры. Общее правило, определяющее влияние температуры на равновесие, имеет следующую формулировку: повышение температуры способствует сдвигу равновесия в сторону эндотермической реакции (- Q); понижение температуры способствует сдвигу равновесия в сторону экзотермической реакции (+ Q). Реакции, протекающие без тепловых эффектов, не смещают химического равновесия при изменении температуры. Повышение температуры в этом случае приводит лишь к более быстрому установлению равновесия, которое было бы достигнуто в данной системе и без нагревания, но за более длительное время. Таким образом, в экзотермической реакции (+ Q) увеличение температуры приводит к сдвигу равновесия в обратном направлении и, наоборот, в эндотермической реакции (- Q) увеличение температуры приводит к сдвигу в прямом направлении, а уменьшение температуры – в обратном направлении. (Схематично можно записать: при +Q Т ; Т ; при -Q Т ; Т ). Влияние давления. Как показывает опыт, давление оказывает заметное влияние на смещение только тех равновесных реакций, в которых участвуют газообразные вещества, и при этом изменение числа молей газообразных участников реакции (n) не равно нулю. При увеличении давления равновесие смещается в сторону той реакции, которая сопровождается образованием меньшего количества молей газообразных веществ, а при понижении давления – в сторону образования большего количества молей газообразных веществ. Таким образом, если n = 0, то давление не влияет на смещение химического равновесия; если n < 0, то увеличение давления смещает равновесие в прямом направлении, уменьшение давления в сторону обратной реакции; если n > 0, то увеличение давления смещает равновесие в обратном направлении, а уменьшение давления – в сторону прямой реакции. Принцип Ле-Шателье применим как к гомогенным, так и к гетерогенным системам и дает качественную характеристику сдвига равновесия.
Билеты №23
Особенности окислительно-восстановительных процессов
ри окислительно-восстановительных реакциях происходит изменение степени окисления вещества. Реакции можно разделить на те, которые проходят в одном реакционном объеме (например, в растворах) и разных (электрохимические). Под степенью окисления вещества (СО) понимают воображаемый заряд атома в соединении, вычисленный, исходя из предположения, что соединение состоит из ионов. Определение степени окисления проводят, используя следующие правила: 1.Степень окисления (СО) элемента в простом веществе равна нулю 2.СО элемента в виде одноатомного иона в соединении, имеющим ионное строение, равна заряду иона. 3. В соединениях с ковалентными полярными связями отрицательный заряд относят к более ЭО элементу, причем принимают следующие степени окисления: Большинство элементов могут проявлять переменную степень окисления в зависимости от положения элемента в периодической системе, и связано с электронным строением атома. Любая окислительно-восстановительная реакция состоит из процессов окисления и восстановления. Окисление – это процесс отдачи электронов веществом, т. е. повышение его степени окисления, вещество при этом называют восстановителем. Восстановление – это процесс присоединения электронов к веществу, т. е. понижение его степени окисления и вещество при этом называется окислителем. Окислительно-восстановительные реакции условно можно разделить на четыре группы: 1) Межмолекулярные реакции: в них окислителем и восстановителем являются разные вещества, простые и сложные: K2Cr2+6O7 + 3K2S+4O3 + 4H2SO4 = Cr2+3(SO4)3 + 4K2S+6O4 + 4H2O В этой реакции окислителем является дихромат калия (K2Cr2+6O7), а восстановителем – сульфит калия (K2S+4O3). 2) составляют внутримолекулярные реакции, которые протекают с изменением степени окисления атомов в одной и той же молекуле: (N-3H4)2Cr2+6O7 = N20 + Cr2+3O3 + 4H2O Окислителем является хром, изменяющий степень окисления от +6 до +3, а восстановителем служит азот, степень окисления которого меняется от –3 до 0. 3) относятся реакции диспропорционирования (дисмутации), в которых атомы одного и того же элемента в реагенте окисляются и восстанавливаются: 4KCl+5O3 = 3KCl+7O4 + KCl-1 При термическом разложении бертолетовой соли (KclO3) часть атомов хлора восстанавливается, изменяя степень окисления от +5 до –1, а другая окисляется от +5 до +7. 4) группе относят реакции синпропорционирования (конмутации), в которых атомы одного и того же элемента разных реагентов в результате их окисления и восстановления получают одинаковую степень окисления: 2H2S-2 + S+4О2 = 3S0 + 2H2О В данном случае сера, входящая в состав сероводорода понизила степень окисления с – 2 до 0 и является восстановителем, входящая в оксид серы, увеличила степень окисления с + 4 до 0, т. е. является окислителем. Окислительно-восстановительные реакции играют важную роль в природе и технике. Они могут как наносить огромный ущерб природе и человеку, так и приносить пользу. Примерами первых процессов служат коррозия металлов, лесные пожары, окисление азота при сжигании топлива, образование чрезвычайно токсичных диоксидов. Положительным примером использования окислительно-восстановительных реакций служат реакции получения металлов, органических и неорганических соединений, проведение анализа различных веществ, очищения многих веществ, природных и сточных вод, газообразных выбросов электростанций и заводов и т.п
Билет №25
Гальваническим элементом называют электрохимическую систему, в которой за счет протекания химических процессов совершается электрическая работа. Гальванический элемент состоит из двух полуэлементов. Гальванический элемент Даниэля-Якоби Рассмотрим систему, в которой два электрода находятся в растворах собственных ионов, например, гальванический элемент Даниэля-Якоби. Он состоит из двух полуэлементов: из цинковой пластины, погруженной в раствор ZnSO4 и медной пластины, погруженной в раствор CuSO4. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой. При погружении цинковой пластины в раствор ZnSO4 ионы цинка из кристаллической решетки пластины будут переходить в раствор, заряжая пластину отрицательно, за счет избытка электронов на пластине, т.е. происходит поверхностное растворение цинка. При погружении медной пластины в раствор CuSO4 ионы меди ионы раствора будут осаждаться на пластине, заряжая ее положительно, т. е. происходит осаждение меди. Если соединить внутренние и внешние цепи, то избыток электронов с цинковой пластины будут переходить по проводнику на медную пластину, компенсируя ее положительный заряд, а избыток сульфат ионов (SO42-) из раствора CuSO4 через пористую перегородку в раствор ZnSO4, компенсируя избыток ионов цинка. Таким образом, при замыкании цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделение меди на медном электроде. Zn0 - 2ē Zn2+ (A(-)) Процессы окисления в электрохимии получили название анодных процессов, а электроды – анодами.Cu2 + + 2ē Cu0 (К(+)) Процессы восстановления в электрохимии получили название катодных процессов, а электроды – катодами Таким образом, при помощи гальванического элемента можно совершить электрическую работу за счет энергии химической реакции.Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. При обратимом протекании химической реакции в гальваническом элементе в условиях постоянства температуры и давления получаемая электрическая энергия будет наибольшей и совершаемая системой электрическая работа будет максимальной полезной работой реакции, равной убыли изобарно-изотермического потенциала. Зная, что максимальная полезная работа химической реакции также равна убыли изобарно-изотермического потенциала Стандартные потенциалы различных металлов, измеренные по отношению к водородному электроду, расположены в порядке возрастания, образуя ряд напряжений. Все металлы, расположенные в ряду напряжений до водорода, называются неблагородными, или химически активными. Металлы, стоящие в ряду напряжения после водорода, называются благородными, или химически неактивными. Ряд напряжений используют при вычислении электродных потенциалов и ЭДС гальванических элементов.
Билет №24 Классификация электродов
Все электроды
можно разделить на шесть групп: 1.
Электроды
первого рода
– это металл, погруженный в раствор
своей хорошо растворимой соли, он
обратим относительно катионов металла.
При этом протекает обратимая
электрохимическая реакция следующего
вида: Me
Men+ +
ne. Схема полуэлемента Men+/Me.
Например: Zn2+/Zn
и Cu2+/Cu.
При расчете потенциала используют
уравнение Нернста в общем виде. 2.
Электроды второго рода
– это металл, покрытый своей
труднорастворимой солью и обратим
относительно аниона. Такие электроды
используют как электроды сравнения,
поскольку они обладают малым температурным
коэффициентом и равновесие в системе
устанавливается достаточно быстро.
Реакция, протекающая при этом, имеет
вид MeX
Men+
+ X–
+ ne,
схема полуэлемента Me/MeX,X–.
Например, хлорсеребряный электрод
Ag/AgCl,Cl–;
каломельный электрод Hg/Hg2Cl2,KCl;
ртутно-кадмиевый электрод Hg/Hg2SO4,CdSO4.
Потенциал рассчитывают по уравнению:
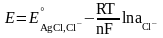 3.
Газовые электроды
состоят из металлического проводника,
который не должен посылать в раствор
собственный ионы (платина и платиновые
металлы), контактирующего одновременно
с газом и раствором, содержащим ионы
этого раствора. Чаще всего газовые
электроды используют в качестве
электродов сравнения, и к ним относятся
водородный и кислородный электроды.
Равновесие на
водородном электроде
выражается равновесием 2H+
+ 2e
H2,
а схема полуэлемента имеет вид H2(Pt)/2H+.
Так как в реакции участвует газообразный
водород, то электродный потенциал
зависит от давления газа На
кислородном
электроде
в щелочной среде протекает реакция O2
+ 2H2O
+ 4e
4OH–,
а схема полуэлемента имеет вид O2(Pt)/OH–.
Выражение равновесного потенциала
имеет вид:
3.
Газовые электроды
состоят из металлического проводника,
который не должен посылать в раствор
собственный ионы (платина и платиновые
металлы), контактирующего одновременно
с газом и раствором, содержащим ионы
этого раствора. Чаще всего газовые
электроды используют в качестве
электродов сравнения, и к ним относятся
водородный и кислородный электроды.
Равновесие на
водородном электроде
выражается равновесием 2H+
+ 2e
H2,
а схема полуэлемента имеет вид H2(Pt)/2H+.
Так как в реакции участвует газообразный
водород, то электродный потенциал
зависит от давления газа На
кислородном
электроде
в щелочной среде протекает реакция O2
+ 2H2O
+ 4e
4OH–,
а схема полуэлемента имеет вид O2(Pt)/OH–.
Выражение равновесного потенциала
имеет вид:
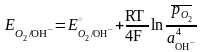 или при T = 298 K.
4.
Амальгамные электроды. Амальгама
– это раствор металла в ртути. Электроды
подобного типа используют для металлов
химически активных, те которые в чистом
виде химически взаимодействуют с водой.
Например, кадмиевый амальгамный электрод
Cd(Hg)/CdSO4.
Реакция Cd
Cd2+
+ 2e.
При расчетах используют уравнение
Нернста в общем виде (9.8). 5.
Окислительно-восстановительные
электроды.
Строго говоря, любая электрохимическая
реакция является окислительно-восстановительной.
Однако при более тонкой классификации
к окислительно-восстановительным
электродам относят только те электроды,
в реакциях которых не принимают
непосредственного участия металлы и
газы. Такие электроды состоят из
металлического проводника, контактирующего
с раствором, содержащим окислители и
восстановители. Уравнение Нернста
имеет вид
или при T = 298 K.
4.
Амальгамные электроды. Амальгама
– это раствор металла в ртути. Электроды
подобного типа используют для металлов
химически активных, те которые в чистом
виде химически взаимодействуют с водой.
Например, кадмиевый амальгамный электрод
Cd(Hg)/CdSO4.
Реакция Cd
Cd2+
+ 2e.
При расчетах используют уравнение
Нернста в общем виде (9.8). 5.
Окислительно-восстановительные
электроды.
Строго говоря, любая электрохимическая
реакция является окислительно-восстановительной.
Однако при более тонкой классификации
к окислительно-восстановительным
электродам относят только те электроды,
в реакциях которых не принимают
непосредственного участия металлы и
газы. Такие электроды состоят из
металлического проводника, контактирующего
с раствором, содержащим окислители и
восстановители. Уравнение Нернста
имеет вид
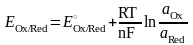 6.
Мембранные электроды,
например стеклянный, который представляет
собой тонкостенный стеклянный шарик,
заполненный раствором электролита.
Содержащиеся в стекле ионы натрия (
6.
Мембранные электроды,
например стеклянный, который представляет
собой тонкостенный стеклянный шарик,
заполненный раствором электролита.
Содержащиеся в стекле ионы натрия (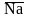 )
обмениваются в растворе с ионами
водорода:
+H+
)
обмениваются в растворе с ионами
водорода:
+H+
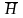 + Na+,
схема полуэлемента – стекло (
)/H+.
Поскольку стеклянный электрод обратим
относительно катионов водорода, то его
используют в качестве индикаторного
электрода и электродный потенциал
рассчитывают по уравнению E
= Eo
– 0,0002 pH.
Используя другой подход, классификацию
электродов можно провести по-другому.
Поляризация
и перенапряжение При
самопроизвольных процессах устанавливается
равновесный потенциал электродов. При
прохождении электрического тока
потенциал электродов изменяется.
Изменение потенциала электрода при
прохождении тока называется поляризацией:
E
= Ei –
Ep,
где E
– поляризация; Ei
– потенциал электрода при прохождении
тока; Ep
– равновесный потенциал. Термин
«поляризация»
употребляют как для обозначения величины
изменения потенциала, так и самого
явления изменения потенциала при
прохождении тока. Различают анодную
(Eа)
и катодную
поляризацию
(Eк).
Если известны причины изменения
потенциала, например, катодное выделение
водорода, то изменение потенциала
называют перенапряжением. Для
экспериментального определения
поляризации строят кривую зависимости
потенциала электрода от протекающего
через электрод тока. Поскольку электроды
могут быть разной площади, то скорость
процесса относят к единице площади
поверхности, которая называется
плотностью
тока
(i): i = I/S
[A/см2]
Плотность тока определяет скорость
электрохимических реакций и связана
с потенциалом. Если процесс протекает
мгновенно, то поляризация равна нулю.
На практике при прохождении тока
потенциал электрода изменяется, то
есть возникает поляризация электрода,
это связано с замедленностью какой-либо
стадии электрохимического процесса:
подвода реагентов, отвода продуктов
реакций, химической или электрохимической
стадии процесса. В зависимости от типа
замедленной стадии поляризацию снижают
перемешиванием раствора, применением
катализаторов, увеличением температуры,
концентрации реагентов и площади
поверхности электродов.
+ Na+,
схема полуэлемента – стекло (
)/H+.
Поскольку стеклянный электрод обратим
относительно катионов водорода, то его
используют в качестве индикаторного
электрода и электродный потенциал
рассчитывают по уравнению E
= Eo
– 0,0002 pH.
Используя другой подход, классификацию
электродов можно провести по-другому.
Поляризация
и перенапряжение При
самопроизвольных процессах устанавливается
равновесный потенциал электродов. При
прохождении электрического тока
потенциал электродов изменяется.
Изменение потенциала электрода при
прохождении тока называется поляризацией:
E
= Ei –
Ep,
где E
– поляризация; Ei
– потенциал электрода при прохождении
тока; Ep
– равновесный потенциал. Термин
«поляризация»
употребляют как для обозначения величины
изменения потенциала, так и самого
явления изменения потенциала при
прохождении тока. Различают анодную
(Eа)
и катодную
поляризацию
(Eк).
Если известны причины изменения
потенциала, например, катодное выделение
водорода, то изменение потенциала
называют перенапряжением. Для
экспериментального определения
поляризации строят кривую зависимости
потенциала электрода от протекающего
через электрод тока. Поскольку электроды
могут быть разной площади, то скорость
процесса относят к единице площади
поверхности, которая называется
плотностью
тока
(i): i = I/S
[A/см2]
Плотность тока определяет скорость
электрохимических реакций и связана
с потенциалом. Если процесс протекает
мгновенно, то поляризация равна нулю.
На практике при прохождении тока
потенциал электрода изменяется, то
есть возникает поляризация электрода,
это связано с замедленностью какой-либо
стадии электрохимического процесса:
подвода реагентов, отвода продуктов
реакций, химической или электрохимической
стадии процесса. В зависимости от типа
замедленной стадии поляризацию снижают
перемешиванием раствора, применением
катализаторов, увеличением температуры,
концентрации реагентов и площади
поверхности электродов.
Билет №26
Электролиз. Законы Фарадея
Электролизом
называют
процессы, протекающие на электродах
под действием электрического тока,
подаваемого от внешнего источника тока
через электролиты. При электролизе на
электродах непрерывно протекают
окислительно-восстановительные реакции.
На катоде (К(-)) происходит процесс
восстановления, на аноде (А(+)) – процесс
окисления. Продукты этих реакций или
откладываются на электродах, или
вступают во вторичные реакции
(взаимодействуют между собой, с молекулами
растворителя или с веществом электрода),
или накапливаются в растворе у электродов.
Течение первичных анодных и катодных
реакций подчиняется законам
Фарадея.
Первый
закон Фарадея:
масса вещества m,
выделяемая на электроде электрическим
током, пропорциональная количеству
электричества Q,
прошедшему через электролит: m = kQ, но Q
=I
где I
– сила тока, А;
– время пропускание тока, с. m = kI
k
– коэффициент пропорциональности,
равный количеству вещества, выделяемого
при прохождении одного кулона (Кл)
электричества Второй
закон Фарадея:
массы различных веществ, выделенных
одним и тем же количеством электричества,
пропорциональных их химическим
эквивалентам (Мэ):
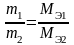 Для
выделения 1 грамма эквивалента вещества
требуется пропустить через электролит
одно и тоже количество электричества,
равное приблизительно 96500 Кл (число
Фарадея). Следовательно:
Для
выделения 1 грамма эквивалента вещества
требуется пропустить через электролит
одно и тоже количество электричества,
равное приблизительно 96500 Кл (число
Фарадея). Следовательно:
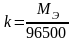 Подставив
последнее уравнение в (9.17), получим
формулу, объединяющую оба закона
Фарадея.
Подставив
последнее уравнение в (9.17), получим
формулу, объединяющую оба закона
Фарадея.
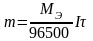 Соотношение
(9.18) используют в расчетах процессов
при электролизе. При практическом
проведении электролиза всегда некоторая
часть электрической энергии затрачивается
на побочные процессы. Важной характеристикой
рентабельности установки для проведения
электролиза (электролизера) является
выход по току (,
%):
=
Соотношение
(9.18) используют в расчетах процессов
при электролизе. При практическом
проведении электролиза всегда некоторая
часть электрической энергии затрачивается
на побочные процессы. Важной характеристикой
рентабельности установки для проведения
электролиза (электролизера) является
выход по току (,
%):
=
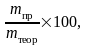 где
mпр
– масса фактически выделенного вещества;
mтеор
– масса вещества, которая должна была
выделиться в соответствии с законом
Фарадея. На процесс электролиза
существенно влияет плотность тока, то
есть сила тока, приходящаяся на единицу
рабочей поверхности электрода. Рассмотрим
процессы,
протекающие на катоде и аноде.
Если электролиз идет в расплаве соли,
то на катоде выделяется металл, а на
аноде газ аниона. Например, электролиз
расплава
хлорида натрия приводит к восстановлению
ионов Na+
до металлического натрия на катоде
(отрицательном электроде) Na+
+ 1e
Na и окислению хлорид ионов Cl–
до газообразного хлора на аноде
(положительном электроде) Cl–
– e
1/2 Cl2.
Суммарная реакция: NaCl
где
mпр
– масса фактически выделенного вещества;
mтеор
– масса вещества, которая должна была
выделиться в соответствии с законом
Фарадея. На процесс электролиза
существенно влияет плотность тока, то
есть сила тока, приходящаяся на единицу
рабочей поверхности электрода. Рассмотрим
процессы,
протекающие на катоде и аноде.
Если электролиз идет в расплаве соли,
то на катоде выделяется металл, а на
аноде газ аниона. Например, электролиз
расплава
хлорида натрия приводит к восстановлению
ионов Na+
до металлического натрия на катоде
(отрицательном электроде) Na+
+ 1e
Na и окислению хлорид ионов Cl–
до газообразного хлора на аноде
(положительном электроде) Cl–
– e
1/2 Cl2.
Суммарная реакция: NaCl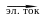 Na
+ 1/2 Cl2.
Если электролиз
идет в растворе соли,
то помимо катиона металла и аниона в
растворе находятся ионы H+
и OH+:
H2O
H++OH-.
При наличии нескольких видов ионов или
недиссоциированных молекул электрохимически
активных веществ возможно протекание
нескольких электродных реакций. На
катоде, прежде всего, протекает реакция
с наиболее положительным потенциалом.
Поэтому при катодном восстановлении
возможно три случая: Катионы металлов,
стоящие в ряду напряжения от Li+
до Al3+
включительно не восстанавливаются на
катоде, вместо них выделяется водород:
2Н2О
+ 2e
Н2
+ 2OH-;
Катионы металлов, находящиеся в ряду
напряжения от Al3+
до H+
(включительно) восстанавливаются
одновременно с молекулами воды, что
связано с более высокой поляризацией
(перенапряжением) при выделении водорода,
чем поляризацией (перенапряжением)
разряда многих металлов: Меn+
+ ne
Ме
2Н2О
+ 2e
Н2
+ 2ОН- Катионы
металлов, стоящие в ряду напряжения
после водорода полностью восстанавливаются
на катоде: Меn+
+ ne
Ме.
На аноде в первую очередь реагируют
наиболее сильные восстановители –
вещества, имеющие наиболее отрицательные
потенциалы. На нерастворимом аноде
(уголь, графит, платина, иридий) анионы
кислородсодержащих кислот не окисляются,
а окисляется вода с образованием
кислорода: 2Н2О
– 4e
4Н+
+ О2.
Анионы бескислородных кислот (Cl-,
I-,
Br-,
S2-
и т.д.) окисляются до простых веществ
(Cl2,
I2,
Br2,
S
и т. д.) при высокой плотности тока. При
малой плотности тока выделяется только
кислород, а при выравнивании потенциала
Na
+ 1/2 Cl2.
Если электролиз
идет в растворе соли,
то помимо катиона металла и аниона в
растворе находятся ионы H+
и OH+:
H2O
H++OH-.
При наличии нескольких видов ионов или
недиссоциированных молекул электрохимически
активных веществ возможно протекание
нескольких электродных реакций. На
катоде, прежде всего, протекает реакция
с наиболее положительным потенциалом.
Поэтому при катодном восстановлении
возможно три случая: Катионы металлов,
стоящие в ряду напряжения от Li+
до Al3+
включительно не восстанавливаются на
катоде, вместо них выделяется водород:
2Н2О
+ 2e
Н2
+ 2OH-;
Катионы металлов, находящиеся в ряду
напряжения от Al3+
до H+
(включительно) восстанавливаются
одновременно с молекулами воды, что
связано с более высокой поляризацией
(перенапряжением) при выделении водорода,
чем поляризацией (перенапряжением)
разряда многих металлов: Меn+
+ ne
Ме
2Н2О
+ 2e
Н2
+ 2ОН- Катионы
металлов, стоящие в ряду напряжения
после водорода полностью восстанавливаются
на катоде: Меn+
+ ne
Ме.
На аноде в первую очередь реагируют
наиболее сильные восстановители –
вещества, имеющие наиболее отрицательные
потенциалы. На нерастворимом аноде
(уголь, графит, платина, иридий) анионы
кислородсодержащих кислот не окисляются,
а окисляется вода с образованием
кислорода: 2Н2О
– 4e
4Н+
+ О2.
Анионы бескислородных кислот (Cl-,
I-,
Br-,
S2-
и т.д.) окисляются до простых веществ
(Cl2,
I2,
Br2,
S
и т. д.) при высокой плотности тока. При
малой плотности тока выделяется только
кислород, а при выравнивании потенциала
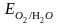 и
и
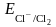 протекают обе реакции. На растворимом
аноде идет процесс растворения самого
анода, например, Сu
+- 2e
Cu2+.
протекают обе реакции. На растворимом
аноде идет процесс растворения самого
анода, например, Сu
+- 2e
Cu2+.
Электролиз применяют в: 1) металлургии для получения меди, цинка, кобальта, марганца и других металлов; 2) в химической промышленности электролизом получают газообразный хлор, водород, кислород, щелочи, окислители (пероксид водорода, перманганат калия, хлораты и другие); 3) получение гальванопокрытий: никелирование, меднение, цинкование, хромирование; 4) электрохимическая анодная обработка металлов и сплавов для придания изделиям определенной формы.
Билет №27
Коррозия металлов
Коррозия – это разрушение металла в результате его физико-химического взаимодействия с окружающей средой. Это процесс самопроизвольный, идущий с уменьшением энергии Гиббса системы и выделением теплоты в окружающую среду. Коррозия приводит к большим потерям в результате разрушения трубопроводов, металлических частей машин, корпусов судов и другие. Безвозвратные потери металлов от коррозии составляют до 15% от ежегодного их выпуска. По механизму протекания коррозионные процессы разделяют на химические и электрохимические. Химическая коррозия характерна для сред, не проводящих электрический ток. При химической коррозии происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды. По условиям протекания коррозионного процесса различают: а) газовую коррозию – в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах (например, окисления металла кислородом при высоких температурах); б) коррозию в неэлектролитах – агрессивных органических жидкостях, например, сернистая нефть. Электрохимическая коррозия характерна для сред, имеющих ионную проводимость. При этом происходит анодное растворение металла и катодное восстановление окислителя. Электрохимическая коррозия может протекать: а) в электролитах (водных растворах солей, кислот, щелочей, морской воде); б) в атмосфере любого влажного газа, в почве. Защиту металлов от коррозии проводят следующими методами: легирование металлов – введение легирующих добавок при плавлении (Mo, W, Gr, Ni и т.д.); нанесение защитных покрытий а) металлических: цинк, алюминий, никель, латунь и т.д.; б) неметаллических: лаки, краски, полимеры; электрохимическая защита, то есть, присоединением протектора к защищаемой поверхности (протектор растворяется), а так же катодной и анодной поляризацией за счет извне приложенного тока; изменение свойств коррозионной среды, снижением концентрации компонентов, опасных в коррозионном отношении. Например, для удаления растворенного кислорода проводят деаэрацию (кипячение, барботаж инертного газа); рациональное конструирование изделий. Например, уменьшением числа сварных швов, узких щелей, контактов разнородных по электродным потенциалам металлов.
Билет №28
Общая характеристика агрегатного состояния вещества
Почти все известные вещества в зависимости от условий находятся в газообразном, жидком, твердом или плазменном состоянии. Это и называется агрегатным состоянием вещества. Агрегатное состояние не влияет на химические свойства и химическое строение вещества, а влияет на физическое состояние (плотность, вязкость, температуру и т.д.) и скорость химических процессов. Например, вода в газообразном состоянии – пар, в жидком – жидкость, в твердом – лед, снег, иней. Химический состав один и тот же, а физические свойства различны. Различие физических свойств связано с разными расстояниями между молекулами вещества и силами притяжения между ними. Для газов характерно большие расстояния между молекулами и малые силы притяжения. Молекулы газов находятся в хаотичном движении. Это объясняет то, что плотность газов мала, они не имеют собственной формы, занимают весь предоставленный им объем, при изменении давления газы изменяют свой объем. В жидком состоянии молекулы более сближены, силы межмолекулярного притяжения возрастают, молекулы находятся в хаотично-поступательном движении. Поэтому плотность жидкостей намного больше плотности газов, объем определенный, почти не зависит от давления, но жидкости не имеют собственной формы, а принимают форму предоставленного сосуда. Для них характерен «ближний порядок», то есть зачатки кристаллической структуры (будет рассмотрено далее). В твердых телах частицы (молекулы, атомы, ионы) сближены настолько друг с другом, что силы притяжения уравновешиваются силами отталкивания, то есть, у частиц наблюдаются колебательные движения, и нет поступательных. Поэтому частицы твердых тел располагаются в определенных точках пространства, для них характерен «дальний порядок» (будет рассмотрен далее), твердые тела имеют определенную форму, объем. Плазма – это любой объект, в котором хаотически движутся электрически заряженные частицы (электроны, ядра или ионы). Плазменное состояние в природе является господствующим и возникает под действием ионизирующих факторов: высокой температуры, электрического разряда, электромагнитных излучений высоких энергий и т.д. Различают два вида плазмы: изотермическую и газоразрядную. Первая возникает под действием высокой температуры, достаточно устойчива, существует долго, например, солнце, звезды, шаровая молния. Вторая возникает под действием электрического разряда и устойчива только при наличии электрического поля, например, в газоосветительных трубках. Плазму можно рассматривать как ионизированный газ, который подчиняется законам идеального газа.
Билет №29
Агрегатное состояние вещества – газ
Газы, агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объём. Вещество в газообразном состоянии широко распространено в природе. Газы образуют атмосферу Земли, в значительных количествах содержатся в твёрдых земных породах, растворены в воде океанов, морей и рек. Солнце, звёзды, облака межзвёздного вещества состоят из газов - нейтральных или ионизованных (плазмы). Встречающиеся в природных условиях газы представляют собой, как правило, смеси химически индивидуальных газов. Обладают рядом характерных свойств. Они полностью заполняют сосуд, в котором находятся, и принимают его форму. В отличие от твёрдых тел и жидкостей, объём газов существенно зависит от давления и температуры. Любое вещество можно перевести в газообразное состояние надлежащим подбором давления и температуры. В зависимости от условий в широких пределах изменяются и другие свойства газов - теплопроводность, вязкость 2. Агрегатное состояние вещества – жидкость Жидкость, промежуточное между твёрдым и газообразным состояниями. сохраняя отдельные черты как твёрдого тела, так и газа, обладает, рядом только ей присущих особенностей, из которых наиболее характерная - текучесть. Подобно твёрдому телу, сохраняет свой объём, имеет свободную поверхность, обладает определённой прочностью на разрыв при всестороннем растяжении и т. д. С другой стороны, взятая в достаточном количестве Ж. принимает форму сосуда, в котором находится. Принципиальная возможность непрерывного перехода Ж. в газ также свидетельствует о близости жидкого и газообразного состояний. По химическому составу различают чистые и смеси. При нагревании или уменьшении плотности свойства Ж. (теплопроводность, вязкость, самодиффузия и др.), как правило, меняются в сторону сближения со свойствами газов. (плотность, сжимаемость, теплоёмкость, электропроводность
Билет №30
Характеристика твёрдого состояния
Как известно, при достаточно низкой температуре все вещества переходят в твердое состояние. Частицы твердых тел настолько прочно связаны друг с другом силами взаимного притяжения, что для них исключается поступательное движение и имеет место лишь колебательное движение около определенных точек. Под действием внешних сил эти частицы могут несколько смещаться из своего первоначального положения, но при снятии нагрузки они вновь возвращаются в него обратно. Таким образом, для всякого твердого тела характерна не только собственная форма, но и способность к деформации. Деформация – это способность твердого вещества восстанавливать прежнюю форму после снятия действия сил, направленных на ее изменение. По способности к деформации все тела разделяются на упругие, пластичные и хрупкие. Твердые тела обычно делят на две группы: кристаллические вещества и аморфные. Кристаллические вещества имеют четкую внутреннюю структуру, что связано с правильным расположением частиц в строго периодически повторяющемся порядке, а с этим связаны следующие свойства: а) для каждого твердого кристаллического тела есть строго постоянная температура плавления; б) для монокристаллов (одиночные кристаллы) характерно явление анизотропии, то есть, свойства кристаллов в различных направлениях неодинаковы (тепло и электропроводность, механическая прочность, коэффициент теплового расширения, скорость растворения и т.д.). Для поликристаллов (реальных) это явление не проявляется; Аморфные вещества не имеют упорядоченной структуры. Такие вещества изотропны – их свойства совершенно одинаковы по всем направлениям внутри тела. Эти вещества не имеют постоянной температуры плавления. При нагревании они сначала размягчаются в определенном интервале температур, а затем постепенно переходят в жидкотекучее состояние. При охлаждении эти расплавы вновь переходят в твердое состояние без образования кристаллической структуры. Аморфные вещества по структуре аналогичны жидкостям и отличаются от них лишь очень малой подвижностью своих частиц. Поэтому аморфные вещества рассматривают как переохлажденные жидкости с высокой аномальной вязкостью. Некоторые из них очень медленно текут (стекло толще внизу). К аморфным веществам относят многие полимеры, смолы, простые вещества (Si, Se, Ag и др.), оксиды (SiO2, B2O3 и т.д.). Резко противопоставлять аморфные тела кристаллическим не следует, так как многие вещества можно получить как в аморфном, так и кристаллическом состоянии. Например, SiO2 как горный хрусталь – это кристалл, а как опал – аморфное тело. Аморфные тела могут переходить в кристаллическое состояние с течением времени. Это связано с тем, что с энергетической точки зрения аморфные вещества по сравнению с кристаллическими обладают большим запасом энергии, так как при кристаллизации твердого вещества происходит заметное выделение тепла, а при застывании расплавленного аморфного вещества никакого выделения тепла не наблюдается. Поскольку аморфное состояние вещества является энергетически менее устойчивым, возникает тенденция к переходу вещества из аморфного состояния в кристаллическое. Этот процесс является длительным во времени. Для перехода стекла в кристаллическое состояние необходимо время в сто и более лет. При этом стекло мутнеет. В процессе кристаллизации внутреннее напряжение в стекле может настолько увеличиться, что оно разрушается без видимых внешних причин. Плазма – это любой объект, в котором хаотически движутся электрически заряженные частицы (электроны, ядра или ионы). Плазменное состояние в природе является господствующим и возникает под действием ионизирующих факторов: высокой температуры, электрического разряда, электромагнитных излучений высоких энергий и т.д. Различают два вида плазмы: изотермическую и газоразрядную. Первая возникает под действием высокой температуры, достаточно устойчива, существует долго, например, солнце, звезды, шаровая молния. Вторая возникает под действием электрического разряда и устойчива только при наличии электрического поля, например, в газоосветительных трубках. Плазму можно рассматривать как ионизированный газ, который подчиняется законам идеального газа.
Билет № 31
Классификация дисперсных систем
Дисперсные системы представляют собой гетерогенную систему, в которой одно вещество в более или менее раздробленном состоянии равномерно распределено в массе другого вещества. Раздробленное вещество в этом случае называется дисперсной фазой, а среда, в которой оно распределено – дисперсионной средой. Например, взмученная в воде глина состоит из взвешенных мелких частиц глины – дисперсной фазы и воды – дисперсионной среды.Дисперсные системы характеризуются степенью дисперсности – величиной обратной величине размера (диаметра) дисперсных частиц. Чем больше размер частиц, тем меньше степень дисперсности. Дисперсные системы классифицируются по следующим признакам: по степени дисперсности (или размеру частиц); агрегатному состоянию дисперсной фазы и дисперсионной среды; интенсивности взаимодействия частиц на поверхности раздела между фазами. Рассмотрим классификацию по степени дисперсности (или размеру частиц). В зависимости от размера частиц (степени дисперсности) все дисперсные системы делятся на три группы: 1) грубодисперсные или микрогетерогенные системы, имеющие размер частиц 10-5 – 10-7 м и более. Такие системы гетерогенны, неустойчивы, не проходят через тонкие бумажные фильтры; сравнительно быстро оседают (или всплывают); не диализируют и не диффундируют, видимы в обычный микроскоп. Примеры: суспензии, эмульсии, пены; 2) полидисперсные или ультрамикрогетерогенные системы, имеющие размер 10-7 – 10-9 м. Такие системы гетерогенны, довольно устойчивы, проходят через самые тонкие фильтры, но задерживаются в ультрафильтрах, заметно не оседают, не диализируют и очень слабо диффундируют, невидимы в обычный микроскоп, но обнаруживаются при помощи ультрамикроскопа. Примеры: коллоидные системы (золи); 3) истинные или молекулярные растворы, имеющие размер частиц менее 10-9 м. Эта группа делится на две подгруппы: растворы высокомолекулярных соединений (ВМС) и растворы низкомолекулярных соединений (НМС). Такие системы гомогенны, довольно устойчивы, образуются путем самопроизвольного растворения, проходят через все фильтры; не оседают, хорошо диализируют и диффундируют, не обнаруживаются и в ультрамикроскопе. Суспензии – это грубодисперсные системы, в которых дисперсная фаза состоит из твердых частиц, взвешенных в жидкой среде. Для получения стабильной суспензии вводят подходящий стабилизатор – различные поверхностно-активные вещества (ПАВ). Эмульсии – это грубодисперсные системы, которые состоят из двух несмешивающихся жидкостей. В качестве стабилизатора используют эмульгаторы: органические кислоты, спирты и др. ПАВ. Пены – это грубодисперсные системы газов (или воздуха) в жидкости. В качестве стабилизатора применяют пенообразователи: мыло, органические кислоты, спирты и др. ПАВ. Классификация по отсутствию или наличию взаимодействия между частицами в дисперсной фазе делит дисперсные системы на две группы: 1) свободнодисперсные системы, в которых частицы дисперсной фазы не связаны между собой и могут свободно перемещаться по дисперсионной среде (суспензии, эмульсии, золи и др.); 2) связнодисперсные системы, в которых частицы дисперсной фазы закреплены в определенных точках пространства и не могут свободно перемещаться по дисперсионной среде: твердые пены, студни, твердые растворы. Классификация по степени взаимодействия дисперсной фазы и дисперсионной среды делит дисперсные системы на две группы: 1) лиофильные (гидрофильные) растворы – системы, в которых частицы фазы взаимодействуют со средой – растворы мыл, некоторых белков, полисахариды, латекс; 2) лиофобные (гидрофобные) растворы – системы, в которых частицы фазы и среды не взаимодействуют – коллоидные растворы (гидрозоли), эмульсии масел в воде. (В переводе с греческого «лио» – растворитель; «филе» – люблю; «фоба» – ненавидеть). Классификация по агрегатному состоянию фазы и среды включает восемь типов систем.
Билет №32
Получение коллоидно-дисперсных систем
Размеры коллоидных частиц настолько велики по сравнению с молекулами дисперсионной среды, что между ними образуется поверхность раздела, т. е. коллоидные системы гетерогенны и их получение возможно при соблюдении следующих условий: 1) размеры частиц данного вещества должны быть доведены до коллоидных размеров (10-7 – 10-9 м), что возможно методом раздробления или укрупнением молекул, атомов или ионов до частиц коллоидного размера; 2) необходимо присутствие стабилизаторов (ионов электролитов, которые на поверхности коллоидной частички образуют ионно-гидратную оболочку, препятствующую слиянию частиц при их взаимном столкновении в растворе);
3) коллоидные частицы должны обладать плохой растворимостью в дисперсионной среде, хотя бы в момент их получения. При соблюдении этих условий коллоидные частицы приобретают электрический заряд и гидратную оболочку, что препятствует выпадению их в осадок. К дисперсионным методам получения коллоидных систем относятся: механические – дробление, растирание, размол и т. д.; электрический – получение золей металлов под действием силы тока 5-10 A и напряжении 100 B в присутствии соответствующих стабилизаторов; ультразвуковой – дробление ультразвуком (например, камней в почках); химического диспергирования (пептизация и получение растворов ВМС из твердого полимера: набухание крахмала, желатина, агара-агара в воде). К конденсационным методам получения коллоидных систем относятся: физические: резкое охлаждение (образование тумана); замена лучшего растворителя на худший (раствор мыла в спирте – истинный раствор, а в воде – пена); выпаривание, т.е. снижение концентрации дисперсионной среды (раствор желатина до 0,9 % – истинный раствор, а больше 1 % – коллоидный). Химические, т. е. проведение таких химических реакций, как окисление: 2H2S + O2 2H2O + 2S (золь серы), восстановление: 2HAuCl4 + 2H2O2 2Au + 8HCl + 3O2 (золь золота), обменное разложение: AgNO3 + KCl AgCl + KNO3, гидролиза: FeCl3 + 3H2O Fe(OH)3 + 3HCl. Золи имеют мицелярное строение. Согласно теории Думанского и Пескова, коллоидный раствор состоит из мицелл (твердая или дисперсная фаза) и интермицеллярной жидкости, которая содержит растворенные в ней электролиты и неэлектролиты (дисперсионная среда). Мицелла – это электрически нейтральная структурная единица коллоидного раствора. Рассмотрим строение мицеллы золя CuS. В центре мицеллы находится скопление большого количества молекул или атомов вещества, образующих золь. Оно имеет кристаллическое строение. В данном случае это (mCuS), на поверхности которого, согласно правилу Фаянса-Пескова: из дисперсной среды адсорбируются те ионы стабилизатора, которые входят в состав золя, то есть Cu2+, в количестве n. Эти ионы называются потенциалопределяющими ионами (ПОИ). Золь и ПОИ образуют ядро. Затем адсорбируются противоионы (ПИ), в данном случае SO42- в количестве (n – х). Ядро и ПИ образуют гранулу или коллоидную частицу, имеющую заряд ПОИ, в данном ионы случае это х+. На поверхности гранулы адсорбируются ПИ SO42- в количестве х, создавая так называемый диффузный слой (ДС), или подвижный слой ионов. Слой ПИ и ДС представляют собой адсорбционный слой (АС). Все вместе это называется мицеллой золя. Некоторые коллоидные системы проявляют большое сродство к молекулам воды Н2О и имеют гидратную оболочку ядро коллоидная частица (гранула) мицелла
Билет №33
Устойчивость коллоидных растворов. Коагуляция. Пептизация
Под устойчивостью коллоидного раствора понимают постоянство основных свойств этого раствора: сохранение размеров частиц (агрегативная устойчивость) и равномерное распределение частиц по всему объему (седиментационная или кинетическая устойчивость).Лиофобные золи термодинамически неустойчивы, с течением времени происходит укрупнение коллоидных частиц, а затем выпадение их в осадок. Процесс слияния мицелл коллоидных растворов и выпадение их в осадок называется коагуляцией. Коагуляцию могут вызвать следующие факторы: изменение температуры (например, сильное охлаждение); механическое воздействие (например, интенсивное встряхивание или перемешивание); действие света и различного рода излучений; действие электрического заряда; действие электролитов, добавляемых к коллоидному раствору; добавление другого коллоидного раствора с зарядом гранулы противоположным заряду гранулы исходного золя. Процесс коагуляции происходит в две стадии: скрытая коагуляция – при этом происходит укрупнение частиц, но не наблюдается внешних изменений; и явная коагуляция – при этом наблюдается изменение цвета, выпадение осадка, появление мути. Правило Шульце-Гарди: коагуляцию коллоидных растворов вызывает не весь электролит, а только тот его ион, который противоположен по заряду гранулы. Причем чем выше заряд коагулирующего иона, тем меньше этого вещества необходимо для коагуляции. Механизм коагуляции объясняет теория, предложенная И. П. Песковым. Согласно этой теории, ион, вызывающий коагуляцию отнимает сольватную (гидратную) оболочку от ионов диффузного слоя, которые переходят в дальнейшем в адсорбционный слой гранулы. Термодинамическая устойчивость системы снижается, увеличиваются силы притяжения между мицеллами, т. е. вандерваальсовы силы и уменьшаются силы отталкивания между ними (отталкивание происходит за счет наличия одноименного электрического заряда у коллоидных частиц). Следовательно, сталкивание мицелл приводит к их слиянию, и в конечном итоге – к коагуляции. Коагуляция золей способствует уменьшению площади поверхности частиц, и за счет этого – снижению свободной поверхностной энергии, а, следовательно, и увеличению термодинамической устойчивости системы. Устойчивость коллоидно-дисперсных систем может быть достигнута за счет проведения диализа – процесса очистки коллоидных растворов от посторонних примесей, находящихся в дисперсионной среде. Этот процесс проводят в диализаторах. Простейший диализатор состоит из цилиндра, дно которого затянуто полупроницаемой мембраной. Цилиндр наполняют коллоидным раствором и помещают в сосуд с дистиллированной водой. Через мембрану проходят растворенные в воде примеси и задерживаются мицеллы. Другой способ увеличения устойчивости коллоидных растворов это введение в них соответствующего высокомолекулярного вещества. Процесс обратный коагуляции – пептизация. При пептизации частицы, находящиеся в рыхлом осадке, адсорбируют на своей поверхности одноименные заряды, отталкиваются друг от друга и переходят в раствор, образуя золь. Вещества, способствующие пептизации, называются пептизаторами. Например, пептизацию гидрозоля железа (Fe(OH)2), находящегося в осадке, можно вызвать, добавив раствор хлорида железа (III) FeCl3 . При этом на поверхности осадка начинают адсорбироваться ионы Fe+3, образуя диффузный слой. Частицы, находящиеся в осадке, отталкиваются друг от друга и переходят в объем во взвешенном состоянии образуя коллоидный раствор. Процесс пептизации проходит за счет увеличения сил отталкивания между частицами.
Билет №34
Свойства коллоидно-дисперсных систем
Все свойства коллоидно-дисперсных систем можно разделить на три основные группы: молекулярно-кинетические, оптические и электрокинетические. Рассмотрим молекулярно-кинетические свойства коллоидных растворов, к ним относят: Броуновское движение – непрерывное хаотичное движение частиц по всему объему. Причем расстояние, на которое перемещается частица в данном направлении за определенное время (называемое смещением) будет тем больше, чем меньше вязкость дисперсионной среды и размер частиц, и чем выше температура. Другое молекулярно-кинетическое свойство – это диффузия. Диффузия – это самопроизвольный процесс выравнивания концентраций по всему объему под влиянием броуновского движения. Причем скорость диффузии возрастает с ростом температуры и уменьшением размера частиц и вязкости дисперсионной среды, т. е. от тех же факторов, что и смещение при броуновском движении. Третье молекулярно-кинетическое свойство коллоидных растворов – это осмотическое давление. Оно очень мало и с трудом поддается измерению. Это связано с тем, что осмотическое давление коллоидных растворов определяется не молярной концентрацией ( = CRT) находящегося в дисперсионной среде вещества, а числом частиц в единице объема, которое много меньше, чем концентрация. По оптическим свойствам коллоидные растворы существенно отличаются от истинных растворов низкомолекулярных веществ и грубодисперсных систем. Это связано с тем, что в коллоидных растворах размер частиц соизмерим с длиной волны падающего света, поэтому наиболее характерными оптическими свойствами коллоидно-дисперсных систем являются опалесценция, эффект Фарадея-Тиндаля, адсорбция света поверхность коллоидных частиц.Опалесценция – это явление рассеяния света мельчайшими частицами (самосвечение каждой частицы). Поэтому окраска золей в отраженном и проходящем свете будет различной. Например, белые золи в проходящем свете имеют красно-желтую окраску, а в отраженном – голубоватую. Эффект Фарадея-Тиндаля (1857): образование светового конуса при прохождении луча света через коллоидный раствор. Для того, чтобы решить, является раствор коллоидным или нет, необходимо проверить его на эффект Фарадея-Тиндаля. Окраска коллоидно-дисперсных систем связана с адсорбцией света поверхности частиц. Если тело способно поглощать все длины волн падающего света, то оно называется абсолютно черным; если тело отражает свет, то оно называется белым. Большинство тел способно поглощать лишь часть спектра, т. е. они обладают избирательной адсорбцией, и этим объясняется интенсивная окраска коллоидно-дисперсных систем, которая во много раз превышает интенсивность окраски истинных растворов. К электрокинетическим свойствам относят электроосмос и электрофорез. Электроосмос – это явление перемещения жидкости в электрическом поле относительно неподвижной твердой поверхности. Электрофорез – явление перемещения твердых частиц в электрическом поле относительно неподвижной жидкости к электроду, знак которого противоположен заряду перемещающихся частиц (движение частиц дисперсной фазы). Эти явления впервые были обнаружены Ф. Ф. Рейссом (1909) при воздействии постоянного электрического тока на диспергированную в воде глину (рис. 9). Под действием электрического тока, отрицательно заряженные частицы глины перемещаются к аноду с зарядом «+», а дисперсная среда, имеющая положительно заряженные ионы водорода (H+) перемещается в сторону катода, с зарядом «-». При этом в трубке с анодом уровень жидкости уменьшается и раствор мутнеет, а в трубке с катодом уровень жидкости увеличивается и она остается прозрачной. Коллоидные растворы в природе и технике. В природной воде содержится часть примесей в коллоидном состоянии. Поэтому воду, используемую для коммунальных нужд, электростанций, строительства подвергают обработке, вызывающей коагуляцию коллоидных частиц. Дымовые газы электростанций, металлургических заводов и других предприятий представляют собой аэрозоли. Для их коагуляции применяется электрогазоочистка методом электрофореза при очень высоких напряжениях поля. Можно разделить коллоидные частицы и ионы через мембрану, проницаемую для молекул и ионов и непроницаемую для коллоидных частиц. Такой метод разделения называется диализом. Он, например, лежит в основе аппарата «искусственная почка». Вместе с тем, коллоидные растворы находят очень широкое применение в технике, медицине и сельском хозяйстве. Многие лекарственные вещества, пищевые продукты, парфюмерные товары, средства борьбы с сельскохозяйственными вредителями и сорняками применяются в коллоидном состоянии. В коллоидном состоянии находятся многие составные части живых организмов: кровь, лимфа, внутриклеточная жидкость. Поэтому для лечения некоторых болезней широко используется введение в организм лекарств методом электрофореза. Таким образом, в коллоидном состоянии могут находиться многие вещества. Электрический заряд и гидратная (сольватная) оболочка коллоидных частиц обеспечивает устойчивость коллоидных систем, а также придает им особые электрические и кинетические свойства. Снятие электрического заряда и удаление гидратной оболочки частиц приводит к разрушению коллоидных систем.
Билет №35
Качественный анализ вещества
Наука, которая занимается качественным и количественным анализом называется аналитической химией. Анализ проводят поэтапно: сначала проводят химическую идентификацию вещества (качественный анализ), а затем определяют, сколько вещества находится в образце (количественный анализ). Химическая идентификация (обнаружение) – это установление вида и состояния фаз, молекул, атомов, ионов и других составных частей вещества на основе сопоставления экспериментальных и соответствующих справочных данных для известных веществ. Идентификация является целью качественного анализа. При идентификации обычно определяется комплекс свойств веществ: цвет, фазовое состояние, плотность, вязкость, температуры плавления, кипения. В зависимости от вида идентифицируемых частиц различают элементный, молекулярный, изотопный и фазовый анализы. Поэтому наибольшее значение имеют методы определения, классифицируемые по характеру определяемого свойства, или по способу регистрации аналитического сигнала: 1) химические методы анализа, основаны на применении химических реакций. Они сопровождаются внешними эффектами (осадка, газа, окраски); 2) физические методы, основаны на определенной взаимосвязи между физическими свойствами вещества и его химическим составом; 3) физико-химические методы, основаны на физических явлениях, сопровождающих химические реакции. В первую очередь будут рассмотрены элементный и молекулярный анализы. Качественный анализ характеризуется пределом обнаружения (обнаруженным минимумом) сухого вещества, т. е. минимальным количеством надежно идентифицируемого вещества и предельной концентрацией раствора. В качественном анализе применяются только такие реакции, пределы обнаружения которых не менее 50 мкг. Однако в большинстве случаев реакции обнаружения вещества не являются специфическими, поэтому мешающие идентификации вещества переводят в осадок, слабодиссоциирующее или комплексное соединение. Анализ неизвестного вещества проводят в определенной последовательности, при которой то или иное вещество идентифицируют после обнаружения и удаления, мешающих анализу других веществ, т.е. применяют не только реакции обнаружения веществ, но и реакции отделения их друг от друга. Следовательно, качественный анализ вещества зависит от содержания примесей в нем. Если примеси содержатся в очень малых количествах, то их называют «следами». Однако значение имеет не любая примесь, а оказывающие влияние на свойства чистого вещества. При идентификации неорганических веществ проводят качественный анализ катионов и анионов. Методы качественного анализа базируются на ионных реакциях, которые позволяют идентифицировать элементы в форме тех или иных ионов. Как и при любом виде качественного анализа, в ходе реакций образуются труднорастворимые соединения, окрашенные комплексные соединения, происходит окисление или восстановление с изменением цвета раствора.
Билет №36
Количественный анализ вещества. Химические методы анализа
Количественным анализом вещества называется определение содержания (концентрации, массы и т.п.) компонентов в анализируемом веществе. С помощью количественного анализа выявляют массовые соотношения компонентов в анализируемом образце, концентрацию вещества в растворе или в газе. При количественном анализе измеряют те или иные химические, физико-химические и физические параметры анализируемого образца, которые зависят от его состава или содержания того или иного компонента. В большинстве методов полученные при анализе результаты сравнивают со свойствами известных веществ. Результаты анализа обычно выражают в массовых долях, в процентах. Количественный анализ проводят в определенной последовательности, в которую входит отбор и подготовка проб, проведения анализа, обработка и расчет результатов анализа. Как и в качественном анализе, различают макрометоды, полумикрометоды, микро- и ультрамикрометоды. Количественный анализ широко используется для изучения состава руд, металлов, неорганических и органических соединений. В последние годы особое внимание обращается на определение содержания токсичных веществ в воздухе, водоемах, почвах, в продуктах питания, различных товарах. Все методы количественного анализа можно разделить на две большие группы: химические и инструментальные. Это разделение условно, так как многие инструментальные методы также основаны на использовании химических законов и свойств веществ. Химические методы обнаружения и определения основаны на химических реакциях четырех типов: кислотно-основные, окислительно-восстановительные, комплексообразования и осаждения. Наибольшее значение среди химических методов анализа имеют гравиметрический и титриметрический методы, они называются классическими. Гравиметрический метод. Сущность метода заключается в получении труднорастворимого соединения, в которое входит определяемый компонент. Для этого навеску вещества растворяют в том или ином растворителе, обычно в воде, осаждают с помощью реагента, образующего с анализируемым соединением малорастворимое соединение с низким значением ПР. Затем после фильтрования осадок высушивают, прокаливают и взвешивают. По массе вещества находят массу определяемого компонента и проводят расчет его массовой доли в анализируемой навеске. Имеются разновидности гравиметрического метода. Например, в методе отгонки анализируемый компонент выделяют в виде газа, который взаимодействует с реактивом. По изменению массы реактива судят о содержании определяемого компонента в навеске. Одним из основных недостатков гравиметрического метода является его трудоемкость и относительно большая продолжительность. Менее трудоемким является электрогравиметрический метод, при котором определяемый металл, например медь, осаждают на катоде (платиновой сетке). По разности массы катода до и после электролиза определяют массу металла в анализируемом растворе. Однако этот метод пригоден лишь для анализа металлов, на которых не выделяется водород (медь, серебро, ртуть).
Билет №37
Титриметрический (объемный) анализ состоит в том, что раствор с известной концентрацией (титрант) добавляют небольшими порциями к анализируемому раствору. Этот процесс называют титрованием. Титрование прекращается при достижении точки эквивалентности, т.е. достижения эквивалентности реагента титруемого раствора и анализируемого компонента. Титрометрия по точности уступает гравиметрическому методу, однако отличается высокой экспрессивностью (быстротой). Существует несколько разновидностей титриметрического анализа: кислотно-основное титрование, осадительное титрование, комплексонометрическое титрование и окислительно-восстановительное титрование. В основе кислотно-основного титрования (протолитометрии) лежит реакция нейтрализации H+ + OH- H2O Метод позволяет определить концентрацию кислоты или катионов, гидролизирующихся с образованием ионов водорода, титрованием раствором щелочи (алкалиметрия) или определить концентрацию оснований, в том числе анионов, гидролизирующихся с образованием гидроксид-ионов титрованием растворами кислот (ацидиметрия). Точка эквивалентности устанавливается при помощи кислотно-основных индикаторов, изменяющих окраску в определенном интервале рН. При осадительном титровании анализируемый раствор титруется реагентом, образующим с компонентом титрованного раствора малорастворимое соединение (М+ + Х- МХ). Точка эквивалентности определяется с помощью индикатора, образующего с реагентом окрашенное соединение (осадок). Разновидности осадительного титрования: аргентометрия (титрование проводят раствором нитрата серебра), роданометрия (титрование проводят раствором роданата калия), меркурометрия. При комплексонометрическом титровании определяемый компонент в растворе титруется раствором комплексона, чаще всего этилендиаминтетрауксусной кислоты (ЕДТА, комплексона П) или ее двунатриевой соли (комплексона III или трилона Б). Комплексоны являются лигандами и образуют со многими катионами комплексы. Индикаторами точки эквивалентности обычно служат лиганды, образующие с анализируемым ионом окрашенное комплексное соединение. Метод комплексонометрического титрования используется, например, для определения общей жесткости воды. Существует две разновидности комплексонометрии: собственно комплексонометрия и меркурометрия. Окислительно-восстановительное титрование заключается в титровании раствора восстановителя титрованным раствором окислителя или в титровании раствора окислителя титрованным раствором восстановителя. В качестве титрованных растворов окислителей нашли применение растворы перманганата калия KMnO4 (перманганатометрия), дихромата калия K2Cr2O7 (дихроматометрия), иода I2 (йодометрия). Из титрованных растворов восстановителей следует отметить растворы гидразина N2HU (гидразинометрия). При перманганатометрическом титровании в кислой среде Mn (VII) (малиновая окраска) переходит в Mn (II) (бесцветный раствор). Например, перманганатометрическим титрованием можно определить содержание нитритов в растворе 2KMnO4 + 5KNO2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5KNO3 + ЗН2О При дихроматометрическом титровании индикатором служит дифениламин, окрашивающий раствор в синий цвет при избытке дихромат-ионов. При йодометрическом титровании индикатором служит крахмал. Йодометрическое титрование используется для анализа растворов окислителей, в этом случае титрованный раствор содержит иодид-ион. Например, медь можно определить титрованием ее растворов раствором иодида 2Cu2+ + 4I- = 2CuI + I2 Затем образующийся раствор титруется титрованным раствором тиосульфата натрия Na2S2O3 с индикатором крахмалом, добавляемым в конце титрования 2Na2S2O3 +I2 = 2NaI + Na2S4O6 Итак, существует большое число разновидностей количественного химического анализа, позволяющих определять разнообразные вещества в широких пределах концентраций. Среди химических методов анализа наиболее распространены титриметрические и гравиметрические методы.
Билет №38
Инструментальные методы анализа
В последние годы все боле широкое применение получают инструментальные метода анализа, обладающие достоинствами: быстротой, высокой чувствительностью, возможностью одновременного определения нескольких компонентов, сочетания нескольких методов, автоматизации и использования компьютеров для обработки результатов. В инструментальных методах применяются датчики, и, химические сенсоры, которые дают информацию о составе среды, в которой они находятся. Условно инструментальные методы анализа можно разделить на три группы: спектральные и оптические, электрохимические и хроматографические методы анализа. Спектральные и оптические методы анализа основаны на взаимодействии определяемого вещества и электромагнитного излучения (ЭМИ). Методы классифицируются по нескольким признакам – принадлежности ЭМИ к определенной части спектра (УФ – спектроскопия, фотоэлектроколориметрия, ИК – спектроскопия), уровню взаимодействия веществ, с ЭМИ (атом, молекула, ядро атома), физическим явлением (эмиссия, абсорбция). Атомно-эмиссионная спектроскопия – группа методов анализа, основанных на измерении длины волны и интенсивности светового потока, излучаемого возбужденными атомами в газообразном состоянии. Фотометрия пламени – метод анализа, основанный на фотометрировании излучения возбужденных в пламени атомов. Вследствие высокой температуры в пламени возбуждаются спектры элементов, имеющие низкую энергию возбуждения, - щелочные и щелочноземельные металлы. Фотоэлектроколориметрия основана на поглощении света определяемым веществом в видимой области спектра (400 – 760 нм); это разновидность молекулярно-адсорбционной спектроскопии. Турбидиметрический метод основан на поглощении и рассеивании монохроматического света взвешенными частицами анализируемого вещества. К оптическим методам анализа относятся рефрактометрия и поляриметрия. Рефрактометрический метод основан на преломлении света при прохождении луча через границу раздела прозрачных однородных сред. Поляриметрия – оптический неспектральный метод анализа, основанный на вращении плоскополяризованного монохроматического луча света оптически активными веществами. Потенциометрический метод основан на измерении электродвижущих сил обратимых гальванических элементов и применяется для определения концентрации (активности) ионов в растворе. Вольтамперометрия – группа методов, основанных на процессах электрохимического окисления или восстановления определяемого вещества, протекающих на микроэлектроде и обусловливающих возникновение диффузного тока. Кондуктометрический метод основан на измерении электрической проводимости растворов в зависимости от концентрации присутствующих заряженных частиц. Объекты анализа – растворы электролитов. Хроматогафические методы разделения, идентификации и количественного определения основаны на различных скоростях движения отдельных компонентов в потоке подвижной фазы вдоль слоя неподвижной фазы, причем анализируемые вещества находятся в обеих фазах. Газовая хроматография – метод разделения летучих термостабильных соединений, основанный на распределении веществ между фазами, одна из которых – газ, другая – твердый сорбент или вязкая жидкость. Ионообменная хроматография – метод разделения и анализа веществ, основанный на эквивалентном обмене ионов анализируемой смеси и ионообменника (ионита). Происходит обмен ионами между фазами гетерогенной системы. Неподвижной фазой являются иониты; подвижной, как правило, вода, так как обладает хорошими растворяющими и ионизирующими свойствами. Соотношение концентраций обменивающихся ионов в растворе и фазе сорбентов (ионита) определяется ионообменным равновесием.
