
- •Тема 2 . «основные виды топлив применяемых в рдтт».
- •Основные закономерности горения баллиститных топлив.
- •Влияние давления на скорость горения.
- •Влияние внешней температуры на скорость горения твердого топлива.
- •Эрозионное горение твердого топлива.
- •Определение скорости горения.
- •Особенности горения смесевых и металлизированных топлив рдтт.
- •Тема 4. Основные уравнения внутренней баллистики рдтт. (44)
- •Тема 5 Основные типы зарядов рдтт и методы расчета выгорания зарядов (2ч).
- •Тема 6 : газодинамический расчет внутри камерных процессах в рдтт.
- •Лекция 9
- •Тема 7. Течение продуктов сгорания в соплах рдтт.
- •Двухфазные эффекты
- •Лекция 10 Профилирование сопел рдтт.
- •Расчет потерь тяги и удельного импульса в соплах рдтт.
- •Потери из-за скоростного и температурного отставания.
- •Потери из-за осаждения
- •Потери из-за двухслойности.
- •Лекция №11
- •Активное регулирование тяги.
- •Пассивное (программное) регулирование тяги рдтт.
- •Рдтт многократного включения
- •Управление вектором тяги
- •Активное и пассивное включение рдтт
- •Лекция 12
- •Тема 9 : Нестационарные режимы работы рдтт
- •Особенности запуска рдтт
- •Выбор воспламенителя и метод расчёта его массы
- •Приближенный расчёт запуска рдтт
- •Расчёт переходных процессов в рдтт
Основные закономерности горения баллиститных топлив.
Баллиститное (двухосновное) топливо обладает в силу своей структуры равномерностью, изотропностью свойств. Компоненты ?тизательно? уложены на микроуровне.
Не требуется перемешивание продуктов сгорания. Они уже «перемешены».
Химические превращения и горение происходят под воздействием соответствующих термодинамических условий (Т,Р…). Должно быть подведено к топливу определенное количество тепла.
Химические превращения твердых компонентов в газообразные происходят в несколько стадий.
Источник воспламенения выделяет необходимое количество тепла для возникновения процесса горения.
Топливо на поверхности разлагается, предварительно прогревшись. Испаряется, разлагаясь и переходя через жидкую фазу.
Реакции разложения твердого топлива являются экзотермическими, то есть сопровождается большим выделением тепла и ускоряет процесс газификации твердого тепла.
Рассмотрим одномерную модель процесса горения двухосновного топлива.
Температура поверхности горения Tsопределяется теплопередачей от зоны газовых реакция и тепловым эффектом реакций, происходящих в твердой фазе.
Установлено, что Ts возрастает с увеличением давления. Ts Pк.
Для определения скорости газификации на стадии разложения твердой фазы используют известную из химической зависимости (закон Аррениуса).
 ,
А-const, где
,
А-const, где
U – скорость газификации, она же скорость горения, мм/с;
Pк – давление в камере, МПа;
n – порядок реакции в законе Аррениуса;
Е – энергия активации реакции горения, Дж/моль;
R – газовая постоянная, Дж/мольК;
Ts – температура поверхности горения, она же температура газов непосредственно у поверхности, К.
Схема горения:

То – начальная температура топлива;
1 – прогретая зона топлива 30 мкм;
2 – зона газификации;
а – пенная зона 2мкм;
б – зона реакций в газовой фазе, считают что в этой зоне температура Ts 1700 К;
3 – зона пламенных реакций – горения – гаг-газ.
Эта область (газ-газ) дает наибольший температурный рост. Здесь также справедливо
уравнение Аррениуса описывающее кинетику реакций.
В этой области выделяется большое количество тепла, температура поднимается до
величины, соответствующей полному сгоранию Т2
4 – зона закрепления пламенных реакций, формирования температуры в камере сгорания.
Это светящаяся область.
5 – темная область
2+3
 .
При увеличении давления зона пламенных
реакций
.
При увеличении давления зона пламенных
реакций
приближается к поверхности топлива.
Влияние давления на скорость горения.
Давление в камере приближает зону пламенных реакций и поверхности топлива, увеличивая при этом количество тепла в сторону заряда.
Скорость горения твердого топлива при увеличении давления увеличивается.
Форма кривой изменения скорости горения от давления монотонная.

Кривую часто аппроксимируют степенной зависимостью

Виды аппроксимаций:
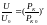 ; или
; или
 ;
или
;
или

Для смесевых

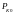 -
условно принятое давление, которое
считают стандартным: Россия = 40 атм
-
условно принятое давление, которое
считают стандартным: Россия = 40 атм
США = 70 атм.
В зависимости от состава твердого топлива коэффициенты b и различны.
Несколько примеров:
НМФ-2 –
баллиститное топливо:
 ;
;
«9» –
баллиститное топливо:
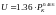 ;
;
«0» - ???
баллиститное топливо

Размерность коэффициентов и параметров:
U – мм/с; b - ?; Pк – атм; - 1.
Такие же законы горения применяются и для смесевых топлив.
