
- •14. Влияние температуры на скорость реакции. Активные молекулы, энергия активации.
- •15. Скорость химических реакций и факторы на нее влияющие.
- •16. Гетерогенные реакции. Скорость гетерогенных реакций.
- •17. Химическое равновесие, условия его смещения, принцип Ле-Шателье.
- •18. Обратимые и необратимые реакции. Химическое равновесие. Константа равновесия и ее связь с термодинамическими функциями.
- •19. Растворы (определение, типы). Термодинамические характеристики процесса растворения.
- •20. Способы выражения концентрации растворов.
- •21. Понижение давления насыщенного пара над раствором. Закон Рауля. Температура кипения и кристаллизации разбавленных растворов не электролитов. Осмос и осмотическое давление. Закон Вант-Гоффа.
- •22. Растворы электролитов. Диссоциация кислот, оснований, солей.
- •23. Сила электролитов. Константа диссоциации. Степень диссоциации и факторы на нее влияющие. З-н разбавления Освальда.
- •24. Произведение растворимости. Условие образования и растворения осадка.
- •25. Гидролиз солей (определение, константа гидролиза, степень гидролиза, 4 типа солей).
- •26. Степень окисления. Основные правила степени окисления. Процессы окисления и восстановления. Типичные ок-ли и восст-ли. Типа овр.
22. Растворы электролитов. Диссоциация кислот, оснований, солей.
Процесс растворения связан с диффузией (самопроизвольным распределением частиц одного в-ва между частицами другого). При внесении растворенного в-ва в р-ль, процесс идет самопроизвольно и р-р остается ненасыщенным. При ∆G=0 р-р становится насыщенным. Можно получить перенасыщенный р-р: он представляет собой систему, находящуюся в кажущемся равновесии. Растворимость данного в-ва = концентрации в насыщенном р-ре. Абсолютно нерастворимого в-ва нет. Электролиты – это в-ва, р-ры или расплавы которых проводят эл ток.
Процесс диссоциации обратим (распад на ионы). Причиной диссоциации явл.взаимодействие молекул р-ля и растворенного в-ва. В водных р-рах содержатся не свободные, а гидротированные ионы. Процесс диссоциации происходит только в полярных р-лях. В молекулах электролитов должны присутствовать ковалентные и полярные или ионные связи. В-ва с неполярными связями на ионы не диссоциируются. Различные электролиты по-разному диссоциируются в р-ре.
Диссоциация многоосновных к-т и многокислотных оснований. Дисс-ция в наиб.степени протекает по I ступени, это объясняется: отрыв второго и след.ионов будет протекать сложнее, т.к +ион должен отрываться от –частицы; химич.равновесие смещ.влево, потому что образуется избыток Н. В случае солей связь между катионом и кислотным остатком носит ионных хар-ер и дисс-цию считают 1-ступенчатой.
23. Сила электролитов. Константа диссоциации. Степень диссоциации и факторы на нее влияющие. З-н разбавления Освальда.
Константа диссоциации не зависит от концентрации р-ра, а зависит от t и природы в-ва.
Количественно дисс-ция хар-ся степенью дисс-ции. Степень дисс-ции зависит от t (t↑-ст.дис.↑), концентрации р-ра и природа в-ва. По ст.дис эл-ты можно поделить на 3 группы: 1) слабые (0-3%)-все нерастворимые осонования, NH4ОН, органические к-ты (кроме муравьиной НСООН и щавельной), сероводородная к-та H2S, угольная к-та Н2СО3, некоторые соли; 2) средней силы (3-30%)-фтороводородная к-та НF, сернистая к-та H2SO3, фосфорная к-та, муравьиная и щавельная к-ты; 3) сильные (›30%).
З-н Освальда: Кд=α2*Св/(1-α), где α-ст.дис. Из з-на Освальда следует, что α↓ при ↑Ср-ра. Добавление одноименного иона→равновесие сдвигается в сторону диссоциирующего в-ва. При добавлении в р-р одноименного иона→хим.равновесие сдвигается в сторону ассоциации и α↓.
24. Произведение растворимости. Условие образования и растворения осадка.
Твердые в-ва хар-ся различной растворимостью. На ряду с хорошо-растворимыми в-вами сущ-ют малорастворимые и практически нерастворимые в-ва. Любое в-во обладает растворимостью.
Произведение С мало растворенного в-ва при данной t есть const, называемая произведением растворимости. ПР зависит от t, природы в-ва. ПР не зависит от Cиона. ПР колич-но хар-ет данное равновесие.
Условия выпадения осадка: ПСионов>ПР при данной t.
Условие растворения осадка: ПСионов<ПР.
25. Гидролиз солей (определение, константа гидролиза, степень гидролиза, 4 типа солей).
Гидролиз – это взаимодействие ионов соли с ионами Н2О, приводящее к изменению концентрации последних и изменению хар-ра среды. Причины: наличие иона слабого эл-та в молекуле соли. Результат: образование слабого эл-та. Гидролиз процесс обратимый, зависящий от концентрации соли и t.
Количественными
хар-ками гидролиза явл-ся Кг
и степень гидролиза. Кг=Кводы/Косн=10-14/Косн.
Кг – это константа равновесия
гидролитической реакции. Под степенью
гидролиза подразумевается отношение
части соли, подвергающейся гидролизу,
к общей концентрации её ионов в растворе.
Αг=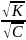 .
.
Соли I (сильные к-та и основание): не подвергаются гидролизу NaCl+HOH↔NaOH+HCl; HOH↔OH+H. Соли II (сильная к-та и слабое основание): гидролиз идет по катиону (слабому иону) Zn(NO3)2+HOH↔Zn(OH)2+HNO3. Соли III (слабая к-та и сильное основание): гид-из идет по аниону Na2SO3+HOH↔NaOH+H2SO3. Соли IV (слабые к-та и основание): гид-из идет по аниону и катиону NH4CN+HOH↔NH4OH+HCN.
