
- •43. Гомогенный катализ в растворах.
- •33. Внешняя масса передачи.
- •34. Внутренняя масса передачи.
- •42. Катализ.
- •35. Кинетика фазовых превращений.
- •16. 3 Закон термодинамики.
- •44. Гетерогенный катализ
- •19. Изменение энтропии при изотермическом расширении или сжатии.
- •17. Применение третьего закона термодинамики для расчета равновесий.
- •13. Изменение свободной энергии при изотермическом расширении и сжатии
- •18. Изменение энтропии при изобарном нагревании или охлаждении.
- •37. Скорость образования зародыша концентрации.
- •23. Закон распределения энергии по степеням свободы.
- •25. Флуктуации плотности.
- •3. Основные условия существования термодинамического равновесия.
- •1. Первый закон тд. Тд координаты, обобщенные силы.
- •4.Химический потенциал.
- •2. Второй закон термодинамики. Общее понятие энтропии.
- •5.Основные термодинамические потенциалы (тдп).
- •8. Распределение в-ва м/у 2 фазами.
- •6.Механические и калорические ур-ия состояния.
- •7. Тдп идеального газа.
- •9.Фазовые превращения. Уравнения Клаузиуса – Клапейрона и Кирхгофа.
- •10. Хим. Равновесие в гом-ых сис-х.
- •15. Равновесие в гетеро-х системах.
- •12. Изменение энергии Гиббса при изменении температуры.
- •11. Изменение свободной энергии при химических реакциях.
- •41. Влияние температуры на скорость химических реакций
- •32.Кинетика гетерогенных реакций.
- •20. Энтропия и вероятность. Теорема Больцмана-Планка.
- •21. Распределение молекул газа в потенциальном поле.
- •28. Статистический расчет химического равновесия.
- •29. Формальная кинетика химических реакций.
- •31.Теория переходного состояния при химической реакции.
- •14. Зависимость константы равновесия от температуры.
- •38. Порядок реакции и молекулярность.
- •30.Теория активных столкновений Аррениуса.
- •22. Распределение молекул по импульсам.
- •24. Статистика Гиббса.
- •36. Работа образования зародыша конденсации.
21. Распределение молекул газа в потенциальном поле.
Пусть
в пространстве действует некоторое
потенциальное поле U(х,
у, z).
Тогда, согласно уравнению![]()
Концентрация С(х,у,z) выразится следующим образом: С= N(х, у, z)/ΔхΔyΔz или
![]()
Сравнивая концентрации в двух точках, получим
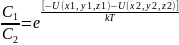 (1)
(1)
Представляет наложение 2 факторов: поле в котором энергия минимальна и температурного фактора, приводящего к равномерному распределению. Иногда приближенное взаимодействие отдельных молекул описывают как действия некоторого молекулярного поля.
28. Статистический расчет химического равновесия.
Рассмотрим реакцию A + 2B = D.
Условие равновесия -ZA – 2ZB +ZD = 0
или, учитывая формулу G = А + pυ = -RT ln (Ze/NA) + RT = - RT ln (Z/NA)

Здесь Z содержит объем в качестве множителя. Поэтому предположим Zi = PiVi,
где Pi носит название функции распределения.
Исключив Z из уравнения и учитывая, что концентрация ci равна NA/Vi, получим
cD/cAc2B = PD/PAP2B
Таким образом:
Kc = PD/PAP2B. (1)
При расчете функций распределения для разных молекул используются разные уровни отсчета энергии. Для учета этого обстоятельства, в соответствии с уравнением Z′ = Zeε0/kT, необходимо умножить правую часть уравнения (1) на е-ΔE/RT, где ΔE - разность уровней отсчета.
Поскольку за нулевой уровень при расчете сумм состояний принимается энергия молекул при абсолютном нуле, то ΔE = -Q0,
где Q0 - теплота реакции при абсолютном нуле.
Таким образом, вместо уравнения (1) получим
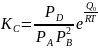
29. Формальная кинетика химических реакций.
Пусть
имеется реакция aA+bB=gG+hH, тогда скорость
химической реакции. Скоростью
химической реакции ω называется скорость
изменения концентрации какого-либо из
участвующих в ней веществ. В гетерогенных
реакциях, протекающих на поверхности
пористых твердых тел, скорость реакции
относят к единице массы или объема
твердой фазы, а в случае жидких или
твердых фаз при известной поверхности
- к единице поверхности раздела. Скорость
может выражаться одной из следующих
производных.
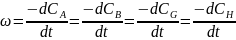
Между изменениями концентрации реагирующих веществ существует соотношения определяемые стехиометрическими коэффициентами a,b,g, и h. по скорости изменения концентрации только одного из реагирующих веществ можно определять скорость изменения концентрации остальных реагентов. Скорость химической реакции есть функция концентраций реагирующих веществ и температуры, т.е. ω = f(с, Т).
Существуют
два основных метода измерения скорости
химических реакций: динамический и
статический. Схема динамического метода
![]() .
.
Смесь реагирующих веществ при низкой температуре подается в реакционную зону Р, где поддерживается достаточно высокая для протекания реакции постоянная температура Т. Необходимо, чтобы смесь из реакционной зоны выходила максимально быстро и вновь попадала в зону с низкой температурой, где реакция практически прекращается, а смесь "закаливается". Производя анализ смеси до поступления в зону Р и после закалки и зная время пребывания смеси в реакционной зоне, определяют скорость реакции. В статических методах проводятся измерения концентраций реагирующих веществ без непрерывного введения и выведения смеси из реакционной зоны. Часто скорость реакции определяют путем измерений каких-либо физических свойств, зависящих от концентрации. скорость прямой реакции A + 2B → AB2 определяется выражением
ω = -dcA/dτ = kcAcB (1) где k - константа скорости реакции, которая также называется удельной скоростью реакции.
Уравнения, такого типа называются кинетическими. Порядком реакции называется сумма показателей степеней, в которых входят концентрации в кинетическое уравнение. В действительности же реакции третьего порядка встречаются очень редко, а реакции более высоких порядков вообще не наблюдаются. Уравнения (1) были сформулированы на основе упрощенных представлений о том, что для реакции необходимы одновременные столкновения молекул реагентов в соответствии со стехиометрическим уравнением и применимы лишь к элементарным актам. Часто реакции бывают нулевого, первого и второго порядка. Наряду с понятием порядка реакции введено понятие молекулярное, т.е. числа частиц, действительно принимающих участие в элементарном акте реакции (в мономолекулярной - одна частица, в бимолекулярной - две). Таким образом, понятие порядка реакции эмпирическое, а молекулярности теоретическое.
