
Основы учения о фазовых равновесиях и диаграммах. Состояния гетерогенных систем
Основные понятия и определения. Понятие о равновесном состоянии.
С и с т е м а – вещество или смесь веществ, отделенные от окружающей среды таким образом, что в ней можно наблюдать изменения и конечное состояние в зависимости от определяющих условий.
Ф а з а – часть системы, обладающая по всему своему объему одинаковыми химическими, физическими, термодинамическими свойствами и имеющая поверхность раздела с другими фазами системы.
Различают чистые фазы, которые представлены, например, химическими соединениями определенного состава и смешанные фазы (газы, расплавы, твердые растворы, растворы), состав которых при изменении внешних условий может меняться.
Процессы, происходящие на границе раздела фаз, играют существенную роль в формировании структуры строительных материалов, исходным сырьем для которых являются различные дисперсные системы с развитой поверхностью.
Существуют системы однородные (гомогенные) – однофазные (это в основном газы и жидкости). В чистом виде в производстве строительных материалов эти системы используются крайне редко. Неоднородные системы состроят из 2-х и более фаз. При минимальном количестве фаз в системе одна из них является сплошной и называется дисперсионной средой (то, в чем растворено), а другая – дисперсной фазой (то, что растворено). Классификация дисперсных систем по агрегатному состоянию вещества фаз приведена ниже.
Таблица 3 – классификация дисперсных систем
Дисперсионная среда |
Дисперсная фаза |
Условное обозначение |
Название системы и примеры |
Твердая |
Твердая |
Т/Т |
Твердые гетерогенные системы: минералы, сплавы, бетон, композиты |
Жидкая |
Ж/Т |
Капиллярные системы: насыщенные пористые тела, почвы, грунты |
|
Газообразная |
Г/Т |
Пористые тела: адсорбенты, катализаторы |
|
Жидкая |
Твердая |
Т/Ж |
Суспензии и золи: илы, пульпы, взвеси, пасты |
Жидкая |
Ж/Ж |
Эмульсии: нефть, молоко, кремы |
|
Газообразная |
Г/Ж |
Газовые эмульсии и пены |
|
Газообразная |
Твердая |
Т/Г |
Аэрозоли (пыли, дымы), порошки |
Жидкая |
Ж/Г |
Аэрозоли: туманы, облака |
|
Газообразная |
Г/Г |
Отсутствуют |
К о м п о н е н т ы – химические индивидуальные вещества, минимального числа которых достаточно для образования всех фаз системы.
Число независимых компонентов системы, в которой происходят химические взаимодействия, определяется как разность между суммой числа химических соединений, которые могут образоваться в системе в результате взаимодействия индивидуальных веществ и числом химических реакций. Рассмотрим процесс термической диссоциации известняка
СаСО3 → СаО + СО2.
Твердыми фазами являются известняк и оксид кальция, газообразная фаза – углекислый газ. Число независимых компонентов системы 3 – 2 = 1, то есть СаСО3 и СаО, они и являются компонентами системы. Кальций, кислород, углерод тоже слагают все фазы системы, но их число уже не минимальное, и они уже не являются компонентами.
Т е р м о д и н а м и ч е с к и е п а р а м е т р ы – величины, характеризующие состояние системы или термодинамического процесса.
Основными параметрами в физической химии силикатов являются температура, давление, концентрация, объем.
С т е п е н ь с в о б о д ы (f) – независимые термодинамические параметры системы, находящейся в равновесии, которые могут изменять свои значения в некотором интервале без изменения числа и природы фаз.
По числу степеней свободы различают нон(ин)вариантное состояние системы (f = 0), моновариантное (f = 1), би(ди)вариантное (f = 2) и многовариантное состояние.
Правило фаз
Правило фаз Гиббса (закон равновесия фаз) устанавливает для любых находящихся в равновесии систем соотношение между числом компонентов К, фаз Р и степеней свободы f
f + P = K + 2
Двойка в числе переменных появляется при рассмотрении в качестве независимых параметров температуры и давления.
Для конденсированных систем, к которым относят силикатные системы, состоящих только из жидких и твердых фаз, влиянием давления пара над поверхностью жидкости на протекание термодинамических процессов можно пренебречь, и тогда правило фаз принимает следующий вид f + P = K + 1.
Диаграмма состояний
Диаграммы состояния представляют собой графическое изображение возможных равновесных состояний в данной системе при различных условиях. Изменения, происходящие в системе, следует рассматривать как последовательность отдельных равновесных состояний, которые достигаются в системе при малом изменении ее параметров.
Диаграммы состояния позволяют установить температуру начала и конца процессов плавления и кристаллизации, состав и количество равновесных фаз при определенной температуре, достижение равновесного состояния или степень отклонения от него.
Диаграммы состояния однокомпонентных систем
Для однокомпонентной системы согласно правилу фаз максимальная степень свободы равна двум: основными параметрами такой системы являются температура и давление. Общий вид диаграммы температура-давление однокомпонентной системы (рис.14) указывает области существования каждой из фаз в зависимости температуры и давления.
На рис.14 рассмотрен случай, когда компонент А имеет две полиморфные модификации: низко- А1 и высокотемпературного А2.
Все области диаграммы являются однофазными: ниже кривой АВСД в системе в равновесии находится пар; выше кривых FCД – жидкость, EBSF – высокотемпературная модификация А2, АВЕ – низкотемпературная модификация А1. В границах этих областей можно произвольно менять два параметра: температуру и давлении, без изменения числа и природы фаз.
Например, для состояния системы, обозначенного на рис.14 точкой М, можно в некотором интервале менять температуру (при постоянном давлении минимальной температурой при этом будет температура Тм) или давление или одновременно оба указанных параметра. Степень свободы при этом изменяться не будет, так как не происходит изменения фазового равновесия: сохраняется парообразное состояние вещества А.
Сплошные пограничные линии на диаграмме определяют моновариантное состояние системы: вдоль этих линий в равновесии находятся две фазы.
Так, вдоль кривой АВ в равновесии находятся кристаллы низкотемпературной модификации А1 и пар, ВС – кр.А2 + пар, СД – расплав компонента А + пар, ВЕ – кр.А1 + кр.А2, СF – кр.А2 + расплав.
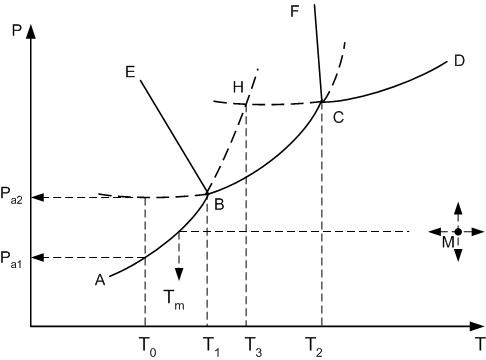
Рис.14. Диаграмма однокомпонентной системы с энантиотропными полиморфными модификациями компонента
Если фазовое равновесие системы описывается точкой, принадлежащей какой либо пограничной линии, то в этом случае произвольно можно изменять только один из параметров: или температуру, или давление. При этом второй параметр будет принимать строго определенное пограничной линией значение. В этом смысле можно говорить о том, что пограничной линией значение. В этом смысле можно говорить о том, что пограничные линии представляют собой графическое изображение функциональных зависимостей давления от температуры (или наоборот) протекания каких-либо фазовых превращений.
Например, пограничная линия ВЕ представляет собой функциональную зависимость давления полиморфного превращения А1 в А2 от температуры (в примере давление возрастает с понижением температуры полиморфного превращения).
В системе существует две точки, когда степень свободы равна нулю, т.е. нонвариантное состояние системы. При этом в равновесии находятся одновременно три фазы: точка В (в равновесии кр.А1 + кр.А2 + пар) и точка С (кр.А2 + расплав + пар).
В этих точках невозможно изменять значения термодинамических параметров без изменения числа фаз.
Например: нонвариантное состояние для воды будет определяться значениями температуры +0,01оС и давления 6,03*10-3 атм., когда в равновесии будут находиться жидкая вода, лед и водяной пар.
Выше было отмечено, что сплошными линиями на диаграмме указывались стабильные состояния системы. Однако при определенных условиях (как правило, высокие скорости изменения температуры системы) можно получать фазы, существующие некоторый промежуток времени в области стабильного существования другой равновесной фазы.
Например, быстрым охлаждением воды можно фиксировать ситуацию, когда при нормальном давлении вода в жидком состоянии будет существовать при температурах до минус 8оС, когда равновесной фазой должен быть лед.
Эта ситуация носит название не(мета)стабильного состояния. Термодинамически метастабильное состояние неустойчиво, и такие системы самопроизвольно стремятся перейти в свое стабильное состояние. Однако скорость перехода будет определяться различными факторами и может быть практически незначимой. Из строительных материалов стекла, в том числе силикатные, являются метастабильными системами, существующими длительный промежуток времени в этом состоянии из-за высоких значений их вязкости.
На диаграммах метастабильные состояния указываются пунктирными линиями.
Например, продолжение пограничной линии АВ в область EBCF стабильного существования высокотемпературной модификации А2 (пунктирная линия ВН), определяет метастабильное фазовое равновесии кр.А1 + пар в области стабильного существования кр.А2. При этом точка Н, образованная пересечением продолжения линий упругости пара низкотемпературной модификации АВ и упругости пара расплава СД, будет определять температуру плавления низкотемпературной модификации А1.
Следует отметить, что для неустойчивого метастабильного состояния при фиксированной температуре упругость пара над поверхностью неустойчивой фазы будет всегда больше, чем над поверхностью устойчивой в данных условиях фазы.
Например: при температуре То давление пара над метастабильной высокотемпературной модификацией А2 будет больше, чем для стабильной А1, т.е. РА2 больше РА1.
Угол наклона линий зависимости равновесного давления от температуры для различных процессов (например, линия ВЕ) можно определить, используя уравнение Менделеева-Клайперона
P / T = Q / (T*(V2 – V1)),
где Q – теплота фазового превращения,
V1 и V2 – удельные объемы низко- и высокотемпературных модификаций.
Например, угол наклона кривой зависимости давления фазового перехода воды в лед от температуры будет тупой, так как удельный объем льда будет больше удельного объема воды.
Таким образом, угол наклона будет тупым, если высокотемпературная модификация будет иметь большую плотность: повышение давления при этом снижает температуру фазового перехода.
Для силикатных систем характерным является снижение плотности при повышении температуры и угол наклона кривой будет острым.
Типы полиморфных превращений
Существует два типа полиморфны превращений: энантиотропные (обратимые) и монотропные (необратимые).
Диаграмма энантиотропных превращений представлена на рис.14, а схема превращений подобного типа приведена ниже.

Отличительными признаками энантиотропных превращений являются:
обе полиморфные модификации имеют области стабильного существования на диаграмме;
температуры плавления обеих полиморфных модификаций выше, чем температура перехода одной модификации в другую (на рис.14 температура Т3 больше Т1 и Т2).
Диаграмма монотропных превращений показана на рис.15.
Кривые АВ, cД и аF характеризуют соответственно давление насыщенных паров над жидкой фазой, неустойчивой модификации А2 и устойчивой модификации А1. Нонвариантная точка а соответствует фазовому равновесию газовой, жидкой и устойчивой А1 модификации, а точка с – равновесному состоянию газовой, жидкой и неустойчивой А2 модификации.
Рассмотрим охлаждение исходного состава системы М.
При снижении температуры при постоянном давлении точка М попадает на линию an, где начинается кристаллизация устойчивой формы А2. При небольших переохлаждениях расплава кристаллизация будет протекать более интенсивно.
Р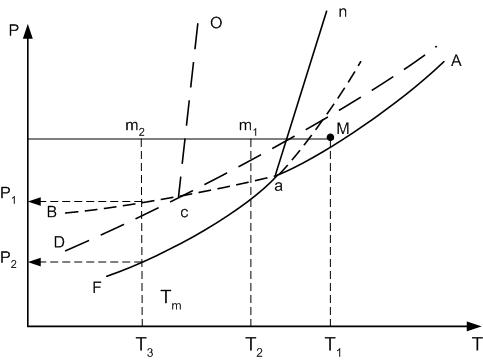 ис.15.
Монотропные превращения полиморфных
модификаций
ис.15.
Монотропные превращения полиморфных
модификаций
Значительное переохлаждение, например до температуры Т3 при быстром снижении температуры, приводит к кристаллизации неустойчивой модификации А2, которая в дальнейшем перекристаллизовывается в устойчивую форму А1.
При монотропных превращениях переход одной модификации в другую необратим.

Невозможность перехода А1 в А2 обусловлена тем, что Р1 > Р2 (рис.15), а переход в направлении получения формы с большей упругостью пара противоречит первому и второму началам термодинамики.
Переход А1 в А2 возможен только путем расплавления неустойчивой модификации и последующим быстрым охлаждением расплава.
Рассмотренные превращения подчиняются правилу последовательных ступеней В.Оствальда: если вещество при данных условиях может образовывать несколько модификаций, то сначала кристаллизуется наименее устойчивая модификация, которая затем переходит в устойчивую через модификации промежуточной устойчивости.
Устойчивая модификация во всех случаях обладает меньшим давлением насыщенного пара, меньшей растворимостью (то есть меньшей химической активностью) и более высокой температурой плавления.
Примерами монотропных превращений могут являться переходы α в β модификации двухкальциевого силиката, превращение ромбического арегонита в тригональный кальцит.
Диаграмма состояния кремнезема
Диаграмма состояния кремнезема отличается сложным полиморфизмом (рис.16). Известны одиннадцать кристаллических полиморфных модификаций и две стеклообразные формы диоксида кремния.
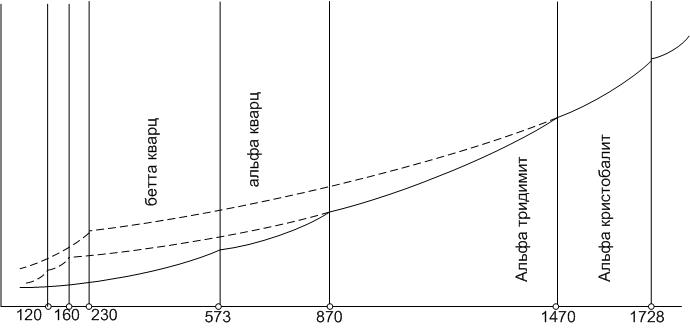
Рис.16. Диаграмма кремнезема с областями равновесных фаз
Кремнезем образует три главные кристаллические модификации: α-кварц, α-тридимит и α-кристобалит. Каждая из этих модификаций имеет, в свою очередь, несколько модификаций второго порядка, представленных на схеме полиморфных превращений кремнезема ниже:
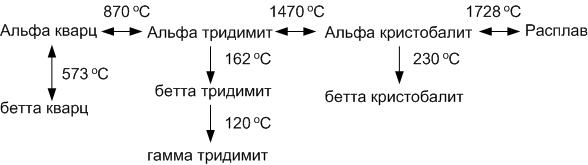
Все кристаллические модификации кремнезема можно разделить на две группы.
В первой группе представлены модификации, имеющие области стабильного существования на диаграмме (сплошные линии на рис.16). Это β- и α-кварц, α-тридимит, α-кристобалит. Пунктирными линиями на диаграмме показаны представители второй группы, не имеющие областей стабильного существования. Превращения внутри главной формы кремнезема (вертикальные ряды схемы полиморфных превращений) происходят быстро из-за незначительной перестройки кристаллической решетки. Превращения между главными формами кремнезема протекают медленно, в течение недель.
Указанные фазовые превращения ускоряются при введении в систему добавок минерализаторов: соединений щелочных и щелочноземельных металлов.
При изготовлении динасовых огнеупоров применяют в основном добавки оксидов кальция и железа.
Механизм действия добавок, вероятно, заключается в ускоряющем действии на процесс фазового перехода за счет появления в системе жидкой фазы, в которой растворяется неустойчивая и кристаллизуется устойчивая в данном температурном интервале полиморфная модификация кремнезема.
Все полиморфные модификации кремнезема сопровождаются изменениями плотности модификаций и, естественно, объемными превращениями.
При переходе от низко- к высокотемпературным формам кремнезема плотность снижается (табл.4). Объемные превращения при фазовых переходах могут достигать 15 и более процентов, что следует обязательно учитывать при проектировании технологических параметров (температура и скорости нагрева или охлаждения) процесса обжига изделий на основе сырья, содержащего кремнезем в свободном состоянии.
Таблица 4 – свойства полиморфных модификаций кремнезема
Полиморфная модификация |
Плотность, г/см3 |
Полиморфные превращения |
Изменение объема, % |
α-кварц |
2,53 |
α-кварц ↔ β-кварц |
+4,5 |
β-кварц |
2,65 |
α-кварц ↔γ-кристобалит |
+17,4 |
α-тридимит |
2,22 |
|
|
β-тридимит |
2,26 |
|
|
γ-тридимит |
2,26 |
|
|
α-кристобалит |
2,19 |
|
|
β-кристобалит |
2,32 |
|
|
расплав |
2,20 |
|
|
Диаграмма Феннера (рис.16) имеет больше теоретическое значение, так как на практике повсеместно наблюдаются отклонения от равновесного состояния из-за медленности превращений между главными формами кремнезема и высокой вязкости силикатного расплава.
Отклонения от равновесных состояний в системе кремнезема
Поскольку фазовые превращения между главными модификациями происходят очень медленно, при быстром нагревании могут перейти в расплав как α-кварц, так и α-тридимит, при этом температуры плавления этих модификаций ниже (соответственно 1610оС и 1710оС), чем у равновесной формы α-кристобалита – 1728оС.
С другой стороны, α-кристобалит при охлаждении превращается в нестабильный β-кристобалит, а α-тридимит в γ-тридимит, а не в равновесную форму кварца.
Расплав кремнезема легко переохлаждается, образуя кварцевое стекло, которое при температуре ниже 1000оС практически не кристаллизуется.
Из кварца при нагревании или кварцевого стекла при расстекловывании в качестве первичной фазы в широком интервале температур стремится выделиться кристобалит называемый метакристобалитом.
Дальнейшие возможные превращения протекают в соответствии с правилом Оствальда. Отклонения от равновесных состояний определяет тот факт, что в технических продуктах обжига (например, динасовом огнеупоре) основными кристаллическими фазами являются метастабильные в обычных условиях тидимит и кристобалит или кремнеземистое стекло.
Характеристика отдельных полиморфных модификаций кремнезема
Кварц (нем.Quarz) имеет две полиморфные модификации: α-кварц и β-кварц. Природной формой является β-кварц, α-кварц в земной коре не встречается. Обе модификации относятся к каркасным силикатам. Структура α-кварца слагается из тетраэдров [SiO4], причем все анионы кислорода каждого тетраэдра являются обобществленными. Угол наклона между двумя соседними тетраэдрами (угол связи Si – O – Si) составляет 150о.
Схематические особенности структуры кварца показаны на рис.17.
Рис.17. Структура кварца.
а – высокотемпературный α-кварц, б – низкотемпературный β-кварц
Группа тетраэдров в структуре кварца располагаются винтообразно вокруг некоторых осей, образуя спирали. В одной спирали тетраэдрами располагаются на разных уровнях: один тетраэдр (1) внизу, другой (2) – в середине и третий (3) – вверху. Эти тетраэдры дают один оборот спирали вокруг оси и затем последовательность слоев повторяется.
В одном кристалле кварца все спирали закручиваются в одну сторону, в другом – могут закручиваться в противоположном направлении. В зависимости от этого различают две формы кварца: левый (вращает плоскость поляризации света влево) и правый.
Структура α-кварца представляет собой несколько искаженную структуру β-кварца. При фазовом переходе происходит небольшое смещение катионов кремния, нарушая симметрию таким образом, что гексагональная ось превращается в тригональную. Сочленение между кремнекислородными тетраэдрами не нарушается.
С химической точки зрения кварц весьма устойчивое вещество. В воде практически нерастворим, из кислот его разрушают только плавиковая и фосфорная. Активнее кремнезем реагирует со щелочами, легко переходя в силикаты при сплавлении со щелочами или карбонатами щелочных металлов. Растворяют кварц также водные растворы едких и углекислых щелочей, особенно при нагревании.
Природный кварц является основным породообразующим минералом литосферы земли. Встречается в самых разнообразных формах: является составной частью многих горных пород, а также месторождений полезных ископаемых самого разнообразного генезиса. Наиболее важные для промышленности кварцевые материалы: кварцевые пески, кварциты (плотные, сцементированные или перекристаллизованные породы из зерен кварца) и кристаллический монокристальный кварц.
К скрытоскристаллическим разновидностям кварца относятся опал и халцедон, яшма и агат, кремень.
Цвет кристаллов, зерен и агрегатов кварца самый разнообразный. Чаще встречаются бесцветные, молочно-белые иди серые разновидности. Прозрачные или полупрозрачные красивоокрашенные кристаллы кварца получили особенные названия: бесцветные и прозрачные – горный хрусталь, фиолетовые – аметист, дымчатые – раухтопаз, черные – морион, золотисто-желтые – цитрин. Различные окраски обусловлены структурными дефектами при замене кремния в структуре тетраэдра на алюминий, железо с одновременным вхождением в кристаллическую решетку натрия, лития или гидроксил иона. В природе встречаются также сложноокрашенные кристаллы за счет микровключений посторонних минералов: золотистый мерцающий авантюрин – включения слюды или гематита.
Применение кварца разнообразно: изготовление строительного и художественного стекла, тонкой керамики (фаянс, фарфор), стеновой керамики, материалов автоклавного синтеза, растворов и бетонов на минеральных и органических вяжущих, огнеупоров различных видов.
Тридимит
Структура тридимита также слагается из кремнекислородных тетраэдров с углом связи в 180о. Характер связи в α-тридимите предопределяет крупную элементарную ячейку с менее плотной по сравнению с кварцем упаковкой: α и β модификации тридимита имеют структуру с несколько искаженной кристаллической решеткой главной модификации.
В технических и природных продуктах тридимит встречается в качестве продуктов расстекловывания технических стекол, а также образуется при перерождении кварца в динасовых огнеупорах при их длительной эксплуатации.
Кристобалит
Структура кристобалита слагается из кремнекислородных тетраэдров с углам силоксановой связи в 190о. Атомы кремния в структуре размещаются также, как атомы углерода в алмазе, то есть каждый атом находится в центре группы из четырех соседних атомов. Структура α-кристобалита построена из гексагональных плоских сеток тетраэдров. Сходную, но несколько искаженную структуру имеет β-кристобалит. β-кристобалит встречается в природных породах: опалах, бентонитах, может присутствовать в стеклах как продукт их расстекловывания, в динасе.
Сравнивая структуры модификаций первого порядка следует отметить, что их отличие состоит в разных схемах соединения тетраэдров друг с другом. Разница же между модификациями второго порядка не столь существенна: характер соединения не меняется, а несколько искажается симметрия структуры в результате смещения и вращения тетраэдров без разрыва каких-либо связей.
Модификации кремнезема, не присутствующие на диаграмме Феннера
На поверхности Земли или на незначительной глубине основной формой кремнезема, как мы уже отмечали, является кварц. Однако поиски иных форм кремнезема были связаны в первую очередь с тем, что температура и давление на глубине достигают высоких значений и это может приводить к качественным изменениям в структуре силикатов, основных породообразующих минералов. Экспериментируя с воздействием на кремнезем температурой и давлением были получены следующие модификации кремнезема: коэсит, китит, стишовит.
В исследованиях при высоких давлениях, предпринятых в США Л.Коэсом (Coes) в 1953 г, была получена при давлении около 3 ГПа новая фаза кремнезема, впоследствии названная коэситом. Плотность ее 3,01 г/см3. Это выше, чем у кварца, но анализ структуры показал, что кремний сохраняет в ней обычную координация по отношению к кислороду.
В 1961 г. молодые русские исследователи С.М.Стишов и С.В.Попова получили новую модификацию кремнезема (при давлениях 16 … 18*104 кг/см2 и температуре 1200 … 1400оС), названную стишовитом. Изучение физико-химических свойств стишовита показало, что его плотность, равная 4,35 г/см3 на 64% больше, чем у кварца, что объясняется изменением координации кремния с 4 на 6 по отношению к кислороду. Стишовит полностью устойчив к плавиковой кислоте, но хорошо растворяется в расплавах и растворах щелочей.
Кремнеземистое стекло
Кремнезем в виде стекла встречается в природе, а также легко получается искусственным путем. Обычное кремнеземистое стекло является наименее плотной формой кремнезема, обладая при этом рядом замечательных свойств:
высокая химическая стойкость. Стойкость против действия всех кислот, за исключением плавиковой и ортофосфорной;
низкий коэффициент термического расширения (КЛТР = 0,6*10-6 1/град);
способность к пропусканию ультрафиолетовых лучей;
высокая огнеупорность;
высокая упругость.
При длительной эксплуатации при высоких температурах (1000оС) кремнеземистое стекло может расстекловываться (кристаллизовываться), выделяя в кристаллической фазе α-кристобалит. Расстекловывание само по себе не приводит к разрушению изделий, так как объемные деформации при этом невелики. Однако, если после длительной работы при высоких температурах изделие охладить ниже 150 … 275оС, оно может разрушиться под воздействием напряжений, возникающих при фазовом переходе α → β-кристобалит.
Диаграммы состояния двухкомпонентных систем
При наличии в системе двух компонентов фазовые превращения усложняются: наряду с фазовыми превращениями, полиморфными модификациями компонента могут происходить и другие процессы, обусловленные взаимодействием компонентов.
Это определяет многообразие типов диаграмм систем с двумя компонентами. Рассмотрим сначала основные типы диаграмм, а затем некоторые диаграммы силикатных систем, практически применяемых в производстве вяжущих веществ, керамики, огнеупоров и некоторых других строительных материалов.
5.6.1. Диаграмма двухкомпонентной системы с одной точкой эвтектики
Для конденсированных систем, содержащих два компонента, максимальное число степеней свободы равно двум. При этом в качестве независимых термодинамических параметров принимают температуру и концентрацию первого компонента [С1]. Концентрация второго компонента [C2] рассчитывается по формуле: С2 = 100 – С1. Вертикальная ость диаграммы – ось температуры, горизонтальная ось – ось концентрации компонентов.
Внешний вид диаграммы приведен на рис.18. Левый конец горизонтальной оси концентраций компонентов, обозначенный буквой А, соответствует 100% содержанию компонента А, правый – 100% содержанию компонента В.
Рассмотрим основные элементы диаграммы.
Та и Тв – соответственно температуры плавления чистых компонентов А и В. Если точка состава находится на одной из вертикальных осей диаграммы (на А или В), то в этом случае мы рассматривает процессы, происходящие в однокомпонентной системе.
Кривые Та-Е и Е-Тв носят название кривых ликвидуса.
Кривые ликвидуса представляют собой температурные зависимости перенасыщения расплава по отношению к какому-либо компоненту или химическому соединению. Кривая Та-Е показывает температуру начала кристаллизации в системе компонента А из расплава при его охлаждении, кривая Е-Тв – соответственно начала кристаллизации компонента В.
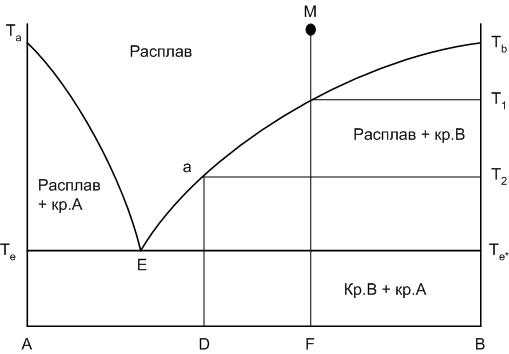
Рис.18. Диаграмма двухкомпонентной системы
Точка Е носит название точки эвтектики и характеризует состав расплава с минимальной для данной системы температурой существования жидкой фазы: расплав эвтектического состава. Этот расплав пересыщен одновременно по отношению к обоим компонентам А и В. При кристаллизации расплава эвтектического состава компоненты выделяются в твердой фазе всегда в строго определенном соотношении, определяемом положением точки эвтектики.
Линия Те-Е-Те* носит название линии солидуса. Это линия окончания кристаллизации или начала плавления любого бинарного состава системы. Ниже линии солидуса в равновесии могут находиться только фазы в твердом состоянии. Следует также отметить, что линия солидуса не всегда горизонтальна.
Диаграмма равновесия позволяет определять последовательность фазовых превращений в системе при ее нагреве или охлаждении, фазовые равновесия при любых параметрах системы, рассчитывать количественное соотношение равновесных фаз при заданных условиях равновесия.
Рассмотрим последовательность фазовых превращений, происходящих при охлаждении исходного состава системы М (рис.18). Следует отметить, что если рассматривать нагрев исходного состава системы М, то последовательность фазовых превращений будет обратной его охлаждению, поэтому в дальнейшем мы будем рассматривать только кристаллизацию исходных составов.
Итак, начинаем охлаждать с постоянной скоростью расплав, соотношение компонентов в котором определяется точкой М.
Выше температуры Т1 в равновесии находится расплав Lm состава М. Число степеней свободы при этом равно двум: можно в некоторых пределах изменять температуру и состав системы (добавляя, например, в расплав кристаллы одного из компонентов, которые сразу же плавятся) без изменения фазового равновесия.
Указанное фазовое равновесие будет наблюдаться при охлаждении до температуры Т1. При температуре Т1, когда вертикаль исходного состава касается линии ликвидуса, расплав становится пересыщен по отношению к компоненту В, и начинается его кристаллизация. Так как степень свободы при этом становится равной единице, то при дальнейшем охлаждении при продолжающейся кристаллизации компонента В состав расплава будет меняться строго по линии ликвидуса.
Например, при температуре Т2 расплав будет иметь состав, определяемый положением точки а на линии ликвидуса Е-Тв.
Таким образом, на диаграмме в области, ограниченной точками Е-Тв-Те* в равновесии будут находиться две фазы: кристаллы компонента В и расплав, состав которого зависит от рассматриваемой температуры системы.
Горизонтальная линия, проведенная при температуре Т2 от линии ликвидуса до вертикали выпадающей твердой фазы, носит название конноды.
При достижении температуры эвтектики состав расплава становится равным Lm и начинается кристаллизация компонента А. В равновесии будут находиться уже три фазы: расплав, кристаллы А и В. Степень свободы при этом становится равной нулю. Таким образом, точка эвтектики на диаграмме определяет нонвариантное состояние. Дальнейшее понижение температуры невозможно без изменения числа равновесных фаз. Поэтому в точке эвтектики закончится кристаллизация исходного состава системы, а пропадающей фазой при этом будет расплав. По окончании кристаллизации система становится моновариантной, и дальнейшее понижение температуры приводит к охлаждению смеси кристаллов А и В.
Фазовые изменения любого другого бинарного состава системы будут протекать аналогично рассмотренному. Исключение составляет исходный состав, совпадающий с точкой эвтектики. Для него при температуре Те начинается одновременная кристаллизация компонентов А и В и при этой же температуре кристаллизации закончится.
Фазовые изменения исходного состава системы М или его путь кристаллизации удобно представить в виде (табл.5).
В таблице запись Lm- > е следует понимать так: состав расплава меняется от точки М к точке е. Для определения состава расплава, как и любой другой точки системы из искомой точки опускается перпендикуляр на ось концентраций: точка пересечения этих прямых
Таблица 5 – фазовые изменения системы при охлаждении
Температура |
Равновесные фазы |
Степень свободы |
Т = То |
Lm |
2 |
Т = Т1 |
Lm + кр.В |
1 |
Те < Т < Т1 |
Lm- > е + кр.В |
1 |
Т = Те |
Lе + кр.А +кр.В |
0 |
Т < Те |
кр.А + кр.В |
1 |
определяет соотношение компонентов в расплаве.
Для упрощения записей в дальнейшем по тексту лекций мы не будем употреблять для записи кристаллической фазы сокращение [кр.], а только наименование компонента (А или В) или химического соединения, например АВ.
5.6.2. Правило рычага
По диаграммам равновесия двухкомпонентных систем можно определять не только качественно фазовые равновесия, но и рассчитывать количественное соотношение равновесных фаз.
Для этого используется правило рычага: если одна фаза в системе распадается на две, то количество образовавшихся фаз обратно пропорционально отрезкам, заключенным между точкой исходного состава и точками составов образовавшихся фаз.
Покажем работу правила на примере. Пусть Q – масса исходного расплава состава М (рис.18). При охлаждении исходного состава до температуры Т2 выделилось некоторое количество кристаллов компонента В. Обозначим это количество кристаллов через Х.
В исходном расплаве при температуре выше Т1 количество компонента А определяется как
А = (Q*FB) / 100
При температуре Т2 количество компонента А в расплаве определяется как
А = (Q – X)*DB / 100.
Учитывая, что при кристаллизации исходного расплава до температуры Т2 количество компонента А не изменялось, мы вправе записать
(Q*FB) / 100 = (Q – X)*DB / 100
Из последнего уравнения имеем количество кристаллов как
X = Q*(DB – FB) / DB = (Q*DB) / DB
и количество расплава
Q – X = (Q*FB) / DB.
Отношение равновесных фаз при температуре Т2 (кристаллов к расплаву) будет определяться следующим образом:
X / (Q – X) = (Q*DF*DB) / (DB*Q*FB) = DF / FB.
Таким образом, отрезок DB определяет общее количество равновесных фаз, отрезок DF – количество кристаллической фазы, FB – количество оставшегося в системе расплава.
Для практического использования правила рычага при решении задач фазового равновесия необходимо за 100% принять отрезок, ограниченный составами равновесных в данных условиях фаз. Точка исходного состава будет обязательно находиться на этом отрезке и делить его в пропорциях, соответствующих равновесным фазам.
5.6.3. Построение диаграмм состояния
Построение равновесных диаграмм основано на изучении количества и состава фаз при различных температурах. Для таких целей используют два метода: динамический (метод кривых охлаждений) и статический (метод закалки).
Суть динамического метода заключается в построении кривых охлаждения (нагревания) для исходных составов системы в координатах температура-время при постоянной скорости изменения температуры. При этом с помощью специального оборудования обнаруживаются тепловые эффекты, вызываемые физико-химическими процессами, происходящими в системе: полиморфные превращения, химические реакции, кристаллизация и плавление, разложение соединений системы.
Построение диаграммы равновесия двухкомпонентной системы А-В заключается в анализе кривых охлаждения (рис.19). Для этого составляют смеси компонентов А и В при их различном соотношении и нагревают навеску до полного ее плавления. Получаемый расплав выдерживается для достижения полной гомогенизации, а затем охлаждается с постоянной скоростью и фиксированием температуры смеси во времени.
Если рассматривается точка, содержащая 100% компонента (кривые А или В), то на кривой охлаждения появляется горизонтальная площадка кристаллизации, температура которой соответствует температуре кристаллизации данного компонента. Число степеней свободы при этом равно 0, то есть пока не изменится число фаз (в равновесии находятся одновременно расплав компонента и его кристаллы) температура системы изменяться не может. Если мы рассматриваем процесс охлаждения системы, то после окончания кристаллизации (расплав пропадает) в равновесии будет находиться только одна фаза – кристаллы, и температура навески начнет понижаться. На диаграмму находятся соответственно точки кристаллизации компонентов А и В на вертикалях, соответствующих 100% содержанию каждого из них (ta и tв).
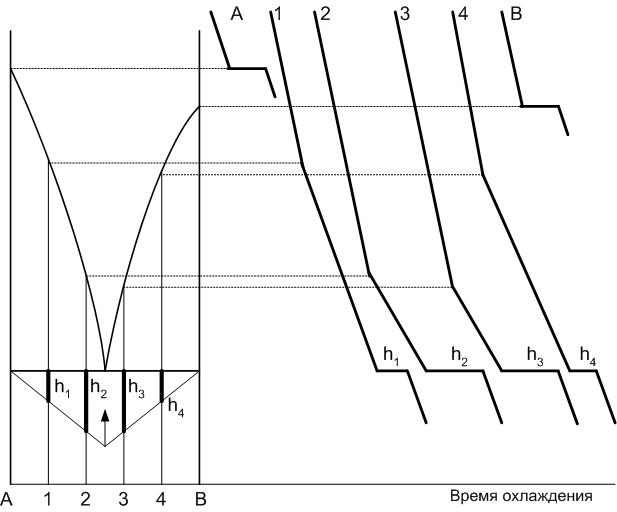
Рис.19. Построение диаграмм равновесия по кривым охлаждения
Если охлаждается смесь компонентов (например, состав 1, в котором содержание компонента А = 80%, а компонента В = 20%), то при какой-то температуре расплав становится перенасыщенным по отношению к одному из них. Начинается кристаллизация компонента (в нашем примере компонента А). Так как процесс кристаллизации носит экзотермический характер, то выделяющееся при этом тепло уменьшает скорость охлаждения системы и на кривой охлаждения это фиксируется появлением угла наклона.
Точка перегиба проецируется на вертикаль исходного состава диаграммы. Аналогично наносятся другие точки составов, принадлежащие кривым ликвидуса диаграммы.
Для всех смесей при температуре эвтектики появляется площадка кристаллизации, когда происходит кристаллизация расплава эвтектического состава. Величина горизонтальной площадки, соответствующей этому процессу, будет зависеть от исходного состава системы и будет максимальна для состава Е. Указанное выше положено в основу построения треугольника Таммана для определения точного положения некоторых точек диаграммы. В нашем случае перпендикулярно эвтектической горизонтали для каждого состава системы откладывается длина горизонтальных площадок h1, h2, h3, h4, через концы которых проводят прямые линии. Их взаимное пересечение указывает на точное положение эвтектического состава системы.
Анализ кривых охлаждения позволяет установить также положение на диаграмме линий полиморфного превращения, химических соединений, точек эвтектики и перитектики.
Для силикатных систем, скорость установления равновесного состояния в которых невелика, динамический метод дает не всегда корректный результат. В этом случае пользуются статическим методом: гомогенизированную смесь компонентов нагревают до заданной температуры, выдерживают длительное время при этой температуре, а затем резко охлаждают. Затем методами химического анализа проводят определение состава и количества образовавшихся фаз. Эта процедура для одного состава многократно повторяется при изменении температуры выдержки и по полученным результатам строят диаграмму равновесия. Метод отличается высокой точностью, но большей, чем в динамическом методе, трудоемкостью.
5.6.4. Диаграмма состояния двухкомпонентной системы с химическими соединениями
Зачастую между компонентами системы наблюдается химическое взаимодействие с образованием химических соединений. Рассмотрим такие типы диаграмм. На рис.20 представлены диаграммы равновесия со всеми типами химических соединений: плавящимися конгруентно (без разложения) – AmBn, инконгруентно (с разложением) – АВ и разлагающимся в твердой фазе – ApBq.
Составы химических соединений на диаграмме показываются сплошными вертикальными линиями, проведенными из точки соотношения компонентов в химических соединениях.
Так как соединение AmBn плавится конгруентно, то состав его соответствует составу расплава, получаемого при плавлении соединения, то есть линия состава химического соединения обязательно доходит до линии ликвидуса при температуре плавления химического соединения. Диаграмма по линии соединения AmBn делится на две части, каждая из которых представляет собой отдельную диаграмму. В этом смысле никаких отклонений в кристаллизации исходных составов системы от ранее рассмотренных не будет. Если исходный состав системы соответствует составу химического соединения, то кристаллизация его начнется и закончится при температуре
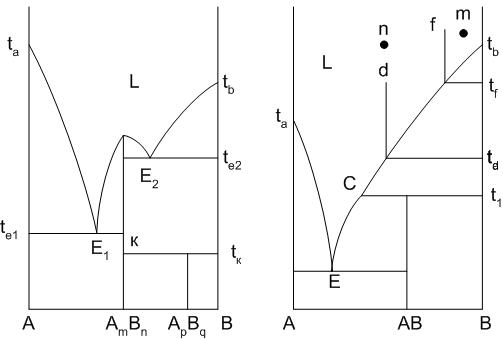
Рис.20. Диаграммы равновесия двухкомпонентных систем с химическими соединениями
плавления химического соединения AmBn (как для отдельного компонента).
Вертикальная линия состава химического соединения ApBq, разлагающегося в твердой фазе при нагревании доходит до горизонтальной линии к – tk, проведенной при температуре разложения ApBq. Концы линии указывают на составы образующихся при разложении химического соединения ApBq фаз (точка к – кристаллы химического соединения AmBn, точка tк – кристаллы компонента В).
Отличительной особенностью диаграммы с химическим соединением, плавящимся инконгруентно, является то, что вертикаль состава химического соединения АВ не доходит до линии ликвидуса E-C-tв. При температуре Т1 при нагревании химическое соединение плавится с разложением на расплав состава Lc и кристаллы компонента В, при этом состав расплава не соответствует составу химического соединения (точка состава расплава С и вертикаль химического соединения не совпадают).
Точка С на диаграмме – точка перитектики. Эта точка, в которой начинается и протекает химическая реакция взаимодействия ранее выделившегося в кристаллическом состоянии компонента В и расплава Lc с образованием химического соединения АВ: кр.В + Lc = AB. В точке перитектики в равновесии находятся одновременно три фазы, определяющиеся нонвариантное состояние системы. Пока одна из фаз не исчезнет, температура изменяться не может. Какая фаза пропадает в результате протекания химической реакции, зависит от точки исходного состава системы. Если исходный состав системы содержит компонента В больше, чем его находится в химическом соединении АВ (точка М на рис.20), то в результате протекания химической реакции в точке перитектики пропадет расплав, в равновесии останутся две кристаллические фазы: АВ и В. Если исходный состав системы содержит компонента В меньше, чем его находится в химическом соединении АВ (точка N на рис.20), то в результате протекания химической реакции в точке перитектики пропадет компонент В, в равновесии останутся расплав состава С и АВ. И в том случае, когда в исходном составе системы количество компонента В совпадает с его количеством в химическом соединении, то в результате протекания химической реакции в точке перитектики пропадут как В, так и расплав: в равновесии останутся только кристаллы химического соединения АВ. Пути кристаллизации исходных составов системы приведены в табл.6.
Таким образом, кристаллизация исходных составов системы может закончиться как в точке эвтектики, так и в точке перитектики.
Таблица 6
Температура |
Равновесные фазы |
Примечание |
Состав а: |
||
T > Ta |
La |
|
T = Ta |
La + кр.В |
|
T1 < T < Ta |
La→c + кр.В |
|
T = T1 |
Lc + кр.В = AB |
Начало химической реакции, в резуль- тате которой исчезает В |
T < T1 |
Lc + AB |
|
и далее по диаграмме |
||
Состав в: |
||
T > Tв |
Lв |
|
Т = Тв |
Lв + кр.В |
|
Т1 < T < Тв |
Lв > c + кр.В |
|
T = T1 |
Lc + кр.В = AB |
Начало химической реакции, в резуль- тате которой исчезает Lc |
T < T1 |
B + AB |
|
и далее по диаграмме |
||
5.8.5. Диаграмма состояния двухкомпонентной системы с явлением ликвидации
Ликвация – расслоение жидкости на две, каждая из которых имеет свой состав и свои свойства.
Внешний вид диаграммы показан на рис.21. Область концентраций, для которых наблюдается явление ликвации, ограничена кривой F-L1-L2-G. Пути кристаллизации составов данной диаграммы приведены в табл.7.
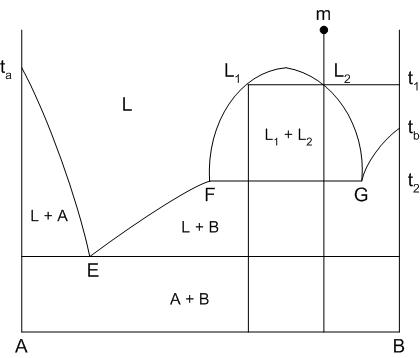
Рис.21. Диаграмма состояния двухкомпонентной системы с явлением ликвации
Таблица 7 – фазовые изменения в системах с лиувацикй
Температура |
Равновесные фазы |
Примечание |
Состав m: |
||
T = T1 |
L1 + L2 |
Расслоение жидкой фазы на две |
T2 < T < T1 |
L1→f + L2→g |
|
T = T2 |
Lf + Lg + B |
Кристаллизация В идет из расплава Lg |
Te < T < T2 |
Lf→e + B |
|
T = Te |
Le + B + A |
|
T < Te |
B + A |
|
Кристаллизация компонента В при температуре Т2 идет из расплава, который содержит в себе большее количество этого компонента, то есть из расплава G, состав которого меняется по прямой GF к точке F. В точке F составы расплавов сравниваются и ликвация как явление пропадает.
5.8.6. Диаграммы состояния двухкомпонентных систем с твердыми растворами
Если содержащиеся в твердом растворе компоненты могут смешиваться в любых соотношениях, то мы имеем дело с твердыми растворами неограниченной растворимости или непрерывным рядом твердых растворов (рис.22).
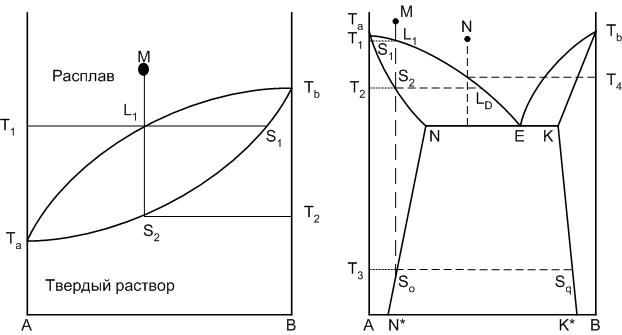
Рис.22. Диаграммы равновесия двухкомпонентных систем с твердыми растворами
При наличии однофазного твердого раствора из двух компонентов, находящегося в равновесии с расплавом, состоящим их тех же компонентов, степень свободы системы будет равна единице, то есть каждой температуре соответствует строгая концентрация компонентов в твердом растворе и расплаве. На диаграмме появляется кривая, показывающая изменение состава твердой фазы при изменении температуры (кривая Та-S1-Тв). Составы равновесных расплава и твердого раствора определяются концами конноды, проведенной при заданной температуре, например между точками L1 и S1. Когда точка М достигнет линии ликвидуса, начинается кристаллизация твердого раствора S1. При дальнейшем понижении температуры состав жидкости меняется по кривой ликвидуса, состав твердого раствора – по кривой солидуса. При температуре Т2, когда состав твердого раствора совпадает с исходным составом системы, кристаллизация закончится. Изменение состава твердого раствора в процессе кристаллизации происходит за счет диффузии атомов или ионов одного компонента в кристаллической решетке.
Если смешиваемость компонентов происходит лишь до некоторых пределов концентраций, то такой твердый раствор называется твердым раствором с ограниченной растворимостью. При эвтектической температуре в равновесии с расплавом находятся два твердых раствора: α и β. Точки N и К – точки предельной концентрации твердых растворов, которая изменяется при понижении температуры по линиям предельной растворимости (например, для твердого раствора α линия предельной растворимости компонентов А и В – N-N*).
На диаграмме составов, пути кристаллизации которых отличаются друг от друга, можно выделить три интервала: А-N*, N*-N, N-E, если рассматривать точку эвтектики как точку симметрии диаграммы. Пути кристаллизации составов, находящихся в интервале A-N*, не отличаются от путей кристаллизации составов с твердыми растворами неограниченной растворимости (рис.22 а). Пути кристаллизации других составов системы приведены в табл.8.
Таблица 8 – фазовые изменения в системах с твердыми растворами
Температура |
Равновесные фазы |
Примечание |
Состав m: |
||
Т = Т1 |
L1 + тв.р-р |
Состав твердого раствора – S1 |
Т→Т2 |
L(1→D) + S(1→2) |
|
Т = Т2 |
тв.р-р (S2) |
Кристаллизация закончилась |
Т = Т3 |
тв.р-р (So)+ тв.р-р (Sq) |
Разделение в твердой фазе на два раствора |
Т < Т3 |
тв.р-р (So- > n*) тв.р-р (Sq- > k*) |
Изменение концентрации твердых растворов по линиям предельной растворимости |
Состав n: |
||
Т = Т4 |
тв.р-р (S4) + расплав L4 |
(составы условно не показаны) |
Т = Те |
тв.р-р (Sn)+ тв.р-р (Sk)+ |
Кристаллизация закончилась |
Т < Те |
тв.р-р (Sn- > n*) тв.р-р (Sk- > k*) |
Изменение составов твердых растворов |
Практическое значение диаграмм состояния уравнения двухкомпонентных систем
Для производства строительных материалов большое значение имеют составы исходных смесей, подобранные на основе диаграмм двухкомпонентных систем СаО – SiO2, CaO – Al2O3, Al2O3 + SiO2 и ряда других. Рассмотрим подробнее указанные системы.
5.8.1. Система CaO – SiO2
Система имеет важное техническое значение при производстве портландцементного клинкера и цементов на его основе. Диаграмма системы показана на рис.23.
В данной системе существуют четыре химического соединения: C3S, C2S, C3S2, CS.
Метасиликат кальция CaO*SiO2 (CS). Структура минерала относится к цепочечным силикатам Ca[SiO3]. Минерал имеет две полиморфные модификации: α-CS и β-CS.
Высокотемпературная модификация: псевдоволлостанит α-CS встречается в продуктах кристаллизации стекол и шлаков. Природный воллостанит β-CS кристаллизуется из стекол при температуре 1000оС в виде длинных иголок.
Трехкальциевый дисиликат 3CaO*2SiO2: Ca3[Si2O7]. Минерал плавится инконгруентно при температуре 1364оС, разлагаясь на белит и расплав состава 44,5% кремнезема и 55,5% CaO. В природе встречается в виде редкого минерала ранкинита: обнаружен в некоторых технических продуктах, например в доменных шлаках.
Двухкальциевый силикат 2CaO*SiO: Ca2[SiO3]. Минерал относится к ортосиликатам кальция. Главная структурная особенность ортосиликата кальция – склонность к образованию полиморфных модификаций (рис.24).
Т ри
из четырех полиморфных модификаций
имеют область стабильного существования.
Метастабильная форма отросиликата
кальция – β
модификация не имеет при нормальном
давлении температурной области
устойчивого существования, но может
существовать при определенных условиях
при температуре ниже 675оС.
ри
из четырех полиморфных модификаций
имеют область стабильного существования.
Метастабильная форма отросиликата
кальция – β
модификация не имеет при нормальном
давлении температурной области
устойчивого существования, но может
существовать при определенных условиях
при температуре ниже 675оС.
Все превращения, за исключением β → γ, носят энантиотропный характер. При охлаждении расплава сначала кристаллизуется α-C2S, переходящая при понижении температуры в α’-C2S. Теоретически при дальнейшем охлаждении должен кристаллизоваться γ-C2S, однако на практике реализуется правило Оствальда: последовательность полиморфных модификаций α → β → γ. Это объясняется меньшими структурными изменениями системы при переходе α → β.
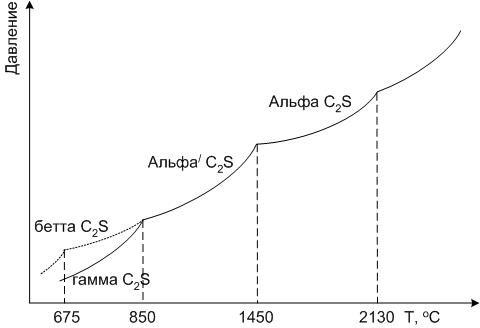
Рис.24. Схема полиморфных превращений двухкальциевого силиката
Для всех модификаций ортосиликата кальция характерно то, что они построены из независимых кремнекислородных тетраэдров, связанных между собой катионами кальция с координационным числом 6 … 9.
Плотность α-C2S составляет 3,28 г/см3, плотность β-C2S – 2,97 г/см3; указанный выше переход сопровождается расширением системы на 12% и самопроизвольным переходом минерала в тонкодисперсное состояние. Этот процесс носит название «силикатный распад».
Модификация, в которой ортосиликат кальция присутствует в технических продуктах, оказывает решающее значение на их свойства. Только нестабильный β-C2S обладает гидравлической активностью и является основным минералом портландцементного клинкера. Поэтому на практике при производстве цемента необходимо получить ортосиликат кальция в виде его метастабильной модификации, предотвратив переход β-C2S в γ-C2S.
Указанная стабилизация может осуществляться различными способами. Одним из них является кристаллохимическая стабилизация, основанная на образовании ортосиликатом кальция твердых растворов с оксидами бария, хрома, фосфора, которые вводятся в состав шихты в количестве до 1%.
Другая форма стабилизации – понижение температуры термической обработки сырья до 1050 … 1100оС, а также быстрое охлаждение клинкера, когда не происходит перегруппировка атомов кристаллической решетки. Кроме того, быстрое охлаждение сохраняет в продуктах обжига стекловидную фазу, обволакивающую зерна ортосиликата кальция и механически препятствующую их расширению.
γ-C2S, стабильный при нормальных температурах, не обладает гидравлической активностью: небольшое количество ионов-сульфатов и ионов хлора усиливают его вяжущие свойства.
Трехкальциевый силикат 3CaO*SiO2: Ca3[SiO5]. Основной минерал портландцементного клинкера, представленный в нем в виде твердого раствора C3S с оксидами алюминия и магния. Чистый C3S разлагается ниже температуры 1250оС на отросиликат кальция и СаО. Распад трехкальциевого силиката предотвращается резким охлаждением, поэтому при комнатной температуре минерал находится в метастабильном состоянии, что усиливает его вяжущие свойства.
5.8.2. Система Al2O3 – SiO2
На рис.25 приведена диаграмма состояния диаграмма состояния системы Al2O3 – SiO2 по Н.А.Торопову и Ф.Я.Галахову. Согласно этой диаграмме химическое соединение 3Al2O3*2SiO2 – муллит плавится конгруентно при температуре 1910оС и имеет две эвтектики: одну с кремнеземом при температуре 1585оС, другую с твердым раствором глинозема в муллите и глиноземом при 1850оС. Область твердых растворов муллита с глиноземом находится в пределах 71,8 … 78% Al2O3.
Особенностью диаграммы является пологий характер кривой ликвидуса Е1-С, что свидетельствует о быстром нарастании количества жидкой фазы при нагревании и быстрой кристаллизации при охлаждении.
Муллит редко встречается в природе, в основном как продукт действия огненно-жидких лав на глинистые породы. Чаще муллит встречается в составе технических силикатов: алюмосиликатных огнеупоров, фарфора, строительной керамики и т.п. как конечный продукт обжига глин и каолинов:
3(Al2O3*2SiO2*2H2O) → 3Al2O3*2SiO2 + 4SiO2 + 6H2O.
Муллит обладает высокой химической стойкостью и огнеупорностью.
На основе диаграммы приготавливаются составы шихты для производства шамотных, муллитовых, корундовых и динасовых огнеупоров, муллитовой и корундовой технической керамики.
Шихта с содержанием 0,2 … 1,0% оксида алюминия является сырьем для производства динасовых (кремнеземистых) огнеупоров. Их огнеупорность составляет 1730оС, механическая прочность 15 … 35 МПа. Изделия обладают малой термической стойкостью и используются для кладки сводов и стен мартеновских и стекловаренных печей.
При 40 … 60% глинозема в составе шихты она используется для производства шамотных огнеупоров, характеризующихся высокой термической стойкостью.
Высокоглиноземистые огнеупоры (температура огнеупорности до 2000оС) содержат в составе шихты от 60 до 90% оксида алюминия. Плавленый корунд (Al2O3 до 99%) получают путем высокотемпературного обжига технического глинозема. Корундовые огнеупоры обладают высокой химической стойкостью, стойкостью против абразивного воздействия и эрозии.
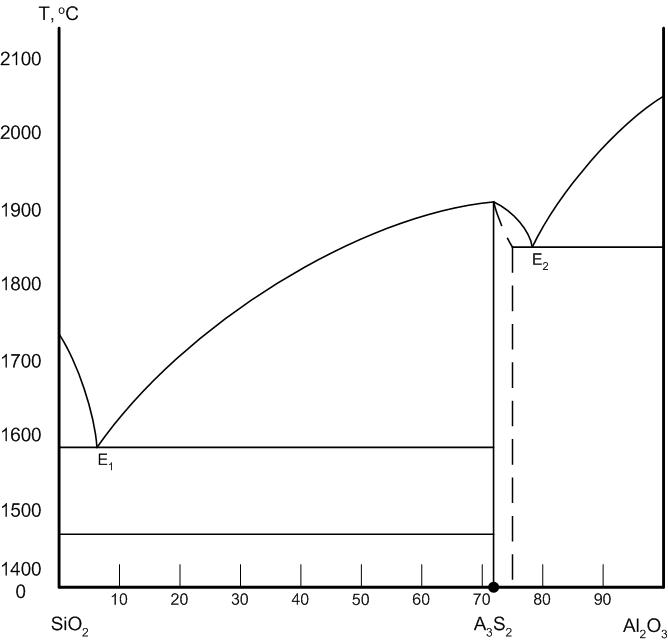
Рис.25. Диаграмма Al2O3 – SiO2
5.8.3. Система CaO – Al2O3
Диаграмма, представленная на рис.26, не отностится к силикатным системам, но используется в производстве портландцемента, глиноземистого и высокоглиноземистого цементов, технической керамики.
В системе существуют пять химических соединений: С3А, С5А3, СА, СА2, СА6.
Трехкальциевый алюминат 3CaO – Al2O3 – один из минералов портландцементного клинкера, имеет высокую гидравлическую активность, обеспечивает быстрое твердение цемента, ответственен за долговечность изделий на основе портландцемента.
Минерал 5CaO –3 Al2O3 содержится в составе глиноземистого цемента, обладая малой гидравлической активностью. Состав минерала иногда в технической литературе изображают формулой С12А7.
Моноалюминат кальция CaO – Al2O3 – основной минерал глиноземистого цемента. Образует твердые растворы с оксидами железа и других металлов. Обладает высокой скоростью взаимодействия с водой.
Минерал CaO – 2Al2O3 содержится в небольших количествах в глиноземистом и является основным минералом высокоглиноземистого цемента.
CaO – 6Al2O3 – малоизученное соединение, найденное в плавленом корунде.
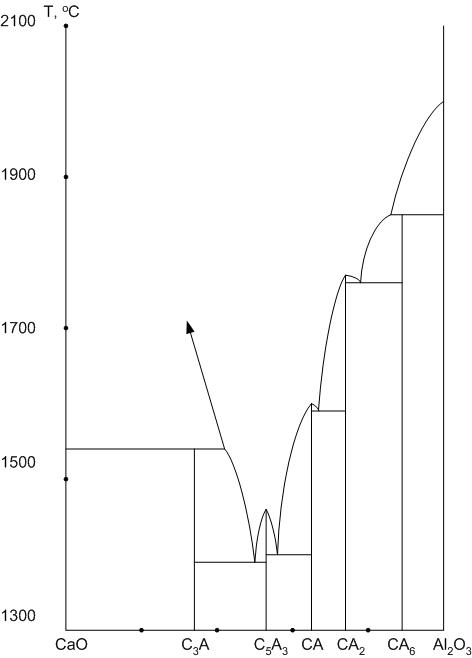
Рис.26. Диаграмма CaO – Al2O3
Контрольные вопросы
Что представляет собой диаграмма двухкомпонентной системы?
Какие термодинамические параметры системы являются независимыми?
Назовите и дайте краткую характеристику элементов диаграммы двухкомпонентной системы?
Определите условия, при которых кристаллизация исходных составов системы заканчивается в точке перитектики.
С какой целью на диаграммах используется правило рычага? Сформулируйте это правило.
Рассмотрите путь кристаллизации исходного состава N на рис.20.
Дайте характеристику минералов в системе CaO – SiO2, CaO – Al2O3, SiO2 – Al2O3. Расскажите о строительных материалах, в основе производства которых находятся эти диаграммы.
Какими способами можно обеспечить стабилизацию силикатных минералов портландцементного клинкера?
Можно ли огнеупор состава 30% SiO2+ 70% Al2O3 нагревать до температуры 1700оС?
Основная литература [13], дополнительная литература [1, 2].
Диаграммы состояния трехкомпонентных систем
Для трехкомпонентых систем согласно правилу Гиббса максимальная величина числа степеней свободы равна 3. При этом в качестве независимых параметров выступают температура, концентрация первого С1 и второго С2 компонентов. Концентрация третьего компонента зависит от первых двух: С3 = (100 - С1 – С2).
Диаграмма является пространственной фигурой: концентрации компонентов откладываются на сторонах равностороннего треугольника (треугольника концентраций), а температура – на перпендикуляре, проведенном к плоскости треугольника концентраций (рис.27).
В целом диаграмма представляет собой призму, грани которой образованы соответствующими двухкомпонентными диаграммами.
На диаграмме трехкомпонентной системы вместо линий появляются поверхности ликвидуса, например: А*-Е1*-Е*-Е3*-А*, С*-Е2*Е-Е3*-С*, В*-Е1*-Е*-Е2*-В*, при пересечении которых образуются пограничные кривые Е1*-Е*, Е2*-Е*, Е3*-Е, сходящиеся в точке тройной эвтектики Е*. Поверхность ликвидуса имеет те же свойства, что и кривая ликвидуса: показывает температуру начала кристаллизации (конца плавления) любого состава системы; состав насыщенной жидкой фазы находится в равновесии с твердой фазой при данной температуре.
Для удобства работы пользуются проекционными диаграммами, которые образуются при проецировании на плоскость треугольника концентраций всех элементов строения пространственной диаграммы. Температура на диаграмме показывается в этом случае изотермами, получаемыми пресечением пространственной диаграммы плоскостями, параллельными треугольнику концентраций при фиксированном значении температуры. Часто изотермы на проекционной диаграмме не показываются вообще, чтобы не усложнять изображение.
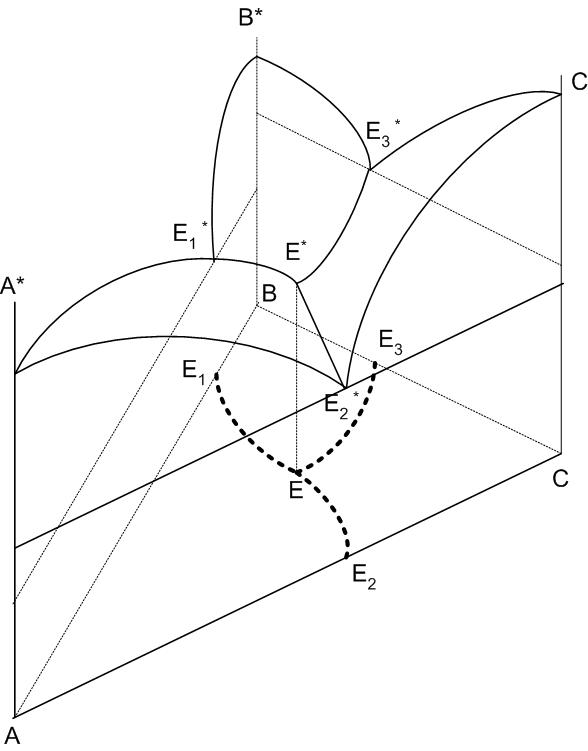
Рис.27. Пространственная диаграмма трехкомпонентной системы
Пограничные линии разделяют треугольник концентраций на поля первичной кристаллизации соединений, существующих в данной системе. Например, на рис.28 поле Е1-В-Е2-Е-Е1 – поле первичной кристаллизации компонента В, А-Е1-Е-Е3-А – компонента А и С-Е3-Е-Е2-С – компонента С.
Состав кристаллов в поле первичной их кристаллизации отмечается кружком.

Рис.28. Проекционная диаграмма трехкомпонентной системы
Точки составов двойных соединений находятся на сторонах треугольника, точки составов тройных химических соединений – внутри его. Точки составов химических соединений или компонентов системы, имеющие смежные поля первичной кристаллизации, соединяются тонкими прямыми линиями, носящими название соединительных прямых. Соединительные прямые разбивают всю диаграмму на отдельные элементарные треугольники, каждый из которых может рассматриваться как отдельная диаграмма трехкомпонентной системы.
Вершина проекционного треугольника соответствует 100% содержанию компонента, название которого находится у данного угла. Если точка состава находится на стороне треугольника, то ее количественный состав определяется как для двухкомпонентной системы, например состав точки Е1 на рис.28 содержит 60% компонента В и 40% компонента А. Если точка исходного состава находится внутри треугольника, то ее состав можно определить следующим образом. Через точку (точка М на рис.28) проводятся прямые, параллельные сторонам проекционной диаграммы. Прямые рассекают каждую строну проекционной диаграммы на три отрезка, каждый из которых определяет количественное содержание одного из компонентов. Например, для стороны СВ отрезок Сс определяет количество компонента В в точке М, отрезок cd – количество компонента А и отрезок dB – количество компонента С. Несложно геометрически доказать, что стороны треугольника разбиваются на три равных по величине отрезка и безразлично, на какой из сторон проводить определение. В общем случае необходимо помнить, что средний отрезок определяет количество компонента противоположного угла диаграммы, а отрезки, примыкающие к углам диаграммы, определяют количество компонентов, принадлежащих данной стороне в обратной пропорции. Это правило будет работать и в том случае, когда рассматриваемая диаграмма не является равносторонним треугольником (например, рассматривается элементарный треугольник какой-либо трехкомпонентной системы). При этом длину стороны, на которой проводятся определения, следует принять за 100%, рассчитав затем процентное содержание каждого компонента.
Для успешной работы с диаграммами трехкомпонентных систем необходимо освоить ряд правил, которые будут излагаться ниже по ходу рассмотрения различных типов диаграмм.
Диаграмма состояния трехкомпонентной системы с точкой тройной эвтектики
Общий вид диаграммы приведен на рис.29. Для рассмотрения путей кристаллизации составов трехкомпонентной системы на пограничных кривых стрелками отмечается направление понижения температуры.
Правило 1:
Температура всегда понижается от точки пересечения пограничной кривой (или ее продолжения) с соединительной линией (или ее продолжения), соединяющей точки составов фаз, поля кристаллизации которых разделяет данная пограничная кривая. На пограничной кривой в точке ее пересечения с соединительной линией будет находиться температурный максимум.
Правило 1 иллюстрируется рис.30. Согласно
этому правилу направление понижения
температуры на пограничных кривых
диаграммы (рис.29) будет определяться
следующим образом. На кривой Е1 –
Е температура понижается от точки Е1
к точке Е, так как точка Е1 – точка
пересечения соединительной линии АВ
(совпадающая в данном случае со стороной
проекционной диаграммы) и пограничной
кривой Е1 – Е, то есть точка Е1
является точкой температурного максимума
на кривой Е1 –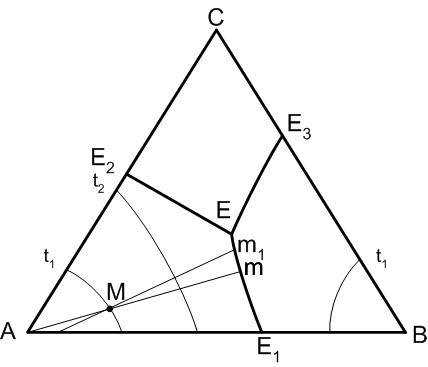 Е.
Е.
Рис.29. Диаграмма состояния трехкомпонентной системы с точкой тройной эвтектики
Правило 2:
Температура начала кристаллизации расплава или конца плавления твердой фазы соответствует температуре той изотермы диаграммы, на которую проецируется точка данного состава.
Например, температура начала кристаллизации компонента А исходного состава m (рис.29) соответствует температуре t1.
При рассмотрении пути кристаллизации любого состава необходимо знать состав кристаллических фаз кристаллизующихся в каждый момент времени.
Правило 3:
При кристаллизации расплава первично выпадающей фазой будет тa, в поле первичной кристаллизации которой находится точка исходного состава. Если точка исходного состава принадлежит пограничной кривой, то первичными фазами будут тe, поля первичной кристаллизации которых разделяет данная пограничная кривая.
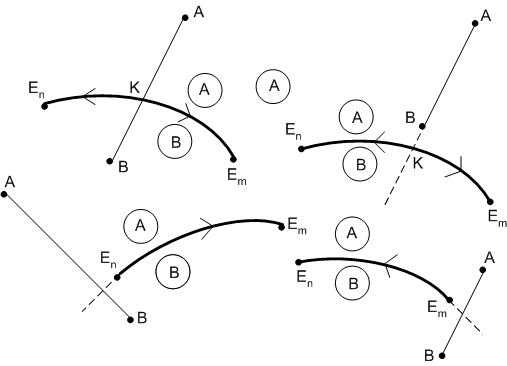
Рис.30. Направления понижения температуры на пограничных кривых
Прежде чем рассматривать пути кристаллизации составов системы, необходимо запомнить, что изменение состава расплава при кристаллизации происходит по линиям, проходящим через поля первичной кристаллизации или по пограничным кривым, а составы твердых фаз определяются на соединительных прямых.
Рассмотрим путь кристаллизации состава m (рис.29).
Выше температуры t1 в равновесии будет находиться расплав состава точки m. При понижении температуры в момент пересечения поверхности ликвидуса (температура t1) расплав становится пересыщенным по отношению к кристаллам компонента А. Начинается его кристаллизация (правило 3). При дальнейшем понижении температуры состав твердой фазы будет неизменен, состав же расплава будет изменяться по правилу 4.
Правило 4:
При кристаллизации из расплава одной твердой фазы состав жидкой фазы изменяется по продолжению прямой, проходящей в поле кристаллизации этой фазы и проведенной через точку состава первично выпадающей фазы и точку исходного состава в сторону понижения температуры.
После начала кристаллизации компонента А состав расплава будет изменяться по отрезку mM прямой АМ в сторону точки М. Как только состав расплава дойдет до пограничной кривой Е1 – Е расплав становится пересыщенным по отношению к двум твердым фазам: А и В.
Кристаллы этих фаз будут одновременно выпадать из расплава. В этот момент времени степень свободы системы будет равна единице. Независимым термодинамическим параметром будет температура, а состав расплава будет изменяться при дальнейшем понижении температуры строго по пограничной кривой, то есть от точки М по кривой Е1 – Е в сторону точки Е. При достижении температуры точки тройной эвтектики te начинается кристаллизация компонента С, так как в этом случае расплав становится пересыщенным по отношению сразу к трем компонентам. Нонвариантное состоянии, характерное для этого случая, заканчивается полной кристаллизацией расплава и дальнейшее возможное охлаждение системы приводит к охлаждению трех кристаллических фаз: А, В, С. Таким образом, путь кристаллизации исходного состава м: м→М→Е. Изменение фазового равновесия при нагревании будет обратным, нежели при охлаждении.
Правило рычага в трехкомпонентной системе
Для трехкомпонентной системы с помощью правила рычага можно решать следующие задачи:
определение количественного соотношения жидкой и твердой фаз при наличии одной твердой фазы;
определение количественного соотношения жидкой и твердой фаз при наличии двух кристаллических фаз с одновременным определением количественного соотношения кристаллических фаз в составе твердой фазы;
определение соотношения двух одновременно кристаллизующихся в данный момент времени фаз.
Рассмотрим работу правила рычага на примере диаграммы по рис.31.
Задача: определить фазовое равновесие исходного состава системы при температуре t2.
К этой температуре в результате кристаллизации в системе в равновесии будут находиться две фазы: кристаллы А и расплав состава Lк. Для определения состава расплава следует провести прямые через точку К, параллельные сторонам треугольника.
Количественное соотношение равновесных
фаз согласно правилу рычага будет
определяться следующим образом. За 100%
системы принимаем отрезок, ограниченный
точками составов равновесных фаз, то
есть точкой К (состав расплава) и точкой
А (состав кристаллов А). Отношение
расплав / кристаллы
будет обратно пропорциональным отрезкам
прямой от точки исходного состава М до
точек составов р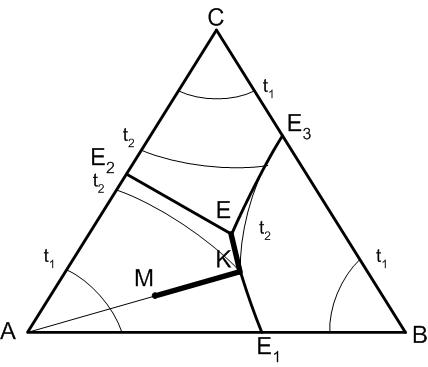 авновесных
фаз, то есть АМ : МК.
авновесных
фаз, то есть АМ : МК.
Рис.31. Правило рычага в трехкомпонентной системе
5.13. Диаграмма состояния трехкомпонентной системы с двойным химическим соединением, плавящимся конгруентно.
Признаком химического соединения, плавящегося конгруентно, является следующее:
Правило 5:
Химическое соединение плавится без разложения, если точка его состава принадлежит полю его первичной кристаллизации.
Соединительная прямая В – АС (компонент В и химическое соединение АС имеют сменные поля первичной кристаллизации) делит систему на два элементарных треугольника А – В – АС и В – АС – С, каждый из которых имеет точку тройной эвтектики. Для определения путей кристаллизации необходимо знать точку окончания кристаллизации исходных составов системы.
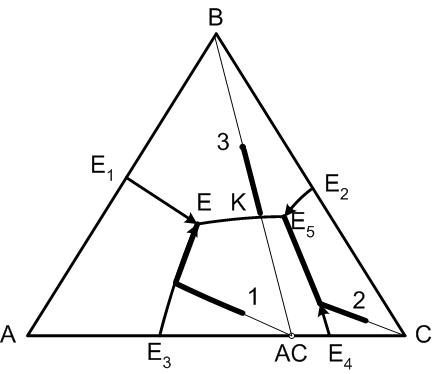
Рис.32. Диаграмма трехкомпонентной системы с двойным химическим соединением, плавящимся конгруентно
Правило 6:
Окончание кристаллизации произвольного состава системы произойдет в точке, где пересекаются поля первичной кристаллизации фаз, находящихся в вершинах элементарного треугольника, которому принадлежит точка исходного состава.
Из этого правила следует, что все составы, находящиеся в элементарном треугольнике А – В – АС закончат свою кристаллизацию в точке Е, а конечными продуктами кристаллизации будут соответственно кристаллы компонентов А и В и кристаллы химического соединения АС. Если исходный состав (точка 3 на диаграмме) расположен на соединительной прямой В – АС, то этот случай рассматривается как диаграмма двухкомпонентной системы В – АС, для которой точка К является точкой двойной эвтектики и именно там окончится кристаллизация указанного состава.
5.14. Диаграмма состояния трехкомпонентной системы с двойным химическим соединением, плавящимся инконгруентно
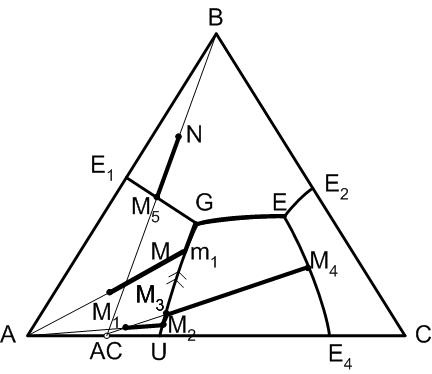
Рис.33. Диаграмма трехкомпонентной системы с двойным химическим соединением, плавящимся инконгруентно
Признаком химического соединения, плавящегося инконгруентно, является следующее.
Правило 7:
Двойное химическое соединение в трехкомпонентной системе плавится с разложением, если точка состава этого соединения не принадлежит полю его первичной кристаллизации, а последнее примыкает к стороне проекционной диаграммы, на которой находится состав химического соединения.
При плавлении с разложением химическое соединение будет выделять расплав, состав которого определяется проекцией точки перитектики двухкомпонентной системы на сторону проекционной диаграммы, то есть состава U и кристаллы (в нашем случае компонента А).
Инконгруентные кривые в отличие от конгруентных являются кривыми химических реакций взаимодействия ранее выпавших кристаллов с расплавом. Для определения характера пограничной кривой существует следующее правило.
Правило 8
Для определения характера пограничной кривой на каком-либо ее участке необходимо провести из точек, ограничивающих этот участок, касательные к пограничной кривой. Если проведенные касательные пересекут соединительную линию, соединяющую составы фаз, поля первичной кристаллизации которых разделяет рассматриваемая пограничная кривая, пограничная кривая на данном участке будет конгруентной, если не пересекут – инконгруентной.
На инконгруентных кривых понижение температуры обозначается двумя стрелками. Следует отметить, что одна и та же кривая на различных участках может носить разный характер. При понижении температуры по конгруентной кривой будет происходить химическая реакция образования химического соединения при взаимодействии ранее выпавших кристаллов с расплавом: кристаллы А + расплав = кристаллы АС.
Особенностью инконгруентной кривой является также то, что путь кристаллизации может сойти с пограничной кривой, когда в результате химической реакции пропадут ранее выделившиеся кристаллы.
Правило 9
Путь кристаллизации покидает инконгруентную кривую в точке ее пересечения с продолжением прямой, соединяющей точку исходного состава с точкой состава химического соединения. После этого путь кристаллизации пересекает поле первичной кристаллизации химического соединения по продолжению указанной выше кривой.
Точка G на диаграмме носит название точки двойного подъема. Это нонвариантная точка диаграммы, признаком которой является то, что по двум подходящим к ней пограничным кривым температура понижается к точке G и по одной пограничной кривой температура понижается от точки G. Дальнейший путь кристаллизации из точки двойного подъема возможет при уменьшении числа фаз.
Правило 10
В точке двойного подъема в результате химической реакции исчезает та ранее выделившаяся фаза, от поля первичной кристаллизации которой отходит единственная пограничная кривая с понижающейся от точки двойного подъема температурой.
Рассмотрим пути кристаллизации некоторых составов системы по рис.33.
Точка М. Первично выпадающими кристаллами будут кристаллы компонента А (правило 3), конечной точкой кристаллизации – точка G, продукты кристаллизации – А, В, АС (правило 6). От точки М при понижении температуры состав расплава будет изменяться по линии М-m1 к точке m1 (правило 4). В точке m1, которая принадлежит инконгруентной кривой UG, начинается химическая реакция взаимодействия кристаллов компонента А с расплавом состава Lm1 с образованием химического соединения АС. При этом путь кристаллизации пойдет по кривой UG к точке G, где дополнительно начнется кристаллизация компонента В и закончится полностью кристаллизация системы, то есть путь кристаллизации исходного состава М: М→m1→G.
Точка М1. Первичной кристаллической фазой будет компонент А. Точка окончания кристаллизации – Е. При понижении температуры состав расплава будет меняться по прямой А – М1 к точке М2, где начнется химическая реакция, а состав расплава будет меняться по инконгруентной кривой. В точке М3 в результате химической реакции исчезнет компонент А, а путь кристаллизации покинет инконгруентную кривую (правило 9) и пойдет далее через поле первичной кристаллизации химического соединения к точке М4. В этой точке начнется кристаллизация компонента В, а состав расплава будет изменяться к точке Е по пограничной кривой G – E. В точке тройной эвтектики начнется кристаллизация компонента С и там же полностью закончится кристаллизация исходного состава системы. Таким образом, путь кристаллизации состава М1: М1 – М2 – М3 – М4 – Е.
Точка N. Путь кристаллизации: N – M5.
5.15. Диаграмма состояния трехкомпонентной системы с двойным химическим соединение, разлагающимся при нагревании в твердом состоянии
Существует следующий признак соединения, разлагающегося при нагревании в твердом состоянии.
Правило 11
Двойное соединение в трехкомпонентной системе разлагается при нагревании в твердом состоянии, если точка состава этого соединения лежит вне поля его первичной кристаллизации, а последнее расположено внутри треугольника концентраций и не примыкает к стороне диаграммы, на которой лежит состав данного двойного соединения.
На диаграмме данной системы появляется еще один элемент: тройная точка двойного опускания G1. Характерным для этой точки является то, что по одной пограничной кривой Е3–G1 температура понижается к данной точке, а по двум другим – G1–G и G1–E температура понижается в направлении от точки двойного опускания.
В точке двойного опускания протекает химическая реакция расплава состава G1 с ранее выпавшими кристаллами компонентов А и С с образованием химического соединения АС. Характер процесса, происходящего в точке двойного опускания, определяется следующим правилом.
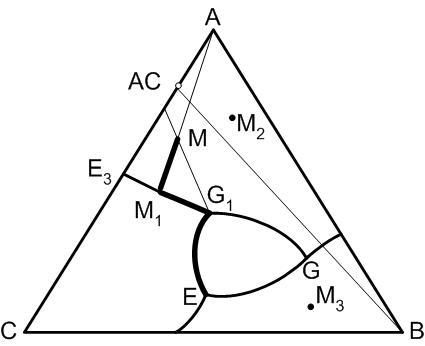
Рис.34. Диаграмма состояния трехкомпонентной системы с двойным химическим соединением, разлагающимся в твердом состоянии
Правило 12
В точке двойного опускания в результате химической реакции выкристаллизовывается химическое соединение, поле кристаллизации которого G1–G–E граничит как с одной (G1–G), так и с другой (G1–E) пограничными кривыми с падающими от этой точки температурами. Две другие равновесные в этой точке твердые фазы частично или полностью исчезают.
Кристаллизация исходного состава системы может как закончиться в точке двойного опускания, так и продолжиться дальше. В том виде, как это изображено на рис.34, кристаллизация никогда не закончится в точке двойного опускания, так как не существует элементарного треугольника в вершинах которого находятся фазы А, С, АС (правило 6).
Дальнейший путь кристаллизации из точки двойного опускания зависит от результата химической реакции и определяется правилом 13.
Правило 13
Для выбора пути дальнейшей кристаллизации из точки двойного опускания ее соединяют с точкой исходного состава прямой. Кристаллизация пойдет по той пограничной кривой, вдоль которой в равновесии находятся фазы, соединительную линию которых пересечет продолжение этой прямой.
Рассмотрим кристаллизацию некоторых составов системы.
Точка М. Первичными кристаллами при начале кристаллизации системы будут кристаллы компонента А, точка окончания кристаллизации – точка Е, конечные кристаллические фазы: В, С, АС.
При понижении температуры от точки М состав расплава будет меняться по линии А – М1 к точке М1, в которой начнется кристаллизация компонента С. При одновременной кристаллизации А и С состав расплава меняется по пограничной кривой Е3 – G1 от точки М1 до точки G1. В точке двойного опускания начинается реакция химического взаимодействия, в результате которой исчезают кристаллы компонента А (правило 13), а дальнейший путь кристаллизации пойдет по пограничной кривой G1 – Е к точке Е. При этом из расплава будут одновременно кристаллизоваться С и АС. В точке тройной эвтектики дополнительно начнется кристаллизация компонента В и закончится кристаллизация расплава. Путь кристаллизации исходного состава М: М – М1 – G1 – Е.
Предлагаю читателям самостоятельно рассмотреть пути кристаллизации исходных составов системы М2 и М3.
5.16. Диаграммы равновесия трехкомпонентных систем с тройными химическими соединениями
На рис.35 представлен общий вид диаграммы трехкомпонентной системы с тройным химическим соединением, плавящимся конгруентно. Точка состава химического соединения АВС находится в поле его первичной кристаллизации. Соединительные линии разбивают треугольник концентраций на три элементарных треугольника: А – В – АВС, В – С – АСВ, С – А – АВС, в каждом из которых имеется точка тройной эвтектики, соответственно Е4, Е5, Е6. Составы системы, лежащие внутри элементарных треугольников, закончат свою кристаллизацию согласно правилу 6 в точках тройной эвтектики. Составы, лежащие на соединительных прямых, закончат свою кристаллизацию в точках температурных максимумов с выделением фаз, точки составов которых соединяет соединительная прямая.
На диаграмме состояния системы с тройным химическим соединением, плавящимся инконгруентно (рис.35 б) нет новых элементов: точек тройной эвтектики Е4 и Е5, точки двойного подъема G, пограничная линия Е4 – G является инконгруентной. На ней имеется точка температурного максимума К, от которой температура понижается к точкам Е4 и G. При рассмотрении путей кристаллизации данной системы работают те же правила, что и для двухкомпонентных химических соединений, поэтому предлагаю читателям самостоятельно проанализировать пути кристаллизации исходных составов системы, графически представленные на рис.35 б.
Р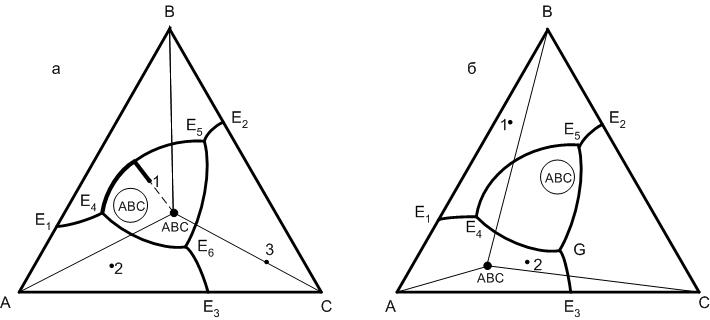 ис.35.
Диаграммы состояния трехкомпонентной
системы с тройными химическими
соединениями, плавящимися: а – конгруентно,
б – инконгруентно
ис.35.
Диаграммы состояния трехкомпонентной
системы с тройными химическими
соединениями, плавящимися: а – конгруентно,
б – инконгруентно
5.17. Система СаО – Al2O3 – SiO2
Указанная система играет важную роль в теории и технологии производства портландцемента, глиноземистого цемента, огнеупоров, стекла, тонкой и строительной керамики и других строительных материалов (рис.37).
В системе имеется 10 бинарных химических соединений, рассмотренных нами ранее и два тройных соединения: алюмосиликаты кальция – природные минералы анортит и геленит.
Анортит или известковый полевой шпат Ca[Al2Si2O8] плавится без разложения при температуре 1550оС. Анортит широко распространен в природе преимущественно в виде непрерывного ряда твердых растворов с альбитом Na2O*Al2O3*6SiO2. Эти твердые растворы получили название плагиоклазов и являются основными породообразующими минералами магматических горных пород. Кристаллическая решетка анортита относится к каркасным структурам из тетраэдров [SiO4] или [AlO4] с катионами кальция в промежутках.
Геленит 2CaO*Ai2O3*SiO2 плавится без разложения при температуре 1590оС. Встречается в природе, в частности, образует с окерманитом 2CaO*MgO*2SiO2 непрерывный ряд твердых растворов, называемых мелилитами. Гелинит и мелилит образуются в доменных, титанистых и высокоглизноземистых шлаках, являются балластной составной частью глиноземистых цементов, так как не обладают гидравлической активностью.
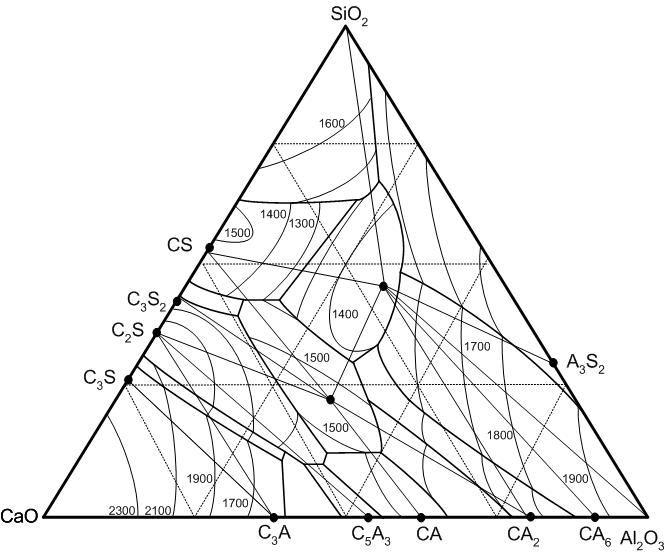
Рис.36. Диаграмма СаО – SiO2 – Al2O3
Области полей кристаллизации алита, белита и трехкальциевого алюмината имеют практическое значение при решении некоторых вопросов определения состава шихты для изготовления клинкера нормированного минералогического состава, например, белого и сульфатостойкого цементов. Рассмотрим практически пути кристаллизации некоторых составов (рис.38).
Состав А.
Конечной точкой кристаллизации будет точка 2, продуктами кристаллизации –CaO, трехкальциевый силикат и трехкальциевый алюминат. После выпадения первичных кристаллов СаО состав расплава будет изменяться по прямой АМ к точке М. Так как кривая 1-2 имеет инконгруентный характер, в точке М начинается химическое взаимодействие СаО с расплавом с образованием трехкальциевого силиката. Состав расплава при этом будет изменяться по кривой 1-2 к точке 2, в которой начинается образование трехкальциевого алюмината также за счет протекания химической реакции. Так как в составе продуктов реакции присутствует свободная СаО, содержание которой в клинкере портландцемента ограничивается, то выбирать состав шихты для производства цемента в рассматриваемом элементарном треугольнике нецелесообразно.
Рис.37. Области составов силикатных материалов:
1 – динасовые огнеупоры, 2 – стекла, 3 – кислые шлаки, 4 – основные шлаки,
5 – портландцемент, 6 – глиноземистый цемент, 7 – корундовые огнеупоры,
8 – муллитовые огнеупоры, 9 – шамотные огнеупоры, 10 – фарфор.
Состав Б.
Точкой окончания кристаллизации будет точка 3, конечными продуктами – трехкальциевый силикат, двухкальциевый силикат и трехкальциевый алюминат. Путь кристаллизации состава Б: Б– М1–3. Для определения количества продуктов кристаллизации любой точки системы, например точки Б, необходимо определить состав точки в элементарном треугольнике, внутри которого она находится. Так, в нашем случае, приняв отрезок C2S–C3S за 100% (аналогично можно принять за 100% и две других стороны треугольника), определяем состав точки Б на этом отрезке: C2S = 60%, C3S = 25%, C3A = 15%.
Практически портландцементный клинкер при невысокой температуре обжига содержит не более 35% жидкой фазы, а так как шихта для производства клинкера содержит и оксиды железа, то минералогический состав клинкера будет отличаться, от установленного по диаграмме (рис.36). Тем не менее, по равновесной диаграмме состояния можно определить направление сложных процессов и провести технологические расчеты клинкера.
Рис.38. Пути кристаллизации составов в системе СаО – SiO2 – Al2O3
Контрольные вопросы
Что представляет собой диаграмма состояния трехкомпонентной системы?
Дайте характеристику основным элементам диаграммы трехкомпонентной системы: поверхность ликвидуса, пограничная и соединительные кривые, точки двойного подъема и опускания и т.п.?
Как определяется состав точки системы, находящейся внутри проекционного треугольника?
На рис.35 б нанесите понижение температур для всех пограничных кривых?
Что можно определить в трехкомпонентной системе по правилу рычага?
Что является отличительной особенностью диаграмм с химическими соединениями, плавящимися инконгруентно?
Как определяется точка окончания кристаллизации составов трехкомпонентной системы?
В чем заключается практическая значимость диаграммы CaO–SiO2–Al2O3?
Рассмотрите путь кристаллизации 10 на рис.38.
Укажите участки на диаграмме CaO–SiO2–Al2O3, состав шихты которых пригоден для изготовления белого цемента, сульфатостойкого портландцемента.
Основная литература [1, 13], дополнительная литература [2, 10].
6. ГИДРАТАЦИЯ МИНЕРАЛОВ ЦЕМЕНТНОГО КЛИНКЕРА
6.1. Механизм взаимодействия минералов клинкера с водой
Поверхностные слои кристаллов минералов клинкера содержат различные типы дефектов (точечные, линейные, поверхностные, объемные), которые обуславливают переменную химическую активность поверхностных зон кристаллов.
При соприкосновении с водой на поверхности кристаллов и вблизи ее протекают следующие процессы:
а) адсорбция полярных молекул воды на поверхности кристалла за счет нескомпенсированной поверхностной энергии твердой фазы. При этом возможно электролитическое разложение части молекул воды Н2О → Н+ + ОН-;
б) взаимодействие ионов Н+ и ОН- с активными центрами поверхности кристалла с образование хемосорбционных связей;
в) развитие ионного обмена типа Са2+ ↔ 2Н-, приводящего к переходу части структурных единиц кристаллов в раствор (СаО, Al2O3, SiO2, Fe2+) и присоединению к поверхности кристаллов клинкера водорода, гидроксил-ионов и диполей воды с образованием первичных зародышей гидратированных соединений: Ca(OH)2, CSHx, CnAHy;
г) интенсивный переход в раствор наряду с обмениваемыми ионами также Ca(OH)+, ионами орто- и метакремниевых кислот, приводящий к насыщению и перенасыщению жидкой фазы;
д) кристаллизация пересыщенных водных растворов.
Перечисленные выше процессы протекают параллельно и носят циклический характер; результатом их является формирование пространственного каркаса из гидратных фаз, приводящего к необратимой потере цементным тестом пластичности и последующим упрочнением цементного камня.
При взаимодействии минералов цементного клинкера с водой широко наблюдаются коллоидные явления. Изменение состава ионов в воде затворения в результате обменных реакций сопровождается изменением состава поверхностных гидроксилсодержащих элементов структуры – частиц гидрозоля гидросиликатов кальция. В зависимости от состава раствора поверхность частиц покрывается структурными элементами типа СаОН+ или SiOH3+, диссоциация которых придает частицам гидрозоля заряд поверхностного слоя; образуется так называемый двойной электрический слой.
Образование заряда на поверхности, его знак, последующая возможная перезарядка поверхности определяют характер протекания начальной и последующих стадий гидратации минералов клинкера.
6.2. Гидратация силикатных минералов цементного клинкера
Силикатные минералы – твердые растворы трехкальциевого силиката и двухкальциевого силиката, составляют основную массу цементного клинкера. Это определяет их основную роль в протекании процесса формирования структуры камня на основе портландцемента.
Состав продуктов гидратации минерала зависит от ряда факторов: вида и количества используемых добавок или наличия иной минеральной фазы, водовяжущего отношения, температуры твердения, его продолжительности и др.
При различных условиях твердения в системах С3S – H2O и β – С2S – H2О образуются гидросиликаты кальция переменного состава типа CxSHy и гидроксид кальция.
В начальной стадии взаимодействия
силикатных минералов с водой в системе
С3S–H2O
образуется первичный богатый известью
гидросиликат кальция C3SHx.
Образование этого соединения является
одной из причин возникновения пленки
начальной стадии взаимодействия
силикатных минералов с водой в системе
С3S–H2O
образуется первичный богатый известью
гидросиликат кальция C3SHx.
Образование этого соединения является
одной из причин возникновения пленки
Рис.39. Взаимодействие минералов клинкера с водой:
а – скорость тепловыделения цемента, б – влияние температуры твердения на скорость гидратации через 12 часов после затворения, в – влияние длительности твердения на степень гидратации трехкальциевого силиката
гидратных фаз на поверхности минералов и торможения процесса гидратации (так называемый индукционный период гидратации, рис.39а).
По истечении 2 … 6 часов высокоосновноый гидросиликат кальция (основностью гидросиликатов кальция называется отношение СаО/SiO) разлагается на соединение меньшей основности: С3SHx → C0, 8 … 1, 5SH + Ca(OH)2 + Q.
Разложение обусловлено снижением стабильности соединений при снижении концентрации СаО в жидкой фазе твердеющей системы при кристаллизации гидроксида кальция (табл.9).
Таблица 9 – устойчивость гидросиликатов кальция
Состав гидросиликатов кальция |
Концентрация СаО, г/л |
С0, 8 … 1,5 SH |
0,05 … 1,10 |
C1, 5 … 2,0 SH |
1,10 … 1,23 |
Гидросиликат кальция С0,8 … 1,5SH получил название вторичного гидросиликата кальция, возможное взаимодействие которого с СаО приводит к образованию третичного гидросиликата кальция с основностью 1,5 … 2,0. Последний кристаллизуется в поровом пространстве цементного камня в виде кристаллов волокнистого строения.
При автоклавной обработке силикатных минералов (температура 150 … 170оС, давление до 1,0 МПа) гидратация С3S приводит к образованию стабильных высокоосновных гидросиликатов кальция, состав которых меняется от С1,6 … 2,4SH до C3SH с преимущественным содержанием раpличных фаз в зависимости от параметров процесса гидратации.
Полнота протекания гидратации силикатных минералов зависит от температуры реакции (рис.39б), длительности взаимодействия (рис.39в), наличия в воде затворения посторонних ионов.
Так, Са(ОН)2, трехкальциевый алюминат замедляют гидратацию алита; хлориды кальция и натрия, бромиды и карбонаты щелочных металлов ускоряют этот процесс.
Реакции гидратации β-C2S и его твердых растворов (белита) протекают по следующей схеме
β-C2S + Н2О → С1,3SH + Ca(OH)2 + Q.
При этом на состав гидросиликатов кальция оказывают влияние условия и длительность твердения (табл.10).
Продукты гидратации силикатов кальция портландцементного клинкера – соли ортокремниевой кислоты со сложными кремнекислородными мотивами: Ca(H3SiO4), CaH2SiO4 и др.
Таблица 10 – влияние условий твердения на состав гидросиликатов кальция
Условия твердения |
Состав гидросиликатов кальция |
|
первичный |
вторичный |
|
Избыток воды затворения |
CSHx |
С1,65SHx |
Тесто нормальной густоты |
C1,15 … 1,2SHx |
C1,65 … 1,7SHx через 1,5 часа |
Р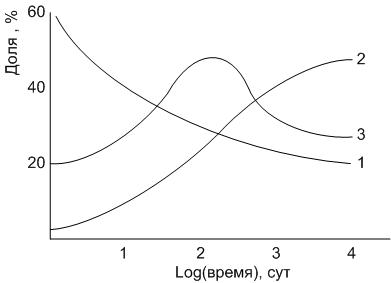 аботами
Белова Н.В. и Мамедова Х.С. установлено,
что в основе структуры гидросиликатов
кальция лежат не кремнекислородные
тетраэдры, а более сложные комплексы
мотивов типа [Si6O17],
[Si12O31],
[Si6O15]
и полисиликты с различной степенью
конденсации кремнезема. Экспериментальные
исследования последних лет
аботами
Белова Н.В. и Мамедова Х.С. установлено,
что в основе структуры гидросиликатов
кальция лежат не кремнекислородные
тетраэдры, а более сложные комплексы
мотивов типа [Si6O17],
[Si12O31],
[Si6O15]
и полисиликты с различной степенью
конденсации кремнезема. Экспериментальные
исследования последних лет
Рис.40. Изменение основных структурных характеристик цементного камня в процессе твердения: 1 – [SiO4]; 2 – [Si2O7]; 3 – полисиликаты
показали, что при гидратации цемента происходит пjлимеризация силикатов. В различные сроки твердения в составе цементного камня присутствуют моно-, ди- и полисиликаты с увеличением доли последних в поздние сроки (рис.40). Выявлена зависимость между упругими характеристиками цементного камня и степенью его поликонденсации.
Состав основных гидросиликатов кальция представлен в табл.11.
Таблица 11 – состав
Название ГСК |
Формулы |
|
кристаллическая |
стехиометрическая |
|
Гиллебрандит |
Ca2[Si6O17]*(OH)4*12Ca(OH)2 |
C2SH1,17 |
Фогашит |
Ca8[Si6O17]*(OH)6 |
C5S3H1,5 |
Ксонотлит |
Ca6[Si6O17]*(OH)2 |
C6S6H |
Тоберморит |
Ca10[Si12O31]*(OH)6*8H2O |
C5S6H5,5 |
Трускотит |
Ca3[Si6O15]*6H2O |
CS2H0,7 |
Для цементного камня характерен эффект старения, заключающийся в изменении его свойств с течением времени. Этот эффект обусловлен изменениями, происходящими в составе гидратных фаз цементного камня, которые касаются, в первую очередь, дисперсности новообразований, а также степени полимеризации кремнекислородных тетраэдров.
Фазовый состав и микроструктура цементного камня находятся в состоянии перекристаллизации с образованием различных изоморфно-замещенных гидратных соединений, направленной на установление химического и термодинамического равновесия в нем. В конечном итоге перекристаллизация приводит к увеличению размеров кристаллов, к переходу гидросиликатов кальция состава CSH(I) в устойчивую форму C2SHx. Однако этот процесс протекает очень медленно под влиянием большого числа факторов.
7. СИЛИКАТООБРАЗОВАНИЕ ПРИ КОРРОЗИИ БЕТОНА
7.1. Кремнезем в горных породах
Силикаты и алюмосиликаты широко присутствуют в горных породах как магматического, так осадочного и метаморфического происхождения различаясь между собой по структуре и плотности. Наиболее твердым основным породообразующим минералом является кристаллический кварц, имеющий решетку каркасного типа и обладающий малой реакционной способностью. Кварц не стоек к действию щелочей, если его решетка деформирована и имеет высокую степень неупорядоченности структуры.
Большинство изменений, происходящих с кремнеземом, происходит при его взаимодействии с водой, приводящему к образованию коллоидных растворов или гидратированных масс. При образовании аморфного состояния кремнезем вначале выделяется в виде мягкой гелеобразной массы, которая впоследствии отвердевает.
К коллоидным формам кремнезема относятся опалы, халцедоны, опоки, трепелы и другие породы. Все они имеют различную реакционную способность взаимодействия со щелочами. Если реакционную способность опала принять за единицу, то реакционная способность других аморфных форм кремнезема будет следующей: халцедон 0,96, липарит 0,86, тридимит 0,68, вулканическое стекло 0,20, гранит 0,03, кристаллический кварц 0,02
О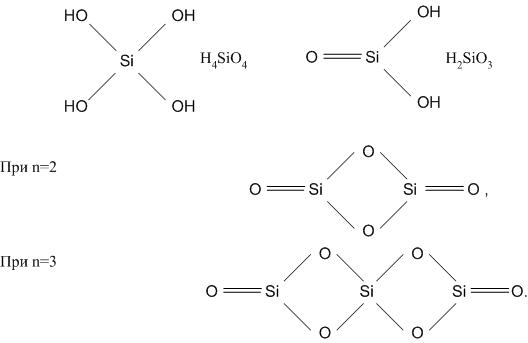 палы
представляют собой типичные гидрогели.
Рассматривая кремнезем как полимер,
обозначаемый символом [SiO2]n,
академик Вернадский В.И. предложил
следующие структурные формулы для
природных гидратов. При n
= 1 отмечается присутствие орто- и
метакремниевых кислот
палы
представляют собой типичные гидрогели.
Рассматривая кремнезем как полимер,
обозначаемый символом [SiO2]n,
академик Вернадский В.И. предложил
следующие структурные формулы для
природных гидратов. При n
= 1 отмечается присутствие орто- и
метакремниевых кислот
Производными этих полимеров будут полимерные кремниевые кислоты, в структурных формулах которых атом кислорода замещается гидроксильной группой. Процесс полимеризации, протекающий при снижении щелочности раствора, можно выразить следующим образом
О бразование
геля кремнезема протекает в две стадии.
Первоначально процесс полимеризации
приводит к образованию частиц коллоидных
размеров (до 5 нм). При их концентрации
свыше 1% частицы способны конденсироваться
с образованием непрерывной жесткой
структурной сетки (рис.41).
бразование
геля кремнезема протекает в две стадии.
Первоначально процесс полимеризации
приводит к образованию частиц коллоидных
размеров (до 5 нм). При их концентрации
свыше 1% частицы способны конденсироваться
с образованием непрерывной жесткой
структурной сетки (рис.41).
Рис.41. Процесс гелеобразования кремниевых кислот
Образование опаловидных структур проходит ряд состояний.
Возникновение и развитие пространственных структур приводит к полному отвердеванию системы и дальнейшему повышению ее прочности. В зависимости от природы действующих сил сцепления формируются сначала коагуляционные структуры, в которых за счет удаления влаги наступает механический контакт между частицами, и кристаллизационный, в которых связь между частицами имеет ионно-ковалентный характер.
Коагуляционные структуры имеют невысокую прочность, склонны к тиксотропии и пластичности. Прочность конденсационно-кристаллизационных структур увеличивается, разрушение носит упруго-хрупкий характер.
Таким образом, аморфный кремнезем характеризуется наличием двух поликремниевых кислот. Содержание воды, например в опалах, меняется от 23% в производных метакремниевых кислот до 37% в гидрате SiO2*2H2O. По мере высыхания опалов они переходят в халцедон (содержание воды 0,4 … 21%), а затем в кварц. Общая формула состава опалов SinO2(n-1)(OH)2*mH2O*pAq.
При замещении атомов водорода в первой части формулы на катионы кальция, магния, железа, натрия, калия образуются кислые соли с большим содержанием кремнезема. Связанная здесь вода носит конституционный характер; вода левой части формулы – цеолитная и гигроскопическая.
Высокая реакционная способность опаловидных структур объясняется высокой удельной поверхностью частиц аморфного кремнезема.
7.2. Взаимодействие кремнезема с водой и щелочными растворами
Кристаллический кварц малорастворим в воде (рис.42).
Хлориды и карбонаты натрия увеличивают растворимость аморфного кремнезема, кислые соли – снижают. Добавка порошкообразного алюминия снижает растворимость кремнезема до 0,0001% из-за образования монослоя оксида алюминия на поверхности частиц кремнезема.
При взаимодействии с водой на поверхности частицы кремнезема происходит гидратация с образованием силоксановых связей: образующаяся пленка прочно удерживаемой влаги увеличивает примерно на 6% общий объем гидратированной частицы.
Взаимодействие с водой приводит к деполимеризации гелей SiO2 с образованием кремниевых кислот. Количественно деполимеризация становится заметной при значении рН среды более 7 (рис.43). Повышение растворимости при рН=10,26 связано с образованием силикатов. Чистые золи кремнезема устойчивы при рН более 7; в кислой среде при рН менее 4,5 происходит агрегация частиц с повышением вязкости системы.
В щелочных растворах натрия и калия кремнезем образует силикаты; при этом деполимеризация идет полнее. Наибольшее количество оксидов щелочных металлов МеО содержится в ортосиликатах, в в которых отношение кремнезема к оксиду металла М=1,0 являются наиболее стойкими солями кремниевой кислоты, при их растворении образуются силикатные растворы.
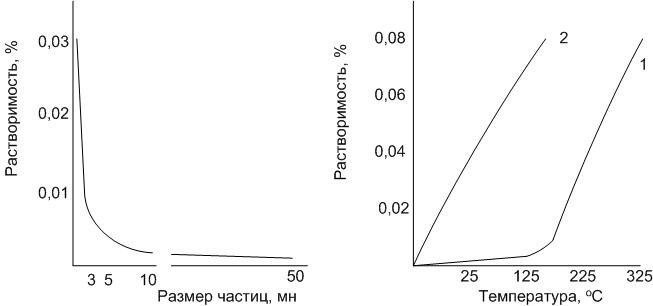
Рис.42 Растворимость кремнезема в зависимости от размера частиц (а) и температуры (б):
1 – кристаллический кварц, 2 – аморфный кремнезем
Структура молекул полисиликатов и их агрегатов с увеличением значения М усложняется, увеличивается вязкость коллоидных растворов вплоть до образования твердого геля. Устойчивость различных форм силикатов показана на схеме ниже.
Рис.43. Растворимость кремнезема в щелочных растворах
7.3. Щелочные реакции в бетоне
Различают три типа взаимодействия щелочей цемента с реакционноспособным заполнителем в бетоне.
Щелочекремнеземистые реакции протекают между щелочами и реакционноспособным кремнеземом в заполнителе. Сопровождающие коррозионный процесс деформации расширения не находятся в прямой зависимости от концентрации щелочи. Считается, что при концентрации щелочей в пересчете на оксид натрия менее 0,6% от массы цемента не возникает опасных для бетона расширений. При увеличении содержания щелочей свыше этого значения деформации расширения растут, а затем могут стабилизироваться или даже уменьшаться.
Известны две наиболее принятые в ученом мире теоретические концепции природы разрушения бетона при щелочной коррозии бетона.
Гипотеза набухания гелей считает причиной разрушения бетона адсорбцию воды гелями, образующимися в результате взаимодействия кремнезема заполнителя со щелочью. Состав гелей изменяется от кальциево-щелочных, не склонных к расширению, до щелочекремнеземистых, подвергающихся значительным деформациям.
По гипотезе осмотического давления цементные пасты, содержащие частицы реакционноспособного заполнителя, проявляют свойства полунепроницаемых мембран, позволяющих диффундировать сквозь них щелочи и воде, но препятствующих выходу наружу силикатных ионов. Разница концентраций внутри и вне ячейки (зерна цементного клинкера, покрытого гидратированной оболочкой новообразований) создает давление, вызывающее расширение бетона.
Щелочекарбонатная реакция протекает при взаимодействии доломитизированного известняка, содержащего более 50% доломита, со щелочами
Ca,Mg((CO)3)2 + 2MeOH → Mg(OH)2 + CaCO3 + Me2CO3,
где Ме – ионы натрия, калия или лития.
Продукт этой реакции взаимодействует с гидроксидом кальция, регенерируя щелочь
Me2CO3 + Ca(OH)2 → 2MeOH + CaCO3.
Протекания реакций подобного типа в бетоне вызывает его расширение как за счет увеличения объема продуктов реакции, так и по ряду других причин, в настоящее время еще не достаточно изученных.
Щелочесиликатная реакция вызывается взаимодействием щелочей цемента с горными породами типа аргиллитов и филлитов, содержащих вермикулит. Подобный тип реакций на сегодня наименее изучен.
Таким образом, протекание реакций щелочей цемента и реакционноспособного заполнителя вызывает опасные деформации расширения бетона, приводящие зачастую к растрескиванию бетонных и железобетонных конструкций.
Количественная характеристика участия кремнезема в реакциях со щелочами и основное условие расширения бетона сформулированы В.М.Москвиным.
Твердые частицы кремнезема соприкасаются со щелочами по суммарной поверхности частиц S.
Реакционная емкость кремнезема при этом определяется как
Q = S*H*P*F,
где Н – глубина перерождения зерна кремнезема, мм;
Р – плотность кремнезема, 2,2 г/см3;
F – реакционная способность кремнезема.
При действии раствора щелочи происходит постепенная послойная гидратация, а затем и полимеризация кремнезема. В раствор переходит кремнезем, образуя молекулярные и в большей степени коллоидные растворы. Согласно экспериментальным данным значительные деформации расширения наблюдаются при среднем диаметре частиц кремнезема 0,2 … 2,0 мм, то есть песчаной фракции заполнителя бетона.
Масса деполимеризованного слоя кремнезема
MSiO2 = (13,2*Vp*Sa*F) / 100*Dcp,
где Vp – объем песка в составе бетонной смеси, л;
Sa – содержание реакционноспособного кремнезема в песке, %;
Dcp – средний размер частиц кремнезема в песке, мм.
Массовая доля щелочей в цементе
MMe2O = (Vz*Pz*A) / 100,
где Vz – объем цемента в составе бетонной смеси, л;
Pz – плотность цемента, г/см3;
А – содержание щелочей в цемент, %.
Основное условие расширения бетона будет определяться коэффициентом:
K = MSiO2 / MMe2O = (13,2*Vp*Sa*F) / (Dcp*Vz*Pz*A).
Минимальное значение К=1 характерно для тех условий, при которых образуются истинные растворы орто- и метасиликатов натрия. Максимальное значение К характерно для образования вязких коллоидных растворов. Определено количество реакционноспособного кремнезема и щелочей, не опасных для бетона. Анализ показывает, что имеются два пути снижения размера или полного исключения возникновения очагов образования расширяющихся комплексов:
введение тонкомолотой реакционноспособной добавки с целью увеличения значения коэффициента К более 4, когда продукты реакции не представляют опасности для бетона;
введение в бетон дополнительного количества щелочи с целью снижения значения К менее 1.
Первый путь реализуется на практике введением в бетонную смесь тонкомолотых добавок зол, микрокремнезема, шлаков, приводящих к повышению устойчивости бетона против щелочной коррозии.
Контрольные вопросы
В чем различие между кристаллическими и коллоидными формами кремнезема?
Что является главной частью опаловидных структур?
Почему растворимость кремнезема увеличивается при повышении щелочности растворителя?
Как меняется структура силикатов при изменении рН среды?
В чем причина щелочной коррозии бетона?
Каковы пути ликвидации коррозии при щелочекремнеземистых реакциях в бетоне?
С какой целью в состав бетонной смеси вводятся тонкомолотые кремнеземистые добавки при наличии опасности щелочной коррозии?
Основная литература [9], дополнительная литература [10].
ЛИТЕРАТУРА
Физическая химия силикатов: Учебник для студентов вузов / А.А.Пащенко, А.А.Мясникова, Е.А.Мясникова и др.; Под ред.А.А.Пащенко. – М.: Высшая школа, 1986. – 3 86с.
Куколев Г.В. Химия кремния и физическая химия силикатов. – М.: Высшая школа, 1966. – 455с.
Горшков В.В., Тимашев В.В., Савельев В.Г. Методы физико-химического анализа вяжущих веществ. – М.: Высшая школа, 1981. – 332с.
Круглицкий Н.Н., Мороз Б.И. Искусственные силикаты. Киев: Наукова думка, 1986. – 240с.
Айлер Р. Химия кремнезема / Пер. с анг. – М.: Мир, 1982 – Ч1. – 416с.
Айлер Р. Химия кремнезема / Пер. с анг. – М.: Мир, 1982 – Ч2. – 712с.
Бабушкин В.И., Матвеев М.Г., Мчедлов-Петросян О.П. Термодинамика силикатов. – М.: 1986. – 407с.
Сборник вопросов и задач по физической химии для самостоятельного контроля: Учебное пособие для вузов / А.Г.Атанасянц, С.Ф.Белевский, Г.С.Каретников и др.; Под ред. С.Ф.Белевского. – М.: Высшая школа, 1979. – 119с.
Рамачандран В., Фельдман Р., Бодуэн Д. Наука о бетоне. Физико-химическое бетоноведение / Пер. с анг. Т.И.Розенберг, Ю.Б.Ратиновой; Под ред. В.Б.Ратинова. – М.: Стройиздат, 1986. – 278с.
Кузнецова Т.В. Алюминатные и сульфоалюминатные цементы. – М.: Стройиздат, 1986. – 208с.
Химическая технология стекла и ситаллов: Учебник для вузов / М.В.Артамонова, М.С.Асланова, И.М.Вуглинский и др.; Под ред. Н.М.Павлушкина. – М.: Стройиздат, 1983. – 432с.
Глинка И.М. Общая химия. – М.: Высшая школа, 1978. – 720 с.
Горшков В.С., Савельев В.Г., Федоров Н.В. Физическая химия силикатов и других тугоплавких соединений. – М.: Высшая школа, 1988. – 400с.
Шульц М.М., Мазузин О.В. Современные представления о строении стекол и их свойствах. – Л.: Наука, 1988. – 88с.
Семириков С.И.Физическая химия строительных материалов. Из-во УПИ, 2002. – 245
