
- •1. Равновесие в гетерогенных системах. Основные понятия.
- •2. Правило фаз Гиббса.
- •3. Однокомпонентные системы. Диаграмма состояния однокомпонентной системы.
- •4) Уравнение Клайперона-Клаузиуса
- •5) Диаграмма состояния двухкомпонентных систем с простой эвтектикой.
- •6. Диаграмма плавящаяся конгруэнтно.
- •7. Диаграмма плавящаяся инконгруэнтно.
- •8. Диаграмма с ограниченной растворимостью в твердом состоянии.
- •9. Диаграмма с неограниченной растворимостью в твердом и жидком состоянии.
- •10. Диаграмма с ограниченной растворимостью в жидком состоянии.
- •11.Растворы. Общие понятия. Основные задачи, решаемые термодинамикой растворов.
- •12.Парциальные молярные величины. Уравнение Гиббса-Дюгема.
- •13. Идеальные растворы и их характеристика.
- •14. Давление насыщенного пара компонента над раствором. Закон Рауля.
- •15. Растворимость газа в жидкостях. Закон Генри.
- •16. Предельно разбавленные растворы.
- •17. Отклонение от закона Рауля.
- •18. Дисперсионные системы. Основные понятия и классификация.
- •Свободная поверхностная энергия и поверхностное натяжение.
- •20. Методы определения поверхностного напряжения.
- •Смачивание. Работа когезии и отгезии.
- •22. Пав. Адсорбция на границе раздела жидкость - газ.
- •24.Адсорбция на твердых адсорбентах. (Уравнение Френдлиха – нет.)
13. Идеальные растворы и их характеристика.
Идеальные растворы – это растворы образование которых из компонентов не сопровождается изменением теплового эффекта и изменением объема. ΔH=0 ΔV=0
А изменение энтропии равно изменению энтропии при отношении идеальных газов. ΔS=ΔсмешS. Идеальные растворы рассматриваются как идеальные газы. Рассмотрим двухкомпонентную систему и с помощью уравнения Гиббса-Дюгема выразим ΔH, ΔV, ΔS через ПАВ.
ΔH = X1H1+X2H2
ΔV = X1V1+X2V2 (1)
ΔS = X1S1+X2S2
ΔсмешS= – X1RlnX1 – X2RlnX2 (2)
Из определения
следует: ΔH1=0 ΔH2=0
ΔV1=0 ΔV2=0 (3)
ΔS1=– RlnX1
ΔS2=– RlnX2
Равенство 3 обозначает то, что в идеальном растворе энергия взаимодействия разнородных молекул равна энергии взаимодействия однородных молекул. В отличии от идеальных газов в идеальных растворах осуществляется связь между молекулами, но энергия взаимодействия между всеми молекулами является одинаковой. Распределение молекул компонентов по объему растворов будет равномерной, т.о. при образовании жидких растворов и газовых смесей – теплота растворения будет равно 0. При растворении твердого вещества по закону Гесса можно разбить на 2 стадии: 1. плавление тела, 2. распределение вещества по всему объему раствора.
ΔраствH= ΔплавH. В случае растворения газа в идеальном растворе теплота растворения равна теплоте парообразования. ΔраствH= ΔплавH=ΔкондH
14. Давление насыщенного пара компонента над раствором. Закон Рауля.
Рассмотрим зависимость давления насыщенного пара р-ля и растворённого в-ва от состава р-ра и св-в чистых компонентов.
р-р→←насыщенный пар
Предположим, что все компоненты которые обр. р-р являются летучими. Тогда равновесный насыщенный пар будет содержать все компоненты р-ра.
При изучении зависимости давления насыщенного пара р-ра от состава можно изучить термодинамические св-ва р-ра.
Давление насыщенного
пара – сумма парциальных давлений
летучих компонентов в р-ре P=![]() Это следует из закона Дальтона для
идеальных газов. Pобщ=P1+P2+…
Это следует из закона Дальтона для
идеальных газов. Pобщ=P1+P2+…
Тогда Рi=p*χi р- общее давление летучих компонентов, χi – молярная доля газовойсмеси.
Рассмотрим зависимость давления насыщенного пара от состава р-ра р-р →← насыщ. пар
![]()
 (1)
(1)
![]() (2)
(2)
![]()
![]() (3)
(3)
Проинтегрируем
(3) в след. пределах
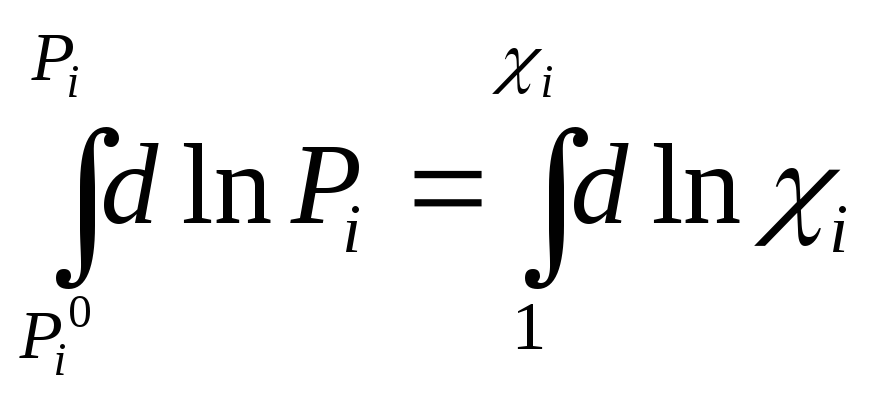 ;
;
![]() Рi0
– давление насыщенного пара над чистым
компонентом, Pi
- -//- над р-ром. Потенцируем выр-ние:
Рi0
– давление насыщенного пара над чистым
компонентом, Pi
- -//- над р-ром. Потенцируем выр-ние:
![]()
![]()
 -- математическое
выражение закона Рауля.
-- математическое
выражение закона Рауля.
![]()
Равновесное парциальное давление насыщенного пара компонентов пропорционально его молярной доле в идеальном р-ре.
15. Растворимость газа в жидкостях. Закон Генри.
Относительное понижение насыщенного пара над р-ром пропорционально молярной доле.
Для определения парциальной зависимости парциальных давлений растворённые в-ва для прот. их состава необходимо применить ур-ние Гиббса Дюгема.
![]()
![]() --
химический потенциал р-ля и растворённого
в-ва соответственно.
--
химический потенциал р-ля и растворённого
в-ва соответственно.
![]()
![]() ;
;
![]() Преобразуем правую часть выр-ния.
На основании закона Рауля
Преобразуем правую часть выр-ния.
На основании закона Рауля
![]() ;
;
![]()
![]() ;
;
![]()
![]() ;
;
![]() проинтегрируем полученное выр-ние.
проинтегрируем полученное выр-ние.
![]() ;
К2
– постоянная интегрирования.
;
К2
– постоянная интегрирования.
Потенцируем выр-ние:
![]() -- закон Генри.
-- закон Генри.
Парциальное давление
растворённого в-ва пропорционально его
молярной доле в р-ре.
![]() Г – постоянная Генри. Величина
обратная Г -- S=1/Г
(растворимость газа в жидкости).
Г – постоянная Генри. Величина
обратная Г -- S=1/Г
(растворимость газа в жидкости).
Растворимость газа в жидкости зависит от: давления, температуры, хим. природы р-ля, присутствием смесей.
Растворение газа в жидкости называется адсорбцией.
Закон Генри применим
