
- •1 Літературний огляд
- •1.1 Конструкції випарних апаратів
- •2 Фізико-хімічні основи процесу випарювання
- •3 Опис технологічної схеми та основного апарату
- •3.1 Технологічна схема трикорпусної випарної установки
- •3.2 Випарний апарат з природною циркуляцією
- •4 Розрахунок основного обладнання
- •4.1 Продуктивність установки
- •4.2 Концентрації упарюваного розчину
- •4.3 Температура кипіння розчинів
- •4.4 Корисна різниця температур
- •4.5 Визначення теплових навантажень
- •4.6 Вибір конструкційного матеріалу
- •4.8 Розподіл корисної різниці температур
- •5 Матеріальний і тепловий баланси
- •6 Розрахунок допоміжного апарату
- •6.1 Розрахунок холодильника упареного розчину
2 Фізико-хімічні основи процесу випарювання
 Фізична
суть процесу випарювання полягає в
перетворенні частини рідини (розчинника)
в пару при згущенні розчинів або в
перетворенні всієї рідини в пару, якщо
випарюють однокомпонентну рідину
(наприклад воду). Слід відрізняти
випарювання від випаровування.
Випаровування відбувається з поверхні
і при будь-якій температурі, тоді як
випарювання — з усієї маси рідини при
температурі, що відповідає точці кипіння
при певному тиску.
Фізична
суть процесу випарювання полягає в
перетворенні частини рідини (розчинника)
в пару при згущенні розчинів або в
перетворенні всієї рідини в пару, якщо
випарюють однокомпонентну рідину
(наприклад воду). Слід відрізняти
випарювання від випаровування.
Випаровування відбувається з поверхні
і при будь-якій температурі, тоді як
випарювання — з усієї маси рідини при
температурі, що відповідає точці кипіння
при певному тиску.
З точки зору молекулярно-кінетичної теорії при випарюванні і випарювання відбувається видалення частини молекул речовини, що перебувають у тепловому русі, з простору, який займає рідина. Молекули, які видаляються з рідини, заповнюють паровий простір і утворюють насичену пару цієї рідини. Частина цих молекул знову повертається в рідину, а частина випаровується, поповнюючи убуток у паровому просторі, тобто встановлюється рухома рівновага, внаслідок чого число молекул над рідиною, а отже і тиск насиченої пари набуває певної величини при заданій температурі.
Коли температура кипіння змінюється, рівновага порушується, а це спричинює відповідні зміни густини і тиску пари. Під час кипіння рідини пара виділяється не лише з поверхні, а й з парових бульбашок, що утворюються в самій рідині, і цей процес стає основним, бо утворені бульбашки є центрами пароутворення. Парова бульбашка в міру випаровування в неї рідини збільшується в розмірі, зростає і її піднімальна сила; тому, переборюючи опір рідини, вона спливає на поверхню, де й лопається, а замість неї утворюється нова бульбашка. Таке переміщення бульбашок з нижніх шарів рідини до її поверхні зумовлює безперервне перенесення утворюваної всередині рідини пари в паровий простір.
Парові бульбашки зароджуються на стінках шорсткої теплообмінної поверхні; їх утворенню сприяють також гази, які є в рідині; при нагріванні гази починають виділятися, утворюючи велику кількість бульбашок, в які й випаровується рідина.
 Умовою
утворення парових бульбашок є рівність
тиску пари всередині бульбашки і
зовнішнього тиску рідини, яка її оточує;
при цьому процес пароутворення
відбувається настільки інтенсивно, що,
незважаючи на надходження ззовні великої
кількості тепла, температура рідини не
підвищується.
Умовою
утворення парових бульбашок є рівність
тиску пари всередині бульбашки і
зовнішнього тиску рідини, яка її оточує;
при цьому процес пароутворення
відбувається настільки інтенсивно, що,
незважаючи на надходження ззовні великої
кількості тепла, температура рідини не
підвищується.
Іноді
спостерігається, що рідина в момент
початку кипіння є перегрітою; це буває
тоді, коли рідина не містить у собі
розчинених газів. У цьому випадку тиск
пари всередині бульбашки р1
повинен дорівнювати зовнішньому тиску
р0
додатковому тиску, зумовленому діями
капілярних сил на межі пара - рідина,
який дорівнює
![]() (де σ – поверхневий натяг, р – радіус
бульбашки):
(де σ – поверхневий натяг, р – радіус
бульбашки):
 (2.1)
(2.1)
Оскільки
р = f(t), то для того, щоб тиск усередині
бульбашки дорівнював р1
рідина повинна бути перегрітою на
величину
![]() (де ts
- температура насичення). Перегрівання
рідини зумовлене тим, що парова фаза
повинна виконати роботу проти сил
поверхневого натягу.
(де ts
- температура насичення). Перегрівання
рідини зумовлене тим, що парова фаза
повинна виконати роботу проти сил
поверхневого натягу.
При наявності розчинених газів випаровування відбувається головним чином у газові бульбашки, які виділяються з рідини при її нагріванні, тому дія поверхневого натягу майже не впливає на кипіння рідини, і перегрівання її незначне. Теплоносієм при випарюванні найчастіше є насичена або трохи перегріта пара; можна застосовувати газове або електричне обігрівання, а також обігрівання за допомогою високотемпературного теплоносія.
Щоб здійснити процес випарювання, тепло від теплоносія треба передати до киплячої рідини, що можливо лише при наявності температурного перепаду між ними. Ця різниця температур між теплоносієм і киплячою рідиною називається корисною різницею температур.
Витрата тепла на випарювання залежить від захованої теплоти пароутворення перетворюваної в пару речовини.
 При
випарюванні рідини під час кипіння
температура її залишається сталою, бо
з початком кипіння тепло витрачається
тільки на зміну агрегатного стану
рідини, тобто на перетворення рідини в
пару. Відомо також з фізики, що температура
кипіння рідини є функцією тиску і що з
підвищенням тиску температура кипіння
підвищується і, навпаки, при вакуумі
вона знижується. Останню обставину
часто використовують при випарюванні
розчинів, для яких у зв'язку з псуванням
продукту високої температури кипіння
допускати не можна.
При
випарюванні рідини під час кипіння
температура її залишається сталою, бо
з початком кипіння тепло витрачається
тільки на зміну агрегатного стану
рідини, тобто на перетворення рідини в
пару. Відомо також з фізики, що температура
кипіння рідини є функцією тиску і що з
підвищенням тиску температура кипіння
підвищується і, навпаки, при вакуумі
вона знижується. Останню обставину
часто використовують при випарюванні
розчинів, для яких у зв'язку з псуванням
продукту високої температури кипіння
допускати не можна.
Випарювання розчинів відрізняється від кипіння однокомпонентної рідини (наприклад, води) тим, що вони киплять при вищій температурі, ніж розчинник при тому самому тиску; на це слід зважати при розрахунку і проектуванні випарного апарата, особливо при виборі параметрів теплоносія і робочого режиму експлуатації.
Величина підвищення температури кипіння розчину порівняно з температурою кипіння чистого розчинника при тому самому тиску називається температурною депресією — υт Вона залежить від концентрації розчину, від тиску під час кипіння і від природи розчиненої речовини. Причиною підвищення температури кипіння розчинів є відмінність у ході температурної кривої (t )= f(p), для чистих рідин і для розчинів (рис. 2.1) внаслідок неоднакової їх леткості. Температура кипіння однокомпонентної рідини є функцією лише тиску, а для розчинів вона є функцією тиску і концентрації (ε). Те саме стосується і температурної депресії: υт = f(р, ε).
Слід зазначити, що υт нерідко досягає великих значень. Що ж до температури утворюваної пари в паровому просторі, то вона практично дорівнює температурі кипіння чистого розчинника при заданому тиску. Використовуючи відомий емпіричний закон Бабо, згідно з яким у «відносне зниження пружності пари розчинника над розчином певної концентрації є величина стала, незалежна від температури кипіння», тобто
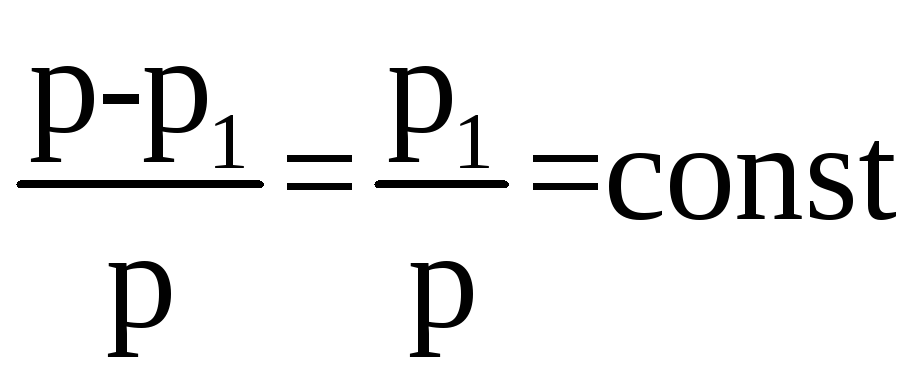 (2.2)
(2.2)
 де
p1
-
пружність пари розчину;
де
p1
-
пружність пари розчину;
p - пружність пари чистого розчинника, можна обчислити температуру кипіння розчину заданої концентрації при довільному тиску, якщо вона відома для одного якогось тиску.
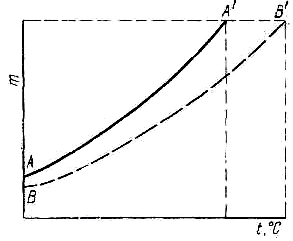
АА' – хід температурної кривої при кипінні чистого розчинника; ВВ' – хід температурної кривої при кипінні розчину.
Рисунок 2.1 – Графік зміни температури кипіння залежно від тиску для чистого розчинника і розчину
Температуру
кипіння розчину при різному тиску можна
також визначити за відомим у техніці
правилом лінійності хіміко - технічних
функцій: відношення різниці температур
кипіння (![]() )
будь-якої рідини при двох довільно
взятих значеннях тиску до різниці
температур кипіння якоїсь
)
будь-якої рідини при двох довільно
взятих значеннях тиску до різниці
температур кипіння якоїсь
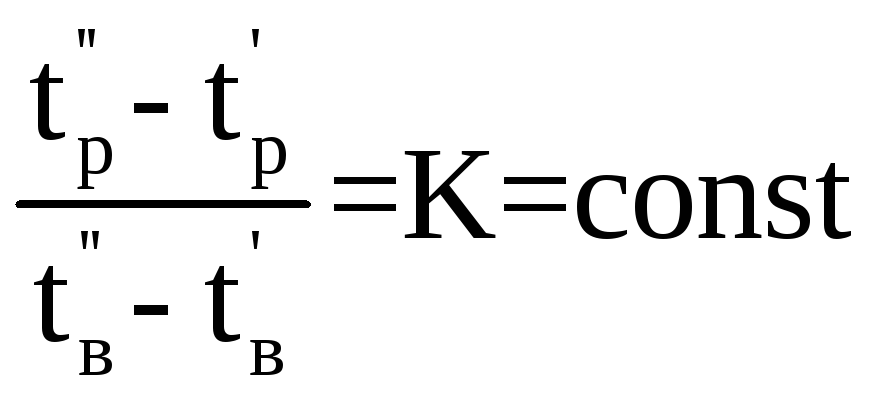 . (2.3)
. (2.3)
Метод визначення температурної депресії, запропонований професором І.О. Тищенко, грунтується на рівнянні Клапейрона – Клаузіуса:
![]() (2.4)
(2.4)
 де
А – тепловий еквівалент роботи;
де
А – тепловий еквівалент роботи;
v’’ – питомий об’єм сухої насиченої пари, м3/кг;
v’ – питомий об’єм рідини, м3/кг;
r – прихована теплота пароутворення, кДж/кг.
Температура кипіння розчину вища за температуру кипіння води при тому ж тиску. Наскільки вони розрізняються - залежить від властивостей розчиненої речовини. Різниця температур кипіння розчину і води при однаковому тиску називається температурною депресією Δ':
![]() . (2.5)
. (2.5)
У розчинів з однаковою концентрацією температурна депресія при підвищенні загального тиску над розчином дещо підвищується, а при розрідженні– знижується.
Підвищення температури кипіння розчину визначається не тільки температурою, а також гідростатичною і гідравлічною депресіями. Гідростатична депресія викликається тим, що нижні шари рідини в апараті закипають при вищій температурі, чим верхні (унаслідок гідростатичного тиску верхніх шарів). З підвищенням рівня рідини в апараті гідростатична депресія зростає. В середньому вона складає 1-3 0С. Гідравлічна депресія враховує пониження тиску вторинної пари унаслідок гідравлічного опору в паропроводах між корпусами установки. При розрахунках гідравлічну депресію приймають 1,0-1,5 0С.
Повна депресія Δ рівна сумі температурної Δ', гідростатичній Δ" і гідравлічної депресій Δ'":
Δ=Δ'+Δ''+Δ'" (2.6)
Випарювання ведуть як при атмосферному, так і при зниженому або підвищеному тиску. При випарюванні розчину під атмосферним тиском утворюється так звана вторинна пара, що випускається в атмосферу. Це найпростіший спосіб випарювання.
 При
випарюванні під зниженим тиском (при
розрідженні) в апараті створюється
вакуум. Для цього вторинна пара
конденсується в спеціальному конденсаторі,
а гази, що не конденсуються, відсмоктуються
вакуумом-насос.
При
випарюванні під зниженим тиском (при
розрідженні) в апараті створюється
вакуум. Для цього вторинна пара
конденсується в спеціальному конденсаторі,
а гази, що не конденсуються, відсмоктуються
вакуумом-насос.
При розрідженні температура кипіння розчинів знижується. Тому вакуум-випарку застосовують для чутливих до високої температури розчинів, а також для висококиплячих розчинів, коли температура нагріваючого агента не дозволяє вести процес під атмосферним тиском. Використання вакууму дозволяє також збільшити різницю температур між нагріваючим агентом і киплячим розчином, а отже, зменшити поверхню теплообміну. Проте вакуум-випарювальні установки дорожче із-за додаткових витрат на конденсаційні пристрої і їх обслуговування.
При випарюванні під підвищеним тиском вторинна пара може бути використана як нагріваючий агент в підігрівачах, для опалювання і т. п., а також для різних технологічних потреб. Випарювання під тиском пов'язане з підвищенням температури кипіння розчину, тому застосування даного способу обмежене властивостями розчину і температурою нагріваючого агента [5].
