
- •Тема 8. Фазовые равновесия и переходы Оглавление
- •Тема 8. Фазовые равновесия и переходы 1
- •Основные понятия и определения. Структура темы
- •Структура темы
- •Химический потенциал
- •Диаграммы состояния
- •Число степеней свободы (правило фаз Гиббса)
- •Однокомпонентные системы
- •Диаграмма состояния воды
- •Диаграмма состояния серы.
- •Диаграммы состояния двухкомпонентных систем. Термический анализ
- •Термический анализ
- •Диаграммы состояния двухкомпонентных систем при полной растворимости веществ в твердой фазе
- •Диаграмма состояния Ag-Au
- •Диаграммы состояния двухкомпонентных систем без образования области твердых расторов
- •Примеры диаграмм состояния двухкомпонентных систем
- •Конденсированное состояние вещества
- •Аморфные соединения
- •Кристаллы и их виды
- •Свойства кристаллов в зависимости от вида химических связей
- •Ковалентная связь
- •Ионная связь
- •Металлическая связь
- •Молекулярная связь
- •Водородная связь
-
Диаграмма состояния Ag-Au
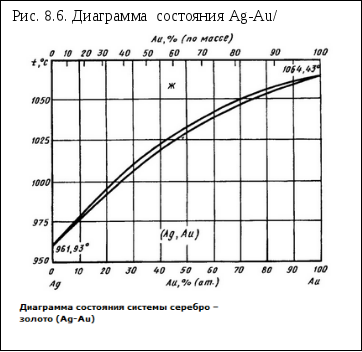
Ag и Аu образуют между собой непрерывный ряд твердых растворов. Построенные экспериментально кривые ликвидуса (на фазовых диаграммах линия полного плавления твёрдых фаз) и солидуса (линия на фазовых диаграммах, на которой исчезают последние капли расплава, или температура, при которой плавится самый легкоплавкий компонент) хорошо согласуются с расчетными кривыми, полученными термодинамическим путем. Интервал кристаллизации сплавов в средней части диаграммы состояния не превышает примерно 2 °С. Сплав, содержащий 50 % (ат.) Аu, имеет температуры ликвидуса и солидуса, равные, соответственно, 1032,5 и 1030,8 °С. Обнаружено отсутствие непрерывности на кривых зависимости электросопротивления, эффекта Холла и периода кристаллической решетки от состава для сплавов, отвечающих составам Ag3Au, Ag3Au2 и AgAu3.
-
Диаграммы состояния двухкомпонентных систем без образования области твердых расторов
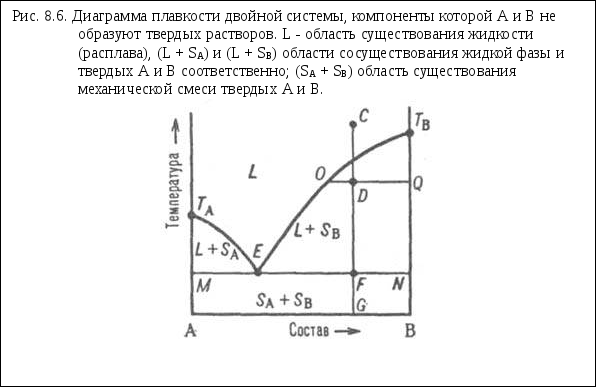
E - эвтектическая точка.
На диаграмме состояния (рис. 8.6.) линия, изображающая зависимость от состава температуры начала выделения из жидкой фазы твердого компонента (начала равновесной кристаллизации), называется линией ликвидуса. Она состоит из двух ветвей ТАЕ и ТВЕ, отграничивающих фазовое поле жидкости L от полей сосуществования жидкой фазы с твердыми А и В соответственно (поля L + SA и L + SB). Линия, изображающая зависимость от состава температуры окончания равновесной кристаллизации при охлаждении (или начала плавления при нагревании), называется линией солидуса. Ниже нее расположено фазовое поле SA + SB твердого состояния системы, отвечающее условиям сосуществования двух твердых фаз.
Происходящие в системе фазовые изменения описываются следующим образом. При охлаждении жидкой фазы, например, из начального состояния С, фигуративная точка системы в целом движется вниз вдоль прямой CG. В точке ее пересечения с линией ликвидуса начинается кристаллизация компонента В, система становится двухфазной и дивариантной или, поскольку давление фиксировано, условно моновариантной.
-
Примеры диаграмм состояния двухкомпонентных систем
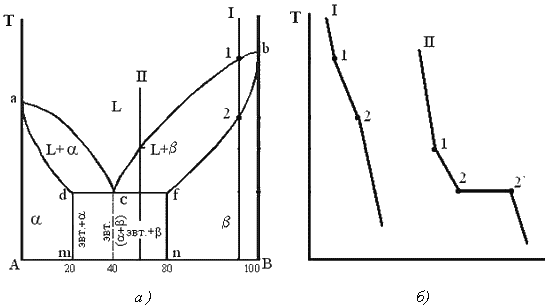
Рис. 8.7. Диаграмма плавкости двойной системы эвтектического типа с ограниченными твердыми растворами. L, α и β - области существования жидкой фазы (расплав) и твердых растворов В в А и А в В соотв.; (L + α) и (L + β) - области сосуществования жидкой фазы и твердых растворов α и β соответственно; (α + β) - область сосуществования двух твердых растворов. ТАЕТВ и MEN - линии ликвидуса и солидуса соотвественно, E - эвтектическая точка.
По мере кристаллизации В жидкость обогащается компонентом А, ее состав изменяется по ветви ликвидуса и по достижении системой состояния, изображаемого, например, фигуративной точкой D, жидкой и твердой фазам соответствуют фигуративные точки О иQ. Прямые, соединяющие фигуративные точки двух находящихся в равновесии фаз, называются нодами (или коннодами); горизонтальные ноды, подобные OQ, можно провести через любые точки фазовых полей, отвечающих гетерогенным состояниям системы. При выражении состава в массовых (молярных) долях отношение отрезков OD и DQ пропорционально отношению масс (чисел молей) твердой и жидкой фаз (так называемое правило рычага).
Оно позволяет рассчитать по диаграмме состояния относительные количества фаз при любой температуре, чтобы, например, определить полноту кристаллизации или степень извлечения данного компонента из жидкой фазы в твердую. В точке F пересечения прямой CG с линией солидуса начинается кристаллизация компонента А. Система становится трехфазной (жидкость и две твердые фазы А и В) и моновариантной , т.е. при постоянном давлении совместная кристаллизация двух твердых фаз (так называемая эвтектическая кристаллизация) протекает при постоянных температуре и составе жидкой фазы, отвечающих координатам эвтектической точки Е.
После завершения эвтектической кристаллизации система состоит из двух твердых фаз и является дивариантной (условно моновариантной). В обсуждаемом случае система после затвердевания состоит из относительно крупных кристаллов В и мелкодисперсной смеси совместно возникших при эвтектической кристаллизации кристаллов А и В; такую смесь называют эвтектикой. Если исходная жидкость имела эвтектический состав, продукт ее затвердевания - мелкодисперсная эвтектика без примеси крупных кристаллов какого-либо из компонентов. При нагревании смеси твердых А и В описанные явления протекают в обратной последовательности: изотермическое образование жидкости эвтектического состава вплоть до исчерпания какого-либо из твердых компонентов и растворение в жидкости оставшегося твердого компонента при дальнейшем повышении температуры, которое завершается по достижении фигуративной точкой системы линии ликвидуса.
Второй тип диаграммы характерен для случая ограниченной растворимости компонентов в твердом состоянии. Твердый раствор В в А (обозначается α-раствор) образуется лишь до определенной концентрации В, твердый раствор А в В (β-раствор) - лишь до определенной концентрации А. Для таких систем возможны два случая трехфазного равновесия: 1) эвтектическое равновесие жидкого расплава состава Е, твердого раствора α, концентрация которого соответствует точке М, и твердого раствора β, концентрация которого соответствует точке N, при эвтектической температуре, которая, как правило, ниже температур плавления TA и ТB обоих компонентов (рис. 3).
При охлаждении затвердевшей смеси ниже линии солидуса MN происходит изменение концентраций твердых растворов α и β соответственно по линиям MF и NG, которые дают температурную зависимость растворимости в твердом состоянии В в А и А в В. 2) Равновесие при температуре Тр, которая является промежуточной между температурами плавления ТА и ТB. Если, например, температура начала кристаллизации расплава с высоким содержанием А выше ТА (рис. 4), а с высоким содержанием В - ниже ТB, линия ликвидуса состоит из двух ветвей ТАР иТВР, соответствующих кристаллизации твердых растворов α и β.
