
- •5. Задание студентам :
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •1. Тема занятия: Линейные и циклические сопряженные системы. Ароматичность.
- •3. Задачи занятия:
- •5. Задание студентам:
- •5.1.Отчитаться за выполненные домашние задания;
- •6.4. Получить задания бумажного тестового контроля, ответить на тесты, ответы сдать
- •8. Литература для подготовки:.
- •Тюкавкина н.А., Бауков ю.И. Биоорганическая химия: Учебник.-2-е. -м., Медицина, 1991.- 528с. Стр.29 – 49.
- •Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •3. Задачи занятия:
- •5. Задание студентам:
- •5.2 Прослушать объяснения преподавателя, выполнить упражнения
- •Работа № 1. Сравнение основных свойств аммиака и мочевины. Образование нитрата мочевины.
- •К раствору, мочевины добавляют 2 капли конц. Нnо3, встряхивают содержимое. Немедленно образуется белый кристаллический осадок труднорастворимой азотнокислой мочевины.
- •Работа № 2. Сравнение кислотных свойств спиртов и фенолов.
- •8. Литература для подготовки.
- •3.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •3. Задачи занятия :
- •5. Задание студентам:
- •8. Литература для подготовки. Основная:
- •3.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •3. Задачи занятия :
- •5 . Задание студентам :
- •6. Методические указания к выполнению самостоятельной работы на занятии,
- •8. Литература для подготовки. Основная:
- •3.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •Работа № 1. Окисление первичных спиртов раствором перманганата калия.
- •Работа № 2. Окисление альдегидов гидроксидом меди (п).
- •8. Литература для подготовки.
- •2.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •2.2. Изучить важнейшие биохимические превращения карбоновых кислот.
- •3. Задачи занятия
- •5. Задание студентам
- •8. Литература для подготовки
- •2 .Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •8. Литература для подготовки
- •2.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •5. Задание студентам
- •8. Литература для подготовки
- •2.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •5. Задание студентам
- •8. Литература для подготовки
- •2.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •3. Задачи занятия :
- •4. Продолжительность занятия : 2 акад. Часа.
- •5. Задание студентам:
- •6. Методические указания к выполнению самостоятельной работы на занятии.
- •8. Литература для подготовки. Основная:
- •3.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •5. Задание студентам
- •Работа № 2. Восстановительные (редуцирующие) свойства моносахаридов - альдоз (окисление глюкозы гидроксидом меди (II) в присутствии щелочи)
- •8. Литература для подготовки
- •2.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •5. Задание студентам
- •8. Литература для подготовки
- •2.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •5. 5. Задание студентам
- •8. Литература для подготовки
- •2.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •5. 5. Задание студентам
- •8. Литература для подготовки
- •2.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
- •Биоорганическая химия
- •1 Курс. 1 семестр
- •3. Задачи занятия :
- •4. Продолжительность занятия : 2 акад. Часа.
- •5. Задание студентам:
- •6. Методические указания к выполнению самостоятельной работы на занятии.
- •8. Литература для подготовки. Основная:
- •2.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
- •9. Обсуждено на заседании кафедры 29. 08. 2008 г.
8. Литература для подготовки.
Основная:
1. Тюкавкина Н.А. Биоорганическая химия: учебник для вузов / Н.А. Тюкавкина, Ю.И. Бауков.- 4-е изд., стереотип. - М.: «Дрофа», 2005- 542 с. Стр. 28-45.
2.Л.А.Каминская, И.В.Гаврилов Биоорганическая химия: Учебное пособие для самостоятельной работы студентов 1 курса очного обучения: Специальности 060101-лечебное дело, 060103- педиатрия, 060104-медико-профилактическое дело, 060105-стоматология.-Екатеринбург: Изд-во»практика», 2008.-136с С. 14-18 , 93 -94, 126 -128
3. «Руководство к лабораторным занятиям по биоорганической химии» под ред. Тюкавкиной Н.А. – М.: Медицина, 1985. – С: 42-50.
Дополнительная:
.
1. А.А. Тюкавкина. «Биоорганическая химия» М. Медицина. 1991г. с 37-38, 49-50, 90-91, 100
- 112.
2.Каминская Л.А. Обучающие задачи с элементами теории. – Изд. Св. гос. мед. ин-та, 1986
– 89с.
3.Реутов о.А., Курц а.Л., Бутин к.П. Органическая химия – м.: мгу, 1999 – с.535.
4.Сайкс П. Механизмы реакций в органической химии., Пер с англ – М.: Химия, 1991 – С. 448.
9. Обсуждено на заседании кафедры 29. 08. 2008 г.
10. Учебное задание подготовлено. доц.. Каминской Л.А., доц. Гавриловым И.В.
ГОУ ВПО УГМА РОСЗДРАВА
кафедра биохимии
Утверждаю
Зав. каф. проф., д.м.н.
Мещанинов В.Н.
_____‘’_____________2008 г
Биоорганическая химия
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ДЛЯ СТУДЕНТОВ
К ПРАКТИЧЕСКОМУ ЗАНЯТИЮ № 4
Факультет: лечебно-профилактический, медико-профилактический, педиатрический
1 Курс. 1 семестр
1. ТЕМА ЗАНЯТИЯ : Изомерия биоорганических соединений.
2. УЧЕБНАЯ ЦЕЛЬ ЗАНЯТИЯ :
2.1.Усвоить представления об особенностях строения биоорганических молекул , существовании соединений-изомеров, отличающихся порядком соединения атомов или их пространственным расположением.
2.2.Выявить связь между строением , реакционной способностью, биологической активностью. Выявить особое значение оптической изомерии для изучения биохимических процессов в организме.
2.3..Выполнить практические работы, подтверждающие свойства соединений-изомеров.демонстрирующие кислотно-основные свойства органических соединений
3. Задачи занятия :
3.1.Изучить понятия: изомерия, изомер. Виды изомерии( структурная, пространственная) и понятия опрической изомерии- энантиомеры, диастереомеры, мезоформы, рацемическая смесь.
3.2. Освоить правила построения структурных формул стереоизомеров в проекциях Фишера. оксикислотный ключ Розанова,
3.4.Освоить методики лабораторных исследований таутомерии- динамической изомерии, характерной среди биологически активных соединений.
4. ПРОДОЛЖИТЕЛЬНОСТЬ ЗАНЯТИЯ 2 акад. часа.
5. Задание студентам:
5.1.Отчитаться за выполненные домашние задания;
5.2 Прослушать объяснения преподавателя, выполнить упражнения
5.3. .Провести контроль усвоения знаний, тестовый контроль по теме занятия; итоги тестирования сдать преподавателю
5.4. Выполнить лабораторную практическую работу:
a Обнаружение енольной формы ацетоуксусного эфира. Бромирование ацетоуксусного эфира.
6. МЕТОДИЧЕСКИЕ УКАЗАНИЯ ДЛЯ ВЫПОЛНЕНИЯ САМОСТОЯТЕЛЬНОЙ
РАБОТЫ :
6.1.Составить конспект лабораторного исследования
6.2. Подготовить реактивы и лабораторную посуду
6.3. Провести лабораторное исследование, записать выводы.
Лабораторно- практическая работа
Обнаружение енольной формы ацетоуксусного эфира. Бромирование ацетоуксусного эфира.
Реактивы и материалы
Ацетоуксусный эфир (этиловый эфир ацетоуксусной кислоты);
Раствор железа ( +3) хлорида 0,1 н.;
Бромная вода ( раствор брома)
Ход работы
В пробирку помещают 0,5 мл ацетоуксусного эфира и 10 капель раствора хлорида железа, содержимое пробирки перемешивают встряхиванием. Опишите наблюдаемые изменения.
Затем в пробирку быстро прикапывают 10 - 20 капель бромной воды, содержимое встряхивают. Также опишите изменения окраски, наблюдаемые в течение 2 минут.
Химизм процесса
При 250 С ацетоуксусный эфир представляет собой равновесную таутомерную смесь кетонной (92,5 %) и енольной (7,5 %) форм.
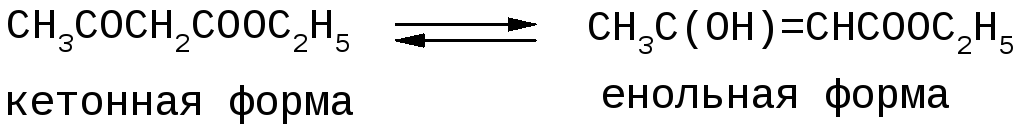
Енольная форма за счет енольной гидроксильной группы образует окрашенное фиолетово-красное комплексное соединение (хелат) с хлоридом железа FeCl3 (реакция равновесна и обратима).
Двойная связь (имеется в енольной форме и в хелате) быстро присоединяет бром, хелат разрушается, его окраска исчезает – переходит в светло-розовую.
Через некоторое время после связывания всей енольной формы с бромом, таутомерное равновесие смещается в сторону ее образования и окраска хелата появляется снова. Добавление новой порции бромной воды снова связывает енольную форму, что приводит к исчезновению окраски. Этот цикл окрашивания – обесцвечивания раствора добавлением бромной воды можно повторить несколько раз до полного бромирования ацетоуксусного эфира.

7 КОНТРОЛЬНЫЕ ВОПРОСЫ ПО ТЕМЕ ЗАНЯТИЯ: смотрите задание для студентов к практическому занятию.
