
- •Основные понятия и законы химии Материя и движение
- •Закон сохранения массы и энергии
- •Атомно-молекулярное учение
- •Масса атомов и молекул
- •Количество вещества. Моль.
- •Стехиометрические законы химии
- •Закон Авогадро
- •Химические системы
- •Периодический закон и периодическая система химических элементов д.И. Менделеева
- •Строение вещества Строение атома
- •Состояние электрона в атоме
- •Строение многоэлектронных атомов
- •Периодическая система элементов и электронная структура атомов
- •Периодичность свойств атомов
- •Физические состояния веществ
- •Газовое состояние вещества
- •Плазменное состояние вещества
- •Жидкое состояние вещества
- •Твердые вещества
- •Типы кристаллов и свойства веществ
- •Понятие о зонной теории кристаллов
Газовое состояние вещества
При обычных условиях газы состоят из молекул с ковалентными связями или атомов (инертные газы).
Характерные свойства газов:
1. Способность расширяться. Газы не имеют собственной формы и объема. Вследствие непрерывного движения частиц (диффузии) газы заполняют весь объем сосуда и оказывают на стенки его постоянное давление, одинаковое во всех направлениях.
2. Сжимаемость.
3. Способность к смешиванию с другими газами в любых соотношениях.
Основные газовые законы:
1. Закон объемных отношений Гей-Люссака (см. стехиометрические законы).
2. Закон Авогадро (см. стехиометрические законы).
3. Объединенный газовый закон (для постоянной массы газа), представляющий собой объединение законов Бойля-Мариотта, Гей-Люссака и Шарля:
p . V / T = const или p . V / T = p0 . V0 / T0 ,
где V - объем газа при давлении р и температуре Т, V0 - объем газа при нормальных условиях (давлении p0 = 101,325 кПа и температуре T0 = 273 К).
4. Уравнение состояния идеального газа (уравнение Клапейрона-Менделеева):
p . V = n . R . T ,
где n - число молей газа, R - универсальная (молярная) газовая постоянная, равная 8,314 Дж / (К . моль).
5. Закон парциальных давлений Дальтона
Общее давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов, составляющих смесь.
рсмеси = ∑рi ,
где рi - парциальное давление данного газа, входящего в смесь (то давление, которое производило бы имеющееся в смеси количество данного газа, если бы оно занимало при той же температуре весь объем, занимаемый смесью).
Перечисленные законы справедливы для идеальных газов (таких, частицы которых представляют собой материальные точки, не имеющие объема, и между частицами отсутствует взаимодействие). Для реальных газов при невысоких давлениях они соблюдаются приближенно, при высоких давлениях наблюдаются отклонения от этих законов, которые растут с увеличением давления и с понижением температуры. Их причина - увеличение межмолекулярного взаимодействия (ван-дер-ваальсовых сил).
6. Уравнение состояния реального газа (уравнение Ван-дер-Ваальса):
( р + a . n2 / V2 ) .( V - n . b ) = n . R . T ,
где a и b - постоянные Ван-дер-Ваальса (содержащие их члены уравнения - поправки к уравнению состояния идеального газа - учитывают межмолекулярные взаимодействия и объем молекул).
7. Уравнение среднего квадрата скорости молекул газа (атомов - для инертных газов)
v2 = 3 RT / M
При постоянной температуре среднеквадратичная скорость движения молекул газа постоянна и определяется молярной массой газа. Но скорости отдельных молекул различаются.
Распределение молекул по скоростям - распределение Максвелла-Больцмана - зависит от природы газа (рис. 2) и от температуры (рис.3):
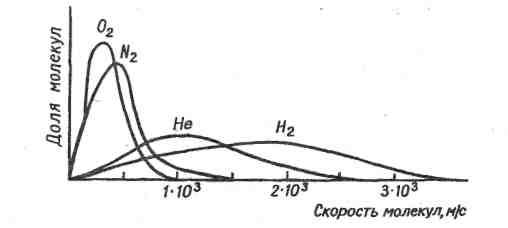
Рис.2. Распределение молекул по скоростям Максвелла-Больцмана при температуре 298 К
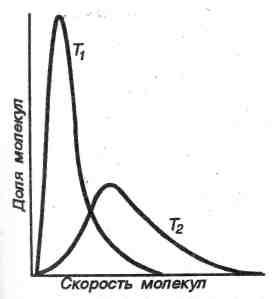
Рис.3. Влияние температуры на распределение молекул по скоростям (Т2 > Т1)
Существует подобное распределение и по энергиям частиц.
Химический состав земной атмосферы достаточно сложен и изменяется по высоте. Содержание газов в чистом сухом воздухе около земной поверхности (в объемных %): азот N2 - 78.08, кислород O2 -20.95, инертные газы (в основном аргон Ar - 0.94), углекислый газ CO2 - 0.035, в очень малых количествах есть также водород Н2 и метан СН4. Кроме того, в обычном воздухе содержатся пары воды и продукты деятельности человека: оксиды азота NO, NO2, сернистый газ SO2, оксиды углерода СО, СО2, озон О3.
