
4 Некоторые способы выражения
КОНЦЕНТРАЦИИ РАСТВОРОВ
В самом общем плане под концентрацией раствора можно понимать соотношение между количествами, массами, объемами и т.п. растворителя (раствора) и растворенного вещества. В этом смысле своеобразным способом выражения концентрации раствора является растворимость (см. разд.3). Однако эта характеристика имеет ограниченное применение, т.к. имеет смысл только в отношении насыщенных растворов. Для характеристики ненасыщенных растворов чаще всего используют следующие способы выражения концентрации: массовая доля (процентная концентрация), молярность, моляльность, мольная доля и некоторые другие.
Массовая доля растворенного вещества равна отношению его массы к массе всего раствора:
![]() (7)
(7)
Если это отношение выразить в процентах, то получим соотношение, которое обычно называют массовой процентной концентрацией:
![]() (8)
(8)
Из этих формул нетрудно найти связь между растворимостью и массовой долей насыщенного раствора:
![]() (9)
(9)
где 100 – это масса растворителя.
Молярная концентрация (молярность раствора) показывает число моль растворенного вещества в каждом литре данного раствора и рассчитывается по формуле:
![]() (размерность
(размерность
![]() )
(10)
)
(10)
Моляльная концентрация (моляльность раствора) равна количеству (моль) растворенного вещества, которые приходятся на каждый килограмм растворителя в данном растворе:
![]() (размерность
(размерность
![]() )
(11)
)
(11)
Мольная доля – это отношение количества данного вещества к сумме количеств всех веществ в растворе (в том числе и растворителя):
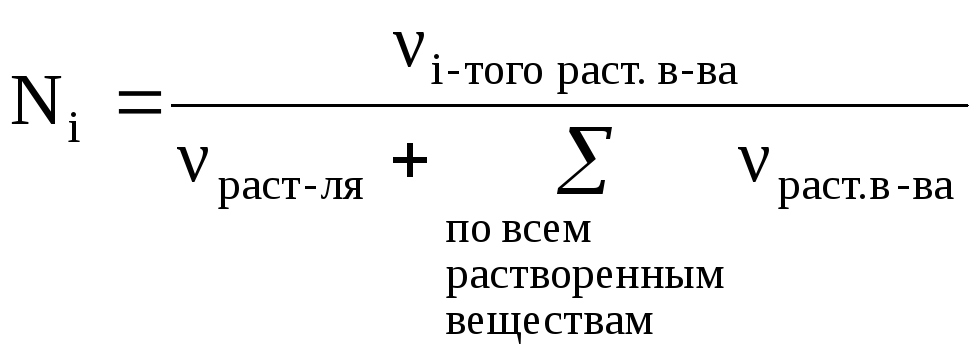 (12)
(12)
В простейшем случае, когда в растворе находится только одно растворенное вещество, формула принимает вид:
![]() (13)
(13)
Сумма мольных долей всех компонент раствора равна единице.
5 Свойства идеальных растворов
Образование растворов, как мы уже выяснили, является сложным физико-химическим процессом. Однако абстрагирование от химических явлений в ходе растворения тоже в ряде случаев оказывается весьма полезным. Во-первых, это позволяет установить некоторые общие закономерности свойств таких – идеальных растворов (Нраст = 0; Vраст = 0). А, кроме того, как выяснится позже, обосновать протекание в растворах некоторых веществ процессов, получивших название электролитическая диссоциация. Такой подход позволяет описать важные свойства разбавленных растворов, содержащих нелетучие растворенные вещества, а именно:
- изменение давления пара растворителя над раствором;
- изменение температур плавления (замерзания) и кипения раствора;
- осмотическое давление раствора.
Эти свойства, называемые коллигативными, зависят от природы растворителя и концентрации растворенного вещества, но не зависят от свойств этих частиц. Коллигативные свойства проявляются, когда в равновесии находятся две фазы, одна из которых содержит растворитель и растворенное вещество, а вторая - только растворитель.
Обсудим вначале причины изменения давления пара растворителя над раствором по сравнению с его давлением над чистым растворителем. При любой температуре часть молекул жидкости (растворителя) в результате теплового движения накапливают энергию, достаточную для разрыва межмолекулярных связей и перехода в газообразную фазу (пар). Эти молекулы и создают некоторое парциальное давление пара растворителя (Р0). При этом между жидкой и газообразной фазами (на границе раздела) устанавливается равновесие:
Е![]() сли
теперь в жидкости растворить некоторое
количество нелетучего вещества, то
часть молекул растворителя окажется
задействованной в гидратации и не сможет
самостоятельно участвовать в диффузии
и перераспределении энергии. Это в целом
скажется на вероятности испарения, что
приведет к смещению равновесия (14)
влево. Через некоторое время вероятности
(скорости) обоих процессов вновь
выравнятся, но уже при меньшем парциальном
давлении пара растворителя (Р). Французским
химиком Франсуа Мари Раулем (1886г) было
установлено, что относительное
понижение давления насыщенного пара
растворителя равно мольной доле
растворенного нелетучего вещества
(закон Рауля):
сли
теперь в жидкости растворить некоторое
количество нелетучего вещества, то
часть молекул растворителя окажется
задействованной в гидратации и не сможет
самостоятельно участвовать в диффузии
и перераспределении энергии. Это в целом
скажется на вероятности испарения, что
приведет к смещению равновесия (14)
влево. Через некоторое время вероятности
(скорости) обоих процессов вновь
выравнятся, но уже при меньшем парциальном
давлении пара растворителя (Р). Французским
химиком Франсуа Мари Раулем (1886г) было
установлено, что относительное
понижение давления насыщенного пара
растворителя равно мольной доле
растворенного нелетучего вещества
(закон Рауля):
![]() (15)
(15)
После почленного деления получим:
![]() или
или
![]() .
.
Поскольку Nраст..в-ва + Nраст-ля = 1, то в итоге
Р = Р0 Nраст-ля (16)
То есть: давление насыщенного пара растворителя над раствором пропорционально мольной доле растворителя (коэффициентом пропорциональности является парциальное давление пара растворителя над чистым растворителем – Р0).
Понижение давления пара над раствором приводит к изменению температуры кипения раствора. Кипение отличается от испарения тем, что газовая фаза (в виде пузырьков) начинает возникать в объеме жидкости. Это становится возможным только в том случае, если возникающие пузырьки способны выдержать давление атмосферного столба. поэтому парциальное давление пара (в том числе и в пузырьке) должно быть не ниже атмосферного (а реально – даже выше, поскольку требуется совершить работу на создание новой поверхности раздела, на разрыв большого числа межмолекулярных связей при ″раздвижении″ жидкости). При повышении температуры жидкости растет число ″активных молекул″, способных уйти в газовую фазу, соответственно, растет давление паров. Когда давление достигает атмосферного, начинается кипение. Например, в случае воды именно при 100 С давление паров H2O становится равным 1атм или 101,3 кПа. Введение в кипящую жидкость нелетучего вещества по закону Рауля понижает давление пара растворителя и кипение прекращается. Для достижения атмосферного давления в этом случае требуется дополнительное повышение температуры раствора. Таким образом, температура кипения растворов всегда выше температуры кипения чистого растворителя. Причем, повышение температуры кипения раствора пропорционально моляльной концентрации растворенного вещества:
Ткип = Е Сm (17)
(Е - эбулиоскопическая константа растворителя).
При Сm = 1моль/кг Ткип = Е , следовательно, эбулиоскопическая константа равна повышению температуры кипения одномоляльного раствора (находится методом экстраполяции, т.к. в растворах такой концентрации законы для коллигативных свойств не соблюдаются).
Е![]() ще
одно следствие из закона Рауля касается
изменения температуры плавления
(замерзания) разбавленных растворов.
Если после установления равновесия:
ще
одно следствие из закона Рауля касается
изменения температуры плавления
(замерзания) разбавленных растворов.
Если после установления равновесия:
растворить в жидкости некоторое количество какого-либо вещества (нерастворимого в твердой фазе), то, тем самым, часть молекул растворителя вовлекается в гидратацию и перестает участвовать в процессе кристаллизации. Равновесие (18) нарушается, плавление начинает преобладать. Для того, чтобы восстановить прежнее равновесие необходимо понизить температуру. То есть температура замерзания раствора всегда ниже температуры замерзания чистого растворителя (например, чистая вода замерзает при 0 С, а морская – при гораздо более низкой температуре). Можно показать расчетом, что понижение температуры замерзания раствора пропорционально моляльной концентрации растворенного в нем вещества:
Тз = К Сm (19)
(К - криоскопическая константа растворителя).
Кроме изменения температур фазовых переходов к важным общим свойствам растворов относят осмос. Осмосом называют явление избирательной диффузии молекул растворителя через полупроницаемую (перегородку) мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией. Полупроницаемость мембраны предполагает, что в ней имеются поры (каналы), сквозь которые способны пройти мелкие молекулы растворителя. В то же время перегородка непрозрачна для более крупных гидратированных молекул (ионов) растворенных веществ.
Коротко обсудим механизм этого явления на простом примере (рис.9). Молекулы растворителя имеются по обе стороны от мембраны и способны проникать сквозь ее поры в обоих направлениях. Однако вероятность их перехода из объема растворителя в раствор выше. Поэтому наблюдается преимущественный переход в раствор, скорость обратного процесса будет вначале меньше. Но со временем, за счет поднятия уровня раствора, в правой части сосуда создается избыточное давление, способное, в конце концов, полностью скомпенсировать явление осмоса.
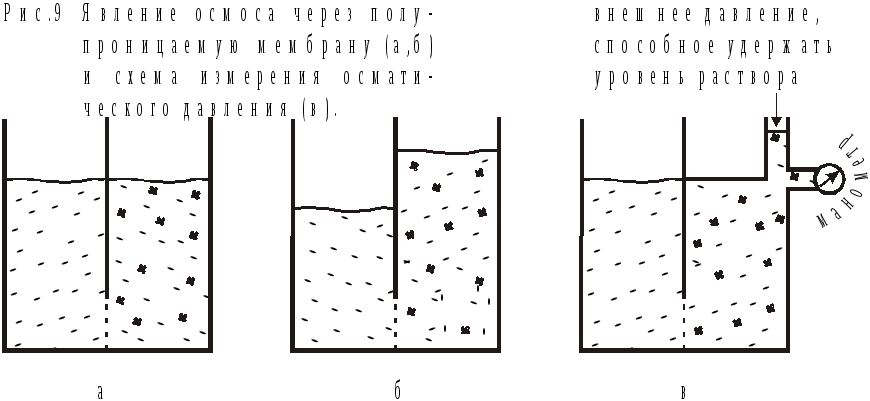
Устанавливается равновесие. Дальнейшее выравнивание концентраций прекращается. В 1886г голандский физико-химик Я.Г.Вант-Гофф установил, что осмотическое давление (π) равно тому давлению, которое производило бы растворенное вещество, если бы оно при данной температуре в виде идеального газа занимало объем раствора:
π = См R T , (20)
где См – молярная концентрация растворенного вещества, R - унивесальная газовая постоянная.
Это определение комментирует формулу, по которой осмотическое давление может быть рассчитано. Известно и другое определение, которое описывает методику измерения π: осмотическим давлением называют то дополнительное гидростатическое давление, которое необходимо оказать на мембрану со стороны более концентрированного раствора, чтобы остановить явление осмоса (рис. 9(в)).
Проявления осмоса часто можно наблюдать в быту (вытекание сока из нарезанных овощей и фруктов при посыпании их солью или сахаром), осмос имеет чрезвычайно большое значение в биологии, медицине. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры, что обеспечивает тургор (упругость) клеток, а это, в свою очередь, позволяет сохранять эластичность тканей, определенную форму органов. Если поместить клетку в воду или в раствор с меньшим содержанием веществ (с меньшим осмотическим давлением – гипотонический раствор), то происходит ее набухание вплоть до разрыва оболочки (лизис). В гипертонических растворах клетки сморщиваются из-за потери воды (плазмолиз). Это явление используется, например, при консервировании пищевых продуктов: микроорганизмы подвергаются плазмолизу и становятся нежизнедеятельными. Осмотическое давление крови, лимфы и тканевых жидкостей человека равно 7,7 атм при 37 ˚С. Физиологические растворы, кровезаменители должны быть изотоническими (таким, например, является 0,9%-ный (0,15 моль/л) раствор NaCl. Осмотическое давление – главная сила, обеспечивающая движение воды в растениях и ее подъем от корней до вершины. Клетки листьев, теряя воду, осмотически всасывают ее из клеток стебля, а последние – из клеток корня, берущих воду из почвы. Все описанные законы справедливы для бесконечно разбавленных идеальных растворов. С их помощью могут выполняться самые разнообразные расчеты (например, молекулярных масс растворенных веществ, степени их диссоциации или ассоциации и др.).
