
- •«Молекулярная физика и термодинамика» оглавление
- •Введение
- •Предмет молекулярной физики. Теплота.
- •Основные понятия раздела.
- •Молекулярно – кинетическая теория газов.
- •Температурные Шкалы.
- •Измерение температуры.
- •Измерение давления.
- •Основные газовые законы. Уравнение Менделеева – Клапейрона.
- •Закон Бойля – Мариотта.
- •Уравнение состояния идеальных газов.
- •Закон Авогадро.
- •Закон Дальтона.
- •Основное уравнение кинетической теории газов.
- •Распределение скоростей молекул по Максвеллу.
- •Скорости молекул.
- •Барометрическая формула.
- •Распределение Больцмана.
- •Опыты Перрена (экспериментальное определение числа Авогадро).
- •Средняя длина и среднее время свободного пробега молекул.
- •Явления переноса.
- •Диффузия.
- •Внутреннее трение (вязкость).
- •Теплопроводность.
- •Теплопроводность и внутреннее трение в газах при низком давлении.
- •Общее уравнение переноса.
- •Получение и методы измерения низких давлений.
Барометрическая формула.
При равновесном состоянии газа хаотичное тепловое движение молекул приводит к равномерному распределению газа по всему объёму, т.е. n = const в среднем везде. Но если газ находится в поле внешних сил, то распределение молекул может быть и неоднородным. Рассмотрим, например, газ, находящийся в поле силы тяжести. В частности, это может быть и воздух(атмосферный) в поле силы тяжести Земли: при условиях, близких к нормальным, воздух можно считать идеальным газом.
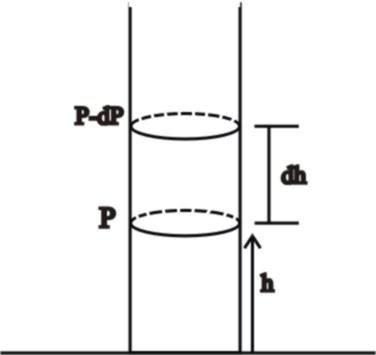
Разность атмосферного давления на высоте h и h + dh равна весу столба воздуха, заключённого в объёме цилиндра с S=1м2 и высотой dh.

ρ – плотность воздуха на высоте h.
![]()
Р- атмосферное давление на высоте h, P0 – на высоте h=0.
μ – средняя молярная масса воздуха, определённая с учётом процентного содержания в воздухе азота, кислорода и других газов.
Воздух мы рассматривали как идеальный газ, а температуру считали постоянной.
Соотношение (1) –
барометрическая формула Лапласа. Её
можно преобразовать :![]()
![]()
Тогда, произведя некоторые
преобразования, получим:
![]()
n- концентрация молекул на высоте h,
n0- концентрация молекул на высоте h=0.
Соотношение (2) можно
записать так:
![]()
( ).
).
Соотношения (1),(2) пригодны для любого газа в силовом потенциальном поле.
Распределение Больцмана.
Запишем Барометрическую
формулу :
![]()
![]()
где n0,n – концентрация молекул на высоте h и h0=0; m0 - масса молекулы. Из (1) следует, что с понижением Т число частиц с высотой убывает и при Т=0 обращается в 0. При Т = 0 все молекулы располагаются на поверхности Земли. При высоких Т молекулы располагаются на высоте почти равномерно. Это все объясняется тем, что распределение молекул по высоте определяется двумя факторами: притяжением их к Земле и тепловым движением (оно стремится разбросать молекулы равномерно по всем высотам). При Т=0 тепловое движение прекращается, превалирует mg. При высоких Т превалирует тепловое движение.
Соотношение (2) даёт распределение молекул по потенциальным энергиям.
Из (2) следует, что n меньше там, где ЕР больше, и наоборот.
Соотношение (2) называют распределением Больцмана, т.к. он доказал, что распределение (2) справедливо не только для гравитационного поля Земли, но и для любого потенциального поля для совокупности любых одинаковых частиц, совершающих хаотическое тепловое движение.
Т.о. закон Максвелла – это распределение по кинетическим энергиям, а закон Больцмана – распределение по потенциальным энергиям.
Согласно (2) количество
молекул, попадающих в объём
![]() расположенный вокруг точки с координатами
x,y,z,
равно:
расположенный вокруг точки с координатами
x,y,z,
равно:
![]() это также закон распределения Больцмана.
это также закон распределения Больцмана.
Объединенный закон Максвелла- Больцмана запишется в виде :

Или так :
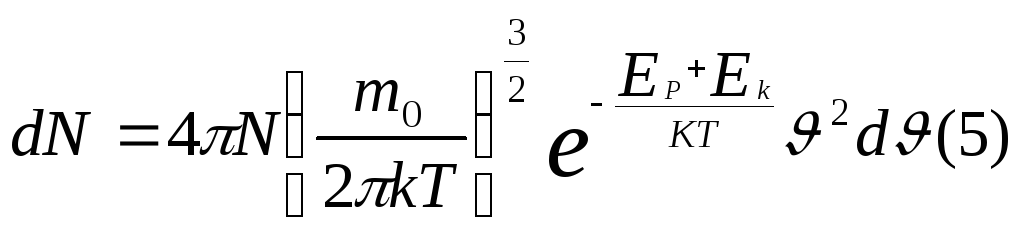
В (5) ЕР и Ек - классические энергии , т.е. могут принимать непрерывный ряд значений.
Для квантового случая :
![]()
где Ni
– число частиц в состоянии с энергией
Ei.
А – коэффициент пропорциональности.
Его находят из условия
![]() ,
N – полное число частиц
в рассматриваемой системе. С учётом (7)
имеем для случая дискретных значений
Е:
,
N – полное число частиц
в рассматриваемой системе. С учётом (7)
имеем для случая дискретных значений
Е:
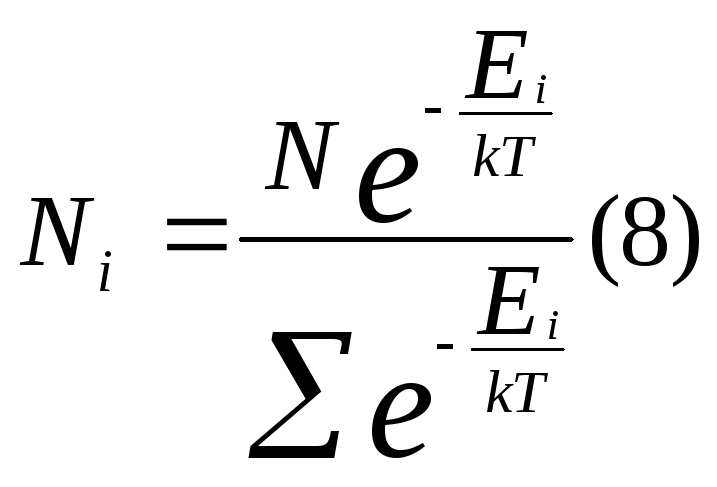
![]() Распределение
Больцмана
Распределение
Больцмана
Вообще распределение частиц описывается функцией Бозе – Эйнштейна (частицы с целым спином ) либо функцией распределения Ферми - Дирака (частицы с полуцелым спином ).
С повышением температуры эти распределения переходят в распределения Максвелла- Больцмана.

При Т → 0 движение молекул подчиняется законам квантовой механики. Область состояний, в которой газ не подчиняется распределению Максвелла – Больцмана, называется областью вырождения газа. Так, для водорода вырождение наступит при Т ≈ 1К. Для более тяжёлых газов эта температура ещё ниже.
В области вырождения уравнение Менделеева – Клапейрона не выполняется и энергия не является линейной функцией температуры. Квантовые особенности частиц проявляются и при больших плотностях, соответствующих конденсированному состоянию вещества.
