
vidp-himia-091
.docxРішення завдань
ІІ етапу Всеукраїнської учнівської олімпіади з хімії
8 КЛАС
1.
υ (К) : υ (Сl)
: υ (O)
=
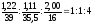
Відповідь: КСlO4
2. FexOy
x
: y
=
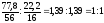 FeO
FeO
x :
y =
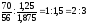 Fe2O3
Fe2O3
x :
y =
 Fe3O4
Fe3O4
Відповідь: FeO, Fe2O3, Fe3O4
3.
а) υ (Сl2)
=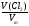 =
=
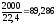 (моль)
(моль)
υ =
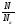 ;
N
= 6,02 ·1023 ·
89,286
= 5,375·1025
молекул,
а кількість
;
N
= 6,02 ·1023 ·
89,286
= 5,375·1025
молекул,
а кількість
атомів у 2 рази більше, тобто 1,075·1026
б)
υ (Н2)
=
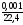 = 4,46
10-5
(моль)
= 4,46
10-5
(моль)
υ =
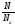 ;
N
= 6,02 ·1023 ·
4,46
;
N
= 6,02 ·1023 ·
4,46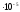 = 2,68·1019молекул,
а атомів буде
= 2,68·1019молекул,
а атомів буде
5,36·1019
Відповідь: а) 5,375·1025 молекул, 1,075·1026 атомів
б) 2,68·1019 молекул, 5,36·1019 атомів.
4. FeSO4 · 7 H2O
Мr (FeSO4 · 7 H2O) = 278
278 – 98 x = 19,75 %
56 – x
Відповідь: 19,75 %
5. Один із можливих варіантів:
3FeSO4 + 2Al → Al2(SO4)3 + 3Fe
2 Fe + 3Сl2 → 2 FeСl3
6. Co + 2HCl = CoCl2+ H2
CoO + 2HCl = CoCl2+ H2O
Co2O3 + 6HCl = 2CoCl3+ 3H2O
Вміст
Со в суміші: m
=

Отже, в 25г суміші міститься 0,59 г кобальту і 1,91 г оксидів кобальту.
З воднем взаємодіють тільки оксиди. Кількість кобальт (ІІ) оксиду позначимо через у г, тоді кількість кобальт (ІІІ) оксиду становитиме (1,91 – у) г.
СоО + Н2 = Со + Н2О
При
взаємодії 75 г СоО утворюється 18 г Н2О,
тоді при взаємодії у г СоО утвориться
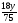 г
Н2О
г
Н2О
Со2О3 + 3Н2 = 2Со + 3Н2О
При
взаємодії 166 г утворюється 54 г Н2О,
тоді при взаємодії (1,91- у) г Со2О3
утвориться
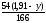 г
Н2О
г
Н2О
Усього води утворилося 0,6 г (за умовою).
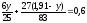 ;
у = 0,25 г
;
у = 0,25 г
Склад суміші:
m (Со) = 0,59 г; m (СоО) = 0,25 г ; m (Со2О3) = (1,91- 0,25) = 1,66 г
w
(Со)
=
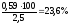 ;
w
(СоО)
=
;
w
(СоО)
=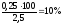 ;w
(Со2О3)
=
;w
(Со2О3)
=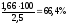
Відповідь: w (Со) = 23,6 %; w (СоО) =10 % ;w (Со2О3) =66,4 %
9 КЛАС
1. Me + n HCl → MeCln + (n/2) H2
Маса зменшилася на: 50 · 0,0168 = 0,84 (г)
Х г Me – (n/2) · 22,4л H2
0,884 г – 0,336л H2
х = (0,84 · n · 22,4л) / (2 · 0,336) = 28n (г)
Якщо Ме одновалентний (n = 1), то Ме = 28 · 1 = 28 г. Така відносна атомна маса у кремнія, але він не розчиняється у хлоридній кислоті. При n = 2, відносна атомна маса дорівнює 56. Цей метал – залізо.
Відповідь: Fe
2.
Згідно
із законом радіоактивного розпаду, N
= N0(1/2)n,
де N0
– початкова кількість речовини, N
– кількість речовини через деякий час,
n
=
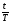 ,
T – період піврозпаду. За умовою N
/ N0
=
1/8, а тому
,
T – період піврозпаду. За умовою N
/ N0
=
1/8, а тому
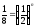 ,
звідки n
= 3,
,
звідки n
= 3,
 ,
t = 3T.Тобто кількість речовини зменшується
у 8 разів за час, що дорівнює трьом
періодам піврозпаду. Отже, 3T = 11,4. T =
,
t = 3T.Тобто кількість речовини зменшується
у 8 разів за час, що дорівнює трьом
періодам піврозпаду. Отже, 3T = 11,4. T =
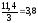 (діб).
(діб).
3.
υ =
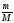 ;
ρ =
;
ρ =
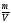
М (CuSO4·5H2O) = 250 г/моль, М (CuSO4) = 160 г/моль.
υ
(CuSO4)
= υ (CuSO4·5H2O)
=
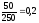 моль.
m
(CuSO4)
= 160
· 0,2
= 32 (г). m
(р-ну) =
моль.
m
(CuSO4)
= 160
· 0,2
= 32 (г). m
(р-ну) =
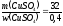 =
80 (г).
=
80 (г).
m
(H2O)
= 80-50 = 30 (г), V(H2O)
=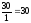 (мл)
(мл)
4. 2CrCl3 + 3Br2 + 16NaOH → 2Na2CrO4 + 6NaBr + 6NaCl + 8H2O
Cr+3 – 3e- → Cr+6 2 відновник
Br2 0 + 2e- →2 Br- 3 окисник
5. W (E) = 100 – 28,5 = 71,5 %
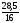 :
: ;
х =
;
х =
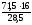 =
40
=
40
Відповідь: Е = Са
6. Обчислимо об’єми утворених газів
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
x
=
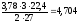 л
H2
л
H2
2 KClO3 = 2KCl + 3O2↑
Mr (KClO3) = 122,5
y
=
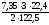 =
2,016 л О2
=
2,016 л О2
Обчислимо кількість утвореного хлороводню:
H2 + Cl2 = 2НCl
За рівнянням реакції з 0,224 л Cl2 та 0,224 л H2 може утворитись 0,448 л НCl. Залишилося 4,704 – 0,224 = 4,48 (л) H2. Визначимо кількість утвореної води:
2H2 + О2 = 2Н2О
2,016 л О2 реагують з 4,032 л H2, отже в надлишку залишилось 4,48 – 4,032 = 0,448 (л) H2.
Z
=
 = 3,24 (г)
Н2О
= 3,24 (г)
Н2О
Визначимо масову частку хлоридної кислоти
36,5 г НCl мають об’єм 22,4 л
n г НCl - 0,448 л
n = 0,73 г НCl.
Усього розчину буде 3,24 + 0,73 = 3,97 (г).
У 3,97 г розчину міститься 0,73 г НCl
У 100 г – m г HCl
m = 18,4 (г)
Отже, утворився розчин хлоридної кислоти з масовою часткою 18,4 %;
0,448 л водню залишилось у надлишку.
Відповідь: 18,4 %; 0,448 л H2.
10 КЛАС
1. 1. N2 + O2 = 2NO
2. 2NO + O2 = 2NO2
3. 3NO2 + H2O = 2HNO3 + NO
4. 4HNO3 = 2NO2 +O2 + 2 H2O
Відповідь: А – N
Б – O
В – H
2.
υ =
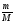 ;
2Al
+ 6HCl = 2AlCl3
+ 3H2
;
2Al
+ 6HCl = 2AlCl3
+ 3H2
υ
(Al) =
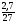 =
0,1
(моль)
=
0,1
(моль)
Згідно з рівнянням, υ (Al) = 3υ (HCl), отже, з 0,1 моль Al прореагує 0,3 моль HCl, тобто кислота міститься в надлишку. При цьому виділяється 0,15 моль Н2.
CuO + H2 = Cu + H2O
υ
(CuO)
=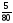 =
0,0625 (моль);
H2
–
в надлишку.
=
0,0625 (моль);
H2
–
в надлишку.
υ (Cu) = υ (CuO) = 0,0625 моль
Практично одержать металу:
υ (Cu) = 0,0625 0,9 = 0,05625 (моль), m (Cu) = 0,05625 64 = 3,6 (г)
Відповідь: m (Cu) = 3,6 (г)
3.
υ =
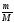 ;
w
=
;
w
=
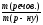 ;
=
;
=

Розрахуємо масу міді, яка прореагувала, та масу відновленого срібла, яке осіло на пластинці:
Сu + 2AgNO3 = Сu (NO3)2+ 2Ag
 m
(n.)
= 20 г
m
(n.)
= 20 г
 m
(т.)
= 152
г
m
(т.)
= 152
г
 m
(n.)
= 90-70 = 20 г
х =
m
(n.)
= 90-70 = 20 г
х =
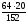 =
8,42 (г). у =
=
8,42 (г). у =
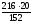 =
28,42 (г).
=
28,42 (г).
Залишилось 70 – 8,42 = 61,58 (г) Сu
υ
(Cu)
=
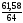 =
0,9622 (моль), υAg
=
=
0,9622 (моль), υAg
=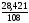 =
0,2632 (моль).
=
0,2632 (моль).
3Cu + 8HNO3(розб.) = 3Cu(NO3)2 + 2NO+ 4H2О
З
рівняння випливає: υ (HNO3)
=
 = 2,5659 (моль)
= 2,5659 (моль)
3 Ag + 4HNO3(розб.) = 3Ag NO3 + NO+ 2H2О
Усього прореагувало: υ (HNO3) = 2,5659 + 0,3509 = 2,9168 (моль)
Тоді m(HNO3) = 2,9168 63 = 183,76 (г)
m(р-ну
HNO3)
=
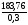 =
612,5 (г), V(р-ну
HNO3)
=
=
612,5 (г), V(р-ну
HNO3)
=
 =
518,6 (мл). Відповідь:
V(р-ну
HNO3)
= 518,6 (мл).
=
518,6 (мл). Відповідь:
V(р-ну
HNO3)
= 518,6 (мл).
4.
υ =
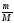 .
Припустимо, що маємо 100 г суміші, яка
містить х г СаСО3
та (100 - х) г Са(ОН)2.
Маса
суміші після прожарювання зменшиться
на 37,5 г тому, що обидві речовини
розкладуться з виділенням газоподібних
речовин. За рівняннями реакцій розрахуємо
маси карбон діоксиду та водяних парів,
які виділяться під час термолізу суміші:
.
Припустимо, що маємо 100 г суміші, яка
містить х г СаСО3
та (100 - х) г Са(ОН)2.
Маса
суміші після прожарювання зменшиться
на 37,5 г тому, що обидві речовини
розкладуться з виділенням газоподібних
речовин. За рівняннями реакцій розрахуємо
маси карбон діоксиду та водяних парів,
які виділяться під час термолізу суміші:
х г а г (100-х) b г
СаСО3= СаО + СО2 Са(ОН)2 = СаО + Н2О
100 г 44 г 74 г 18 г
a
=
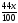 (г)
b
=
(г)
b
=
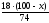 (г)
(г)
a
=
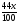 +
+
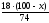 = 37,5. Звідси х = 66,97 (г)
= 37,5. Звідси х = 66,97 (г)
m Са(ОН)2= 100 – 66,97 = 33,03 (г)
υ
СаСО3= =
0,6697 (моль)
=
0,6697 (моль)
υ
Са(ОН)2=
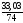 =
0,4464 (моль)
=
0,4464 (моль)
υ СаСО3 : υ Са(ОН)2 = 0,6697 : 0,4464 = 1,5 : 1 = 3 : 2
Відповідь: υ СаСО3 : υ Са(ОН)2 = 3 : 2
5.
K2Cr2O7 + 3H2S + 4H2SO4 = K2SO4 + Cr2(SO4)3 + 3S + 7H2O
υ
(S) =
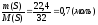
S + 2H2SO4(конц.) = 3SO2 + 2H2O , υ (SO2) = 3υ (S) = 0,7 3 = 2,1 (моль),
V(SO2) = υ (SO2) Vm = 2,1 22,4 = 47 л
Відповідь: V(SO2) = 47 л
6.
υ
=
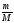 ;
υ = (MgS04
2H20)
= 1,2821 (моль).
;
υ = (MgS04
2H20)
= 1,2821 (моль).
υ (MgS04) = υ (MgS04 2H20) = 1,2821моль.
m (MgS04) = 120 1,2821 = 153,85 (г). т (H20) = 200 - 153,85 =46,15(г)
Припустимо, що шукана маса розчину становить х г. Визначимо масу солі в цьому розчині: 159 г р-ну містить 59 г солі,
х г р-ну містить а г солі. Звідси а = 0,3711х (г).
т (Н20) = х - 0,3711х = 0,6289х (г). Після охолодження до 20°С в розчині залишиться: (0,3711х - 153,85) г MgS04 та (0,6289х - 46,15) г Н20.
Можна записати:
100 г води розчиняє 44,5 г солі,
(0,6289х - 46,15) г води розчиняє (0,3711х - 153,85) г солі.
44,5 (0,6289х - 46,15) = 100 (0,3711х- 153,85). Звідси х = 1461 г
Відповідь: m = 1461 г
11 КЛАС
1. υ
=
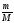 ;
υ (Н20)
=
;
υ (Н20)
= =
0,6 (моль), υ (ВаСОз) =
=
0,6 (моль), υ (ВаСОз) =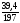 = 0,2
(моль),
= 0,2
(моль),
υ
(Ва(НСОз)2)
= =0,1
(моль). Фосфор (V)
оксид поглинув 0,6 моль
=0,1
(моль). Фосфор (V)
оксид поглинув 0,6 моль
води, а карбон діоксид при пропусканні крізь баритову воду утворив певну кількість речовини барій карбонату та барій гідрогенкарбонату:
Ва(ОН)2 + С02 = ВаС03 + Н20; (І)
ВаС03 + С02 + Н20 = Ва(НС03)2. (II)
На утворення 0,1 моль Ва(НС03)2 витрачено 0,1 моль С02 та 0,1 моль ВаС03 (згідно з рівнянням II). Отже, за рівнянням реакції (І) повинно було утворитись 0,2 + 0,1 = 0,3 (моль) барій карбонату, на що витратилось 0,3 моль С02. Усього витрачено 0,3 + 0,1 = 0,4 (моль) С02.
υ (Н) = 2 υ (Н20) = 0,6 2 = 1,2 (моль), т (Н) = 1,2 1 = 1,2 (г).
υ (C) = υ (С02) = 0,4 12 = 4,8 (г). Перевіримо, чи містила вихідна речовина Оксиген: т (О) = 6 - (1,2 + 4,8) = 0. Отже, органічна речовина містила лише атоми Гідрогену та Карбону. Визначимо формулу невідомого вуглеводню: v(C) : v(H) = 0,4 : 1,2 = 1 : 3. Найпростіша формула речовини — СН3. Однак такої речовини не існує. Тоді подвоюємо кількість атомів С та Н. Одержимо етан — С2Нб.
Відповідь: С2Нб.
2. Пропонуємо розв’язок одним із можливих способів.
Кількість цинку в суміші позначимо через х г, а об'єм водню, що виділився в результаті взаємодії цинку з кислотою — через у л. Кількість заліза в суміші становить (1,86 — х) г, а об'єм водню, що виділився в результаті розчинення заліза в кислоті — (0,672 – у) л. З рівнянь реакцій видно, що
65 г Zn витискують 22,4 л Н2;
х г » у л Н2; у = 0,345х
при взаємодії 56 г Fe виділяється 22,4 л Н2;
(1,86 — х)г Fe » (0,672 — у) л Н2;
22,4 (1,86 — х) = 56 (0,672 — у).
Підставимо значення у = 0,345 х;
х = 1,3 г.
Отже, в суміші 1,3 г Zn, 0,56 з Fe та 0,64 г Сu.
Відповідь: 1,3 г Zn, 0,56 г Fe та 0,64 г Сu;
52 % Zn; 22,4 % Fe; 25,6 % Сu.
3.
0,7 0,35 0,175 0,175
4N02 + 2Ва(ОН)2 = Ba(NO2)2 + Ba(N03)2 + 2H20
46 г/моль 171 г/моль 229 г/моль 261 г/моль
υ
(N02)
=
 =
=
 =
0,7 (моль);
=
0,7 (моль);
((Ba(OH)2)
=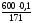 = 0,35 (моль).
= 0,35 (моль).
Отже, υ (NOa) : υ [Ba(OH)2] =2:1 (співвідношення вихідних
речовин стехіометричне).
За хімічним рівнянням визначимо кількість речовини
утворених солей:
υ
(N02)
=
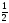 υ [Ba(OH)2]
=
υ [Ba(OH)2]
=
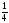 [Ba(N02]2)
=
[Ba(N02]2)
=
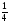 υ [Ba(N03)2].
υ [Ba(N03)2].
Отже, υ [Ba(N02)2] = υ [Ba(N03)2] = 1/4 0,7 = 0,175 (моль).
Знайдемо масу солей:
m [Ba(N02)2] = 0,175 229 = 40,08 (г);
m[Ba(NQ3)2] = 0,175 261 = 45,68 (г).
Обчислимо масу розчину, яка збільшиться на масу ввібраного NO2:
m (N02) = υ M(N02) = 0,7 46 = 32,2 (г);
m (р-ну) = 600 + 32,2 = 632,2 (г).
Знайдемо масову частку солей в утвореному розчині:
w [Ba(N02)2]
=
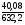 100
% = 6,34 %,
100
% = 6,34 %,
w [Ba(N03)2]
=
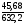 100
% = 7,23
%,
100
% = 7,23
%,
Відповідь: 6,34 % Ba(N02)2; 7,23 % Ba(N03)2.
4.
2S03 = 2S02 + 02. Припустимо, що маємо 1 моль S03. Тоді розкладеться 0,04 моль S03 і при цьому утвориться, згідно з рівнянням реакції, 0,04 моль S02 та 0,02 моль 02. Таким чином, рівноважна суміш міститиме: 0,02 моль 02, 0,04 моль S02 та (1 - 0,04) = 0,96 (моль) S03. Загальна кількість речовини суміші становить 0,02 + 0,04 + 0,96 = 1,02 (моль).
х
= х (О2)
=
х (О2)
=
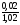 = 0,0196 х
(SО2)
=
= 0,0196 х
(SО2)
=
 = 0,0392
= 0,0392
х (SО3) = 1 - 0,0196 - 0,0392 = 0,9412.
В 1 моль суміші міститься 0,0196 моль 02, 0,0392 моль S02 та 0,9412 моль S03. М(сум.) = 64 0,0392 + 32 0,0196 + 80 0,9412 = 78,4 (г/моль).
DH2
=
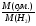 =
=
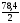 =
39,2
=
39,2
Відповідь: DH2 = 39,2
5. М(сум. СН4, С4Н10) = 18 2 = 36 (г/моль). Припустимо, що в 1 моль суміші міститься х моль СН4 та (1- х) моль С4Н10.
36 = 16х + 58 (1 – х)
Звідси х = 0,5238 (моль). х (СН4) = υ (C3H6) = 52,38%.
V(CH4) = 150 0,5238 = 78,58 (дм3),
V (С4Н10) = 150-78,58 =71,42 (дм3)
СН4 + 202 = С02 + 2Н20 (І) 2С4Н10 + 1302 = 8С02 + 10Н2О (ІІ)
Із рівняння
(І) випливає: V(02)
= 78,58
2 = 157,16 (дм3).
З рівняння (II)
випливає:
V
(02)
=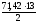 =
464,23 (дм3).
Загальний об'єм кисню
=
464,23 (дм3).
Загальний об'єм кисню
становитиме 157,16 + 464,23 = 621,39 (дм3). М(сум. 02, 03) = 1,4 29 =
= 40,6 (г/моль). Припустимо, що в 1 моль суміші міститься у моль 02
та (1 - у) моль 03.
40,6 = 32у + 48 (1 - у). Звідси у = 0,4625 (моль).
υ (03) = 1 - 0,4625 = 0,5375 (моль). x(Оз) = υ (03) = 53,75%.
В 100 дм3 суміші озону і кисню міститься 53,75 дм3 03 та 46,25 дм3 02.
При розкладанні
озону за рівнянням реакції 203
= 302
утвориться =
80,625 (дм3)
02.
Загальний
об'єм кисню становитиме
=
80,625 (дм3)
02.
Загальний
об'єм кисню становитиме
46,25 + 80,625 = 126,875 (дм3). Можна записати:
зі 100 дм3 суміші озону і кисню одержимо 126,875 дм3 02,
з а дм3 суміші озону і кисню одержимо 621,39 дм3 02.
Звідси а = 490 (дм3).
Відповідь: 490 (дм3).
6.
Н2 + С12 = 2НС1. Щ
Позначимо об'єм хлору у вихідній суміші через х л. Через деякий час прореагувало 20%, тобто 0,2 х л хлору. Згідно рівняння, прореагувало також 0,2 х л водню і при цьому утворилося 0,4 х л НС1, що становить 30% утвореної суміші:
0,4х = 30; х = 75.
Отже, у вихідній суміші містилося 75% хлору і 25% водню.
Хлор можна добути:
1) діючи окислювачами на концентровану хлоридну кислоту та її солі за схемами:
4HCl + 02=2Cl2 + 2H20;
16НС1 + 2КМп04 = 2МпС12 + 5С12 + 2КС1 + 8Н20;
4НС1 + Мп02 = МпС12 + C12+ 2Н20;
6НС1 + КС103 = КС1 + ЗС12 + ЗН20; І
2NaCl + Mn02 + 2H2S04 = MnS04 + Na2S04+Cl2 +2H2О
2) електролізом розплаву або розчину хлориду натрію та інших солей хлору:
2NaCl 2Na + Cl2
2NaCl + 2Н20 2NaОН + Н2 + Cl2
Основні методи добування водню: і
1) взаємодія цинку з розбавленою хлоридною кислотою
Zn + 2HC1 = ZnCl2 + H2
2) взаємодія алюмінію чи кремнію з їдким натром:
2А1 + 2NaOH + 6Н2О = 2Na [А1 (ОН)4] + ЗН2
Si + 2NaOH + Н20 = Na2Si03 + 2H2 І
3) взаємодія натрію з водою:
2Na + 2Н20 = 2NaOH + H2
4) взаємодія води з кальцій гідридом . .
СаН2 + 2Н20 = Са (ОН)2 + 2Н2
5) залізо-паровий метод:
3Fe + 4Н20 = Fe304 + 4H2 V
6) пропускання водяної пари над розпеченим коксом при 1000° С:
Н20 + С = СО + Н2.
7) пропускання водяного газу в суміші з парою води над каталізатором (оксиди феруму, кобальту) при 400° С:
CO + Н20 = С02 + Н2;
8) взаємодія водяної пари с фосфором:
2Р + 8Н20 = 2Н3Р04 + 5Н2
Методи добування хлористого водню:
1) синтез з водню і хлору:
Н, + С12 = 2НС1;.
2) взаємодія кислот з галогенідами:
NaCl + H2S04 = NaHS04 + HCl
3) гідролітичний розклад галогенідів:
РС13 + 3H20 = Н3Р03 + 3HC1;
4) взаємодія водневих сполук з галогенами у водному розчині (у газоподібному стані реакція відбувається у зворотному напрямі):
C12+H2S = 2HC1+S
Відповідь: 75% хлору і 25% водню.
