
- •Иркутск 2011
- •Требования к результатам лабораторных работ по дисциплине «Химия»
- •Лабораторная работа 1 классы неорганических соединений
- •Выполнение работы
- •Опыт 2. Получение и свойства кислотных оксидов
- •Опыт 3. Взаимодействие амфотерных оксидов с кислотами и щелочами
- •Опыт 4. Получение и свойства оснований
- •Опыт 5. Получение основных солей
- •Лабораторная работа 2 определение молярной массы эквивалентов цинка Теоретическое введение
- •Выполнение работы
- •Данные опыта и результаты расчетов
- •Давление насыщенного водяного пара при различных температурах
- •Лабораторная работа 3 определение теплоты реакции нейтрализации Теоретическое введение
- •Выполнение работы
- •Лабораторная работа 4 скорость химической реакции Теоретическое введение
- •Выполнение работы
- •Опыт 1. Зависимость скорости реакции от концентрации реагирующих веществ
- •Опыт 2. Зависимость скорости реакции от температуры
- •Лабораторная работа 5 реакции в растворах электролитов Теоретическое введение
- •Выполнение работы Опыт 1. Сравнение химической активности кислот
- •Требования к результатам опыта:
- •Требование к результатам опыта:
- •Требования к результатам опыта:
- •Требование к результатам опыта:
- •Требования к результатам опыта:
- •Лабораторная работа 6 окислительно-восстановительные реакции Теоретическое введение
- •П роцесс окисления
- •Выполнение работы Опыт 1. Влияние среды на окислительно-восстановительные реакции
- •Опыт 2. Окислительно-восстановительная двойственность нитрита калия
- •Опыт 3. Реакция диспропорционирования
- •Опыт 4. Внутримолекулярная реакция
- •Лабораторная работа 7 жёсткость воды Теоретическое введение
- •Выполнение работы Опыт 1. Определение общей жёсткости воды
- •Библиографический список
Выполнение работы Опыт 1. Влияние среды на окислительно-восстановительные реакции
В три пробирки налейте по 2-3 мл раствора перманганата калия KMnO4. В первую пробирку прилейте 1-2 мл разбавленной серной кислоты H2SO4, во вторую 1-2 мл воды, в третью - 1-2 мл концентрированного раствора щелочи (NaOH или KOH).
В каждую пробирку добавьте по 2-3 мл свежеприготовленного раствора сульфита натрия Na2SO3. Отметьте наблюдения. Учтите, что фиолетовая окраска характерна для ионов MnO4-, бесцветная или слабо-розовая для ионов Mn2+, зеленая - для ионов MnO42-, бурый цвет имеет осадок MnO2.
Требования к результатам опыта:
1. Составьте уравнения реакций взаимодействия KMnO4 с Na2SO3 в кислой, щелочной и нейтральной среде. В каждой реакции укажите окислитель, восстановитель, среду, процессы окисления и восстановления. Расставьте коэффициенты.
2. Сделайте вывод о характерной степени окисления марганца в кислой, щелочной и нейтральной среде.
Опыт 2. Окислительно-восстановительная двойственность нитрита калия
В две пробирки налейте по 2-3 мл раствора нитрита калия KNO2. Добавьте в каждую из них по 1-2 мл разбавленной серной кислоты. Затем в одну из них прилейте раствор дихромата калия K2Cr2O7, в другую – раствор иодида калия KI. Что наблюдается?
Требования к результатам опыта:
1. Составьте уравнения реакций. Укажите в каждой реакции окислитель, восстановитель, среду, процессы окисления и восстановления. Расставьте коэффициенты.
2. Сделайте вывод об окислительно-восстановительных функциях KNO2 в проведенных реакциях.
3. Сделайте общий вывод, какие вещества могут проявлять окислительно-восстановительную двойственность.
Опыт 3. Реакция диспропорционирования
Поместите в пробирку 1-2 кристалла йода I2, 3-5 капель концентрированного раствора щелочи NaOH (или KOH). Как меняется цвет раствора?
Требования к результатам опыта:
1. Напишите уравнение реакции, учитывая, что продуктом окисления йода в щелочной среде является йодат натрия NaIO3 (или KIO3).
2. Сделайте общий вывод, какие вещества могут участвовать в реакциях диспропорционирования.
Опыт 4. Внутримолекулярная реакция
В сухую пробирку поместите небольшое количество кристаллов перманганата калия KMnO4 и осторожно нагрейте. Во время нагревания поднесите к отверстию пробирки тлеющую лучину. Что наблюдается? Нагревание продолжайте до прекращения выделения газа. Охладите пробирку и прилейте немного воды. Слейте pаствор с осадка диоксида марганца (MnO2) и разбавьте водой. Какова окраска раствора?
Требования к результатам опыта:
1. Закончите
уравнения реакций: KMnO4
![]()
K2MnO4 + Н2О =
В каждой реакции укажите окислитель, восстановитель, процессы окисления и восстановления. Расставьте коэффициенты.
2. Сделайте вывод, к какому типу ОВР относится каждая из реакций.
Лабораторная работа 7 жёсткость воды Теоретическое введение
Жёсткость воды обусловливается присутствием в ней солей кальция и магния. Различают временную (карбонатную) и постоянную (некарбонатную) жёсткость. Временную жёсткость придают воде гидрокарбонаты, постоянную – сульфаты и хлориды кальция и магния. Сумма временной и постоянной жёсткости составляет общую жёсткость воды.
Жёсткая вода непригодна для употребления в промышленности и быту. С этим связана проблема устранения жёсткости воды. Временную жёсткость можно устранить кипячением воды. При этом гидрокарбонаты разлагаются, переходя в малорастворимые соединения. Постоянную жёсткость устраняют обработкой воды карбонатом или фосфатом натрия, образующими осадки с ионами Са2+ и Мg2+. В настоящее время для устранения жёсткости воды широко используется ионный обмен, осуществляемый с помощью природных или синтетических ионитов.
Жёсткость воды выражается числом миллимолей эквивалентов ионов Са2+ и Мg2+, содержащихся в 1 л воды (ммоль/л). Один миллимоль эквивалентов жёсткости отвечает содержанию 20,04 мг/л ионов Са2+ или 12,16 мг/л ионов Мg2+.
Для определения общей жёсткости воды используется метод комплексонометрии. В основе этого метода лежит титрование воды в присутствии аммиачного буферного раствора и индикатора раствором комплексона III (трилона Б) до перехода винно-красной окраски в синюю.
При анализе применяют индикатор хромоген чёрный ЕТ-00. В присутствии ионов Са2+ и Мg2+ этот индикатор окрашивается в красный цвет, при отсутствии - в синий.
Трилон Б - двузамещённая натриевая соль этилендиаминтетрауксусной кислоты:
N
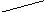 aOOCCH2 CH2COONa
aOOCCH2 CH2COONa
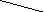
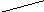 N
- CH2
- CH2
- N
N
- CH2
- CH2
- N
HOOCCH2 CH2COOH
При титровании жёсткой воды раствором трилона Б образуется внутрикомплексное соединение:
N
 aOOCCH2 CH2COONa
aOOCCH2 CH2COONa
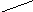
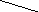
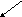
 N
- CH2
- CH2
- N
N
- CH2
- CH2
- N

 OOCCH2 CH2COO
OOCCH2 CH2COO

 М
М
(М – Са, Мg), т.е. связываются ионы Са2+ и Мg2+. Поэтому в конце титрования индикатор изменяет окраску и раствор становится синим.
Определение карбонатной жёсткости воды сводится к определению концентрации гидрокарбонат-ионов НСО3‾ и, тем самым, эквивалентной этим ионам концентрации ионов жёсткости Са2+ и Мg2+. Анализ проводят методом нейтрализации. В основе этого метода лежит титрование воды в присутствии метилоранжа раствором соляной кислоты до перехода жёлтой окраски индикатора в оранжевую.
Анион НСО3‾ в воде гидролизуется:
Н
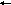 СО3‾
+ Н2О
Н2СО3
+ ОН‾
СО3‾
+ Н2О
Н2СО3
+ ОН‾
поэтому вода имеет щелочную реакцию среды и метилоранж в ней окрашен в жёлтый цвет. При титровании раствором HCl такой воды протекает реакция нейтрализации:
О
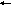 Н‾
+ Н+
Н2О
Н‾
+ Н+
Н2О
Ионы Н+ нейтрализуют количество ионов ОН‾, эквивалентное концентрации ионов НСО3‾.
Анализ воды на жёсткость предполагает обычно:
-
Определение общей жёсткости Жо.
-
Определение карбонатной жёсткости Жк.
-
Вычисление некарбонатной жёсткости Жнк = Жо – Жк.
