
- •1. Класифікація неорганічних сполук
- •1.1. Оксиди
- •Гідроксиди
- •2. Приклади розв’язання типових задач з теми 1
- •3. Основні поняття та закони хімії. Атомно-молекулярне вчення Програмні питання
- •3.1. Основні поняття та закони хімії
- •3.2. Запитання для самостійної підготовки
- •Приклади розв’язання типових задач з теми 3
- •Будова атома. Періодичний закон і періодична система д. І. Менделєєва
- •5.1. Будова атома
- •Основні характеристики елементарних частинок
- •5.2. Періодичний закон і періодична система д. І. Менделєєва
- •5.3. Запитання для самостійної підготовки
- •Приклади розв’язання типових завдань з теми 5
- •Набір квантових чисел для електронів, які характеризуються станом 4d7
- •Набір квантових чисел для атома з електронною конфігурацією 1s22s22p63s23р2
- •2P; 3s; 3d; 4p; 5s; 4d; 6s; 4f (табл. 6.3).
- •Розрахунок енергій ао за правилами Клечковського
- •7. Хімічний зв’язок. Будова молекул. Кристалічний стан речовини
- •7.1. Ковалентний хімічний зв’язок
- •Будова молекул
- •7.3. Іонний та металічний хімічні зв’язки. Міжмолекулярна взаємодія
- •Кристалічний стан речовини
- •Запитання для самостійної підготовки
- •Приклади розв’язання типових завдань з теми 7
- •Валентність Брому і за електронною конфігурацією
- •Елементи хімічної термодинаміки Програмні питання
- •9.1. Короткі теоретичні відомості
- •9.2. Запитання для самостійної підготовки
- •10. Приклади розв’язання типових задач
- •32 Г сірки (1 моль) виділяється 296,9 кДж;
- •Вплив температури на можливість перебігу хімічних процесів
- •11. Хімічна кінетика і хімічна рівновага Програмні питання
- •11.1. Кінетика хімічних процесів
- •11.2. Рівноважні процеси
- •Константа рівноваги
- •11.3. Запитання для самостійної підготовки
- •12. Приклади розв’язання типових задач з теми 11
- •За формулою (9.4) розраховуємо зміну вільної енергії Гіббса у хімічній реакції
- •13. Розчини. Загальні властивості розчинів неелектролітів Програмні питання
- •Властивості розчинів неелектролітів
- •13.3. Запитання для самостійної підготовки
- •Приклади розв’язання типових задач з теми 13
- •Тиск насиченої пари над розчином розраховуємо за формулою:
- •15. Розчини електролітів
- •15.1. Електролітична дисоціація у розчинах електролітів
- •15.2. Особливості розчинів електролітів
- •15.3. Напрям перебігу процесів у розчинах електролітів. Іонно-молекулярні рівняння
- •Тобто реакція зліва направо не перебігає. Слід пам’ятати, що серед основ сильними електролітами є тільки основи лужних та лужно-земельних металів:
- •15.4. Електролітична дисоціація води. Водневий показник рН
- •15.5. Добуток розчинності
- •15.6. Гідроліз солей
- •У молекулярному вигляді:
- •15.7. Запитання для самостійної підготовки
- •16. Приклади розв’язання типових задач
- •Використовуючи формулу (13.7), знаходимо ізотонічний коефіцієнт
- •Стандартні ентальпії утворення , ентропії та енергії Гіббса утворення деяких речовин при 298 к
- •Інтегральні теплоти розчинення деяких речовин у воді
- •Список рекомендованої та додаткової літератури
-
Запитання для самостійної підготовки
-
У чому полягає причина утворення хімічного зв’язку? Яка його природа?
-
Який хімічний зв’язок називають ковалентним? Чим можна пояснити напрямленість і насиченість ковалентного зв’язку?
-
Як за допомогою методу валентних зв’язків (МВЗ) можна обґрунтувати утворення ковалентного зв’язку?
-
Який ковалентний зв’язок називають полярним? Що є кількісною мірою полярності зв’язку? Що таке поляризованість зв’язку?
-
Який механізм утворення хімічного зв’язку називають донорно-акцепторним? Чим він відрізняється від обмінного механізму?
-
Що таке кратність хімічного зв’язку? У чому відмінність між - та -зв’язками?
-
Що розуміють під гібридизацією атомних орбіталей? Орбіталі якого типу підлягають гібридизації під час утворення молекул: CH3Cl, AlH3, CaCl2?
-
Чому під час утворення молекули SnCl4 відбувається гібридизація атомних орбіталей центрального атома, а під час утворення молекули SnCl2 ні? Обґрунтуйте геометричні форми молекул.
-
Який хімічний зв’язок називають іонним? Які властивості йонного зв’язку відрізняють його від ковалентного?
-
Що таке електронегативність ЕН? Як можна оцінити частку йонного зв’язку в молекулі за допомогою величин ЕН взаємодіючих атомів?
-
Що таке диполь? Що називають дипольним моментом молекули? Яка з наведених молекул HCl, HBr або HІ і чому має найбільше значення дипольного моменту?
-
Які молекули називають полярними? Чи може неполярна молекула мати полярні ковалентні зв’язки між атомами? Наведіть приклади.
-
Що називають міжмолекулярною взаємодією? Які взаємодії належать до орієнтаційних, індукційних та дисперсійних?
-
Який хімічний зв’язок називають водневим? Як впливає наявність водневого зв’язку на фізичні властивості речовин? Наведіть приклади.
-
Поясніть залежність фізичних властивостей речовин у кристалічному стані від типу зв’язку між частинками в кристалах. Наведіть приклади.
-
Що називається аморфним станом речовини? Чим він відрізняється від кристалічного?
-
Що називають ступенем окиснення та як його визначають? Наведіть приклади.
-
Чим відрізняються поняття валентності та ступеня окиснення? Наведіть приклади сполук, у яких ступінь окиснення елемента відрізняється від його валентності.
-
Наведіть приклади речовин, у кристалах яких реалізується металічний зв’язок. Чому метали мають високі тепло- та електропровідність?
-
Які фізичні властивості характерні для речовин з а) атомною; б) іонною; в) молекулярною і г) металічною кристалічними решітками?
-
Приклади розв’язання типових завдань з теми 7
Завдання 1. Визначити типи хімічних зв’язків, які утворюються в сполуках: N2, O2, Cl2, CaF2, NaCl, Na, CH4, LiH, BCl3, HCl, CO, H2O.
Розв’язання. У молекулах BCl3, CH4, H2O, CO, HCl реалізуються
ковалентні
полярні зв’язки між атомами, оскільки
в цих сполуках різниця електронегативностей
елементів ЕН
![]() 0 (Додаток 1).
0 (Додаток 1).
У молекулах N2, O2, Cl2 здійснюється ковалентний неполярний тип зв’язку, оскільки до складу кожної з цих молекул входять атоми тільки одного хімічного елемента з однаковими значеннями електронегативностей (ЕН = 0).
Речовини CaF2, NaCl мають іонний тип зв’язку оскільки різниця електронегативностей елементів (ЕН 1,9).
Завдання 2. Пояснити, чи можливе існування молекул PCl5 і NCl5 .
Розв’язання.
Е лектронна
будова атома Фосфору:
лектронна
будова атома Фосфору:
…
3p
3s
3d
О
3p
3s
3d
…
Р* … 3s1 3p3 3d1 B* = 5.
Отже, молекула PCl5 може існувати, причому Фосфор утворює п’ять хімічних зв’язків за ковалентним обмінним механізмом.
Молекула NCl5 не може існувати, тому що на другому валентному рівні атома Нітрогену немає d-підрівня:
7N 1s2 2s2 2p3 … B = 3.
2s
2p
Для атома Нітрогену не існує збудженого стану, саме тому він може утворювати лише три хімічні зв’язки за ковалентним обмінним механізмом.
Завдання 3. Відомо, що валентний кут у молекулі SCl2 становить 90о, наведіть схему перекривання атомних орбіталей під час утворення цієї молекули. Чому ця молекула полярна?
Р озв’язання.
Наводимо електронні конфігурації
валентних рівнів атомів Сульфуру та
Хлору:
озв’язання.
Наводимо електронні конфігурації
валентних рівнів атомів Сульфуру та
Хлору: 
3p
3s
3p
17Cl … 3s23p5 … В = 1.
3s
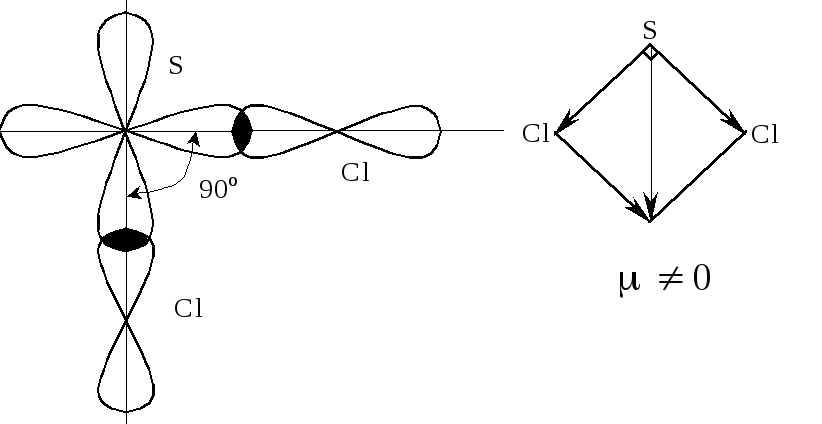 Обидва
неспарені р-електро-ни
Сульфуру беруть участь в утворенні двох
-зв’язків
із двома атомами Хлору, які мають по
одному неспареному електрону на р-атомній
орбіталі. Тому молекула SCl2
має кутову будову з валентним кутом
90.
Полярність молекули пояснюється тим,
що сума дипольних моментів окремих
зв’язків, що утворюють молекулу, не
дорівнює нулю (
Обидва
неспарені р-електро-ни
Сульфуру беруть участь в утворенні двох
-зв’язків
із двома атомами Хлору, які мають по
одному неспареному електрону на р-атомній
орбіталі. Тому молекула SCl2
має кутову будову з валентним кутом
90.
Полярність молекули пояснюється тим,
що сума дипольних моментів окремих
зв’язків, що утворюють молекулу, не
дорівнює нулю (![]() ≠
0).
≠
0).
Завдання 4. Визначити типи гібридизації центральних атомів, зобразити геометричні конфігурації: а) молекули амоніаку NH3; б) молекули води Н2О.
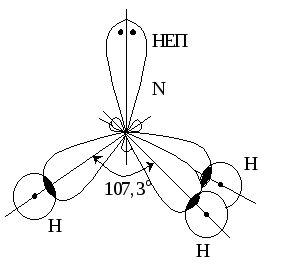
Розв’язання. а) Експериментально встановлено, що молекула амоніаку має пірамідальну геометричну форму, причому неподілена електронна пара (НЕП) атома Нітрогену напрямлена до однієї з вершин тетраедра. Всі зв’язки NH у цій молекулі є рівноцінними, а валентні кути становлять 107.
Якщо виходити з електронних формул атомів, що складають молекулу NH3 , хімічні зв’язки можуть бути утворені внаслідок перекривання трьох одноелектронних р-орбіталей атома Нітрогену з одноелектронними s-рбіталями трьох атомів Гідрогену.

2p
1s
НЕП
2s
Але в цьому випадку утворюється молекула пірамідальної просторової будови з кутами між зв’язками NH, близькими до 90, що не збігаються з експериментальними результатами.
Тому необхідно зробити припущення, що в атомі Нітрогену в момент утворення хімічного зв’язку відбувається sp3-гібридизація валентних орбіталей. При цьому одна з гібридних орбіталей має неподіленими електронними парами НЕП, а три інші – по одному електрону:
Підсумковий
дипольний момент молекули NH3
відрізняється від нуля
![]() ,
тому молекула амоніаку полярна.
,
тому молекула амоніаку полярна.
б
НЕП
 8O
… 2s22p4
… B
= 2;
8O
… 2s22p4
… B
= 2;
2s
2р

Отже, дві атомні орбіталі Оксигену утворюють два -зв’язки з s-орбіталями атомів Гідрогену, а дві інші гібридні орбіталі заповнені неподіленими електронними парами (НЕП).
Сумарний
дипольний момент молекули Н2О
відрізняється від нуля
![]() ,
тобто молекула води також полярна.
,
тобто молекула води також полярна.
У розглянутих молекулах амоніаку і води атомні орбіталі з неподіленими електронними парами (НЕП) не беруть участі в утворенні хімічного зв’язку, тобто вони є незв’язуючими. Зв’язуюча електронна пара знаходиться між двома взаємодіючими атомами і займає менший простір, ніж незв’язуюча. Тому відштовхування незв’язуючої пари проявляється більшою мірою, ніж зв’язуючої. Зменшення валентних кутів у ряді молекул СН4, NH3 і Н2О (відповідно 109,5; 107 i 104,5) обумовлене наявністю та збільшенням кількості незв’язуючих
орбіталей центрального атома за однакового типу гібридизації (sp3).
Завдання 5. Визначити типи гібридизації атомних орбіталей, які відбуваються в молекулах: а) СаН2; б) BBr3; в) CІ4. Зобразити їх геометричні конфігурації, оцінити валентні кути.
Р озв’язання.
а) У нормальному стані атом Кальцію має
валентність, що дорівнює нулю (на
валентному рівні немає неспарених
електронів):
озв’язання.
а) У нормальному стані атом Кальцію має
валентність, що дорівнює нулю (на
валентному рівні немає неспарених
електронів):
Са … 4s2 … B = 0.
4s
4р
4s
У сполуці СаН2
Кальцій двовалентний, тобто знаходиться
у збудженому стані:
сполуці СаН2
Кальцій двовалентний, тобто знаходиться
у збудженому стані:
Са* … 4s14p1 … B* = 2.
2s
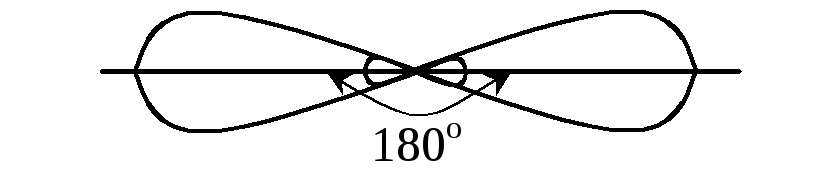
Отже, можна припустити, що відбувається sp-гібридизація атомних орбіталей центрального атома Кальцію.
Валентний електрон атома Гідрогену, який бере участь в утворенні хімічного зв’язку, знаходиться на s-атомній орбіталі, яка має форму кулі:
4р

 Са
Са
Н Н
Валентний
кут у молекулі СаН2
становить 180,
тому вона лінійна. Хоча молекула СаН2
має два ковалентні полярні зв’язки
СаН,
унаслідок лінійної та симетричної
будови вона є неполярною
![]() .
.
б) У нормальному стані атом Бору має валентність, що дорівнює одиниці:
2s
2р
5В 1s22s22p1 … B = 1.
У
сполуці BBr3
Бор т ривалентний,
отже, знаходиться у збудженому стані:
ривалентний,
отже, знаходиться у збудженому стані:
B* … 2s12p2 … B* = 3.
2s
2р
2s
2р
Оскільки
всі зв’язки в молекулі BBr3
рівноцінні, можна констатувати, що вона
має симетричну будову, а
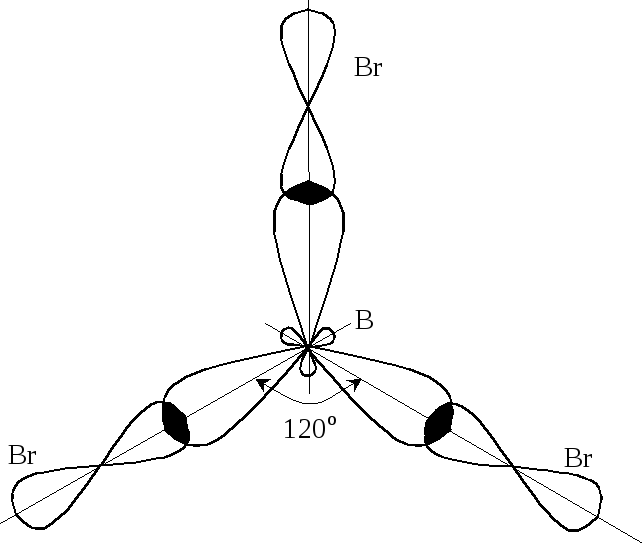 тип гібридизації атомних орбіталей
Бору
sp2
з
валентним кутом 120о.
тип гібридизації атомних орбіталей
Бору
sp2
з
валентним кутом 120о.
