
- •660025, Г. Красноярск, ул. Вавилова, 66 а
- •1.1.Распространение в природе и получение
- •1.2 Физические свойства
- •Химические свойства
- •Соединения s – металлов
- •1.6.Применение
- •Элементы іііа – группы
- •Распространение в природе и получение
- •Физические свойства
- •Химические свойства
- •Соединения металлов
- •2.1.4. Применение
- •Глава 3. Химия переходных металлов
- •В периоде с ростом z восстановительные свойства металлов уменьшаются, достигая минимума у элементов iв группы (табл.3.1.). Тяжелые металлы viiiв и iв групп за свою инертность названы благородными.
- •3.1. Элементы iв группы
- •Химические свойства
- •Применение
- •3.2. Элементы подгруппы II в
- •3.2.1.Распространение в природе и получение
- •3.2.2.Физические свойства
- •3.2.3. Химические свойства По химическим свойствам Zn и его аналоги менее активны, чем подгруппа Са. В ряду от Zn к Hg-химическая активность металлов уменьшается (см. Табл.3.3.).
- •3.2.4. Соединения металлов
- •3.2.5. Применение
- •3.3. Элементы подгруппы iiia
- •3.3.1. Способы получения
- •3.3.2.Физические и химические свойства
- •3.3.3. Соединения металлов
- •3.3.4. Применение
- •3.4. Элементы подгруппы ivb
- •3.4.1.Распространение в природе и получение
- •3.4.2.Физические свойства
- •3.4.3. Химические свойства
- •3.4.4. Соединения металлов
- •3.4.5. Применение
- •3.5. Элементы подгруппы vb
- •3.5.1.Распространение в природе и получение
- •3.5.1.Физические свойства
- •3.5.2. Химические свойства
- •3.5.4. Cоединения металлов
- •3.5.5.Применение
- •3.6. Элементы подгруппы viв
- •3.6.1. Распространение в природе и получение
- •В промышленности чистый хром получают из хромистого железняка:
- •Вольфрам, молибден получают из соответствующих оксидов, например:
- •3.6.2.Физические свойства
- •3.6.3. Химические свойства
- •3.6.4. Соединения металлов
- •3.6.5. Применение
- •3.8. Элементы подгруппы VII b
- •3.8.1. Распространение в природе и получение
- •3.8.2.Физические свойства
- •3.8.4. Химические свойства
- •3.8.5.Соединения металлов
- •3.8.6. Применение
- •3.9.2. Физические свойства
- •3.9.3. Химические свойства
- •3.9.4.Соединения металлов
- •3.9.5. Применение
- •3.9. Элементы VIII в группы (платиновые металлы)
- •3.9.1. Распространение в природе и получение
- •В виде соединений находятся в Си- Ni сульфидных рудах.
- •3.9.2. Физические свойства
- •3.9.3. Химические свойства
- •3.9.4.Соединения металлов
- •3.9.5.Применение
- •Глава 4. Лантаноиды и актиноиды
- •4.1. Электронные конфигурации атомов лантаноидов и актиноидов и их свойства.
- •4. 1.1.Монотонно изменяющиеся
- •4.1.2.Периодически изменяющиеся свойства
- •4.2.Распространение f - элементов в природе и получение
- •4.3.Разделение смеси соединений лантаноидов (актиноидов)
- •4.3.1.Ионообменная хроматография
- •4. 3.2.Жидкостная экстракция
- •4.3.3.Разделение по изменению степени окисления
- •4.4.Физические свойства
- •4.5.Химические свойства
- •4.6.Соединения f-металлов
- •4.7.Применение
1.6.Применение
Рассмотренные выше элементы и их соединения играют колоссальную роль в народном хозяйстве, составляя арсенал современной и грядущей техники. Элементы – Li, Mg, Be, Ca, Na, Sr, K, Cs – относятся к стратегически важным.
Литий и бериллий используются в термоядерной энергетике, бериллий – служит в качестве отражателя и замедлителя нейтронов.
Cs – в двигателях ракет; Be, Mg, и Li – при производстве специальных сплавов для авиаракетной и космической промышленности. Бериллиевая бронза сплав Cu – Be, содержащая около 25% Be, обладает твердостью стали и высокой коррозионной стойкостью. Из нее изготавливают пружины и другие упругие элементы приборов и устройств.
Производство лития в мире сильно выросло в последние годы в связи с тем ,что его добавка в криолит – глиноземный электролит алюминиевого производства повышает его электропроводимость и позволяет уменьшить удельный расход электроэнергии при производстве алюминия. Кроме того, литий стал широко использоваться в литиевых миниатюрных батарейках для электронных часов и радиоэлектроники.
S – металлы используются в металлургии для получения некоторых металлов (Ti, Zr, Nb, Ta) металлотермическим способом . из соединений щелочных металлов наиболее применение находят – NaCl (электролитическое получение NaOH и Cl2), NaHCO3 (пищевая промышленность), Na2CO3 (производство глинозема Al2O3, стекла, мыла), NaOH(получение глинозема, вискозы, очистка нефтепродуктов, гидрометаллургия многих металлов), Na2SO4(производство стекла), KNO3(производство удобрений, дымного пороха).
Бериллий, легко реагирующий со всеми газами, в электровакуумных приборах служит в качестве геттера – поглотителя газов.
BeO и MgO необходимы при производстве огнеупорных материалов, ими футируют (покрывают) стенки высокотемпературных печей.
Большинство солей бария (кроме BaSO4)относятся к сильно токсичным веществам, нервным и мышечным ядам. Очень токсичны соединения бериллия, обладающие канцерогенным действием.
Вопросы и упражнения
-
Как изменяются радиусы и потенциалы ионизации атомов щелочных металлов с ростом порядкового номера элементов? Дайте объяснение наблюдающимся закономерностям на основе электронного строения атомов.
-
Охарактеризуйте устойчивость оксидов S – металлов по величинам
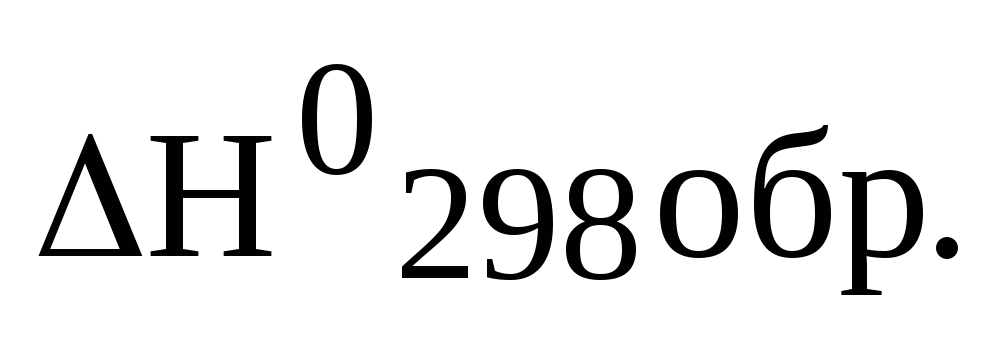 ,
кДж/моль
,
кДж/моль
MgO CaO SrO BaO
![]() ,кДж/моль
-601 -6,36 -604 -583
,кДж/моль
-601 -6,36 -604 -583
-
Рассмотрите расположение лития в электрохимическом ряду напряжений и в периодической системе. Объясните кажущуюся аномалию, учитывая, что Е0Li+/Li = -3,05В
-
Докажите диагональное сходство химических свойств атомов бериллия – алюминия, мотивируя уравнениями реакций.
-
Предложите все возможные способы переходов по следующей схеме: NaCl Na NaOH Na2SO3 NaHCO3 NaCl
-
К равным объемам 0,1М растворов солей Be, Mg и Ca в отдельных стаканах приливают избыток раствора NH4OH. Не прибегая к расчету, укажите, в каком из стаканов формульное количество (моль) осадка будет больше.
-
Растворимость Ca(OH)2 в воде при 180С составляет 8,21*10-2г в 100г воды. Вычислите ПР
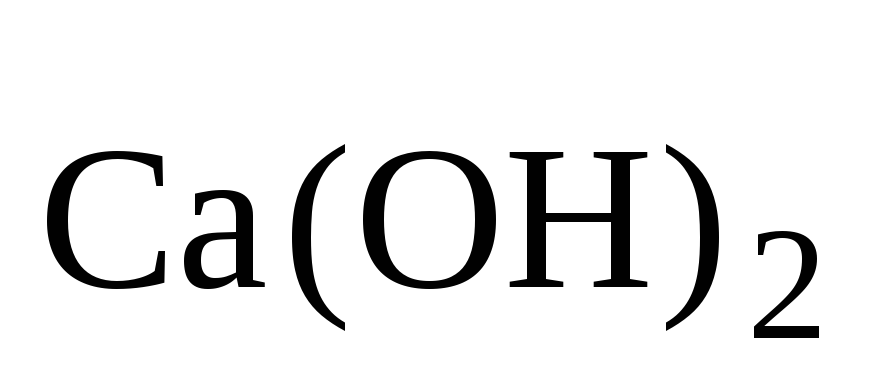 .
. -
Вычислите растворимость фторида бария в воде, если ПР
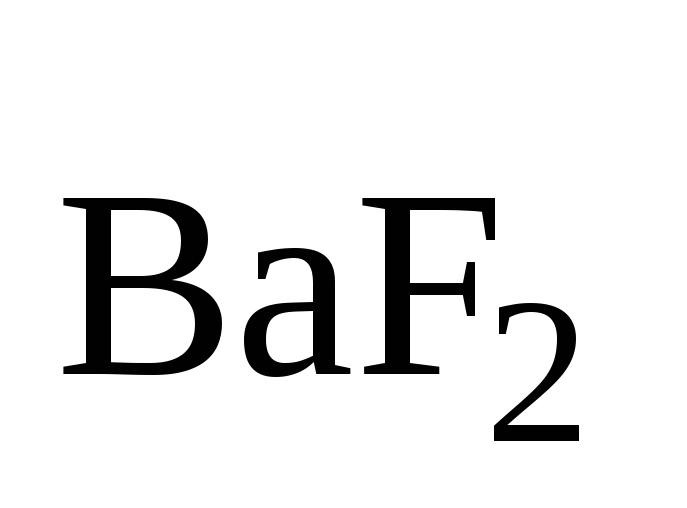 = 1,1*10-6.
= 1,1*10-6.
-
В какую сторону смещены равновесия следующих реакций:
BaCO3 + Na2SO4 = BaSO4 + Na2CO3
CaCO3 + Na2SO4 = CaSO4 + Na2CO3
Hапишите
уравнения сокращенным молекулярно-ионным
способом, учитывая значения ПР. (ПР![]() ;
ПР
;
ПР![]() ;
ПР
;
ПР![]() ;
ПР
;
ПР![]() ).
).
-
Напишите выражение констант равновесия для процессов:
2MgCl2(T) + O2(Г) 2MgO(T) + 2Cl2(Г)
LiH(T) + H2O(Г) LiOH(Ж) + Н2(Г)
-
Р – Металлы
Большая часть р – элементов относится к неметаллам. Металлические свойства сохраняются только у 9 элементов, причем элементы германий и сурьму можно лишь условно рассматривать как металлы, поскольку им характерны многие неметаллические свойства. Указанные р металлы имеют конфигурацию валентного слоя ns2 np1-3,, где n = 3 – 6.
 ІІІ
А – гр. ІVA - гр. VA
- гр.
ІІІ
А – гр. ІVA - гр. VA
- гр.
увеличение
n = 3 Al радиуса атомов
n = 4 Ga Ge уменьшение
энергии ионизации
n = 5 Jn Sn Sb
усиление металлических
n = 6 Tl Pb Bi свойств
s2p1 s2p2 s2p3

В периодах слева направо атомные и ионные радиусы р - металлов по мере увеличения заряда ядра уменьшаются, энергия ионизации возрастает, металлически свойства ослабевают. В группах радиусы атомов и однотипных ионов закономерно увеличиваются. Энергия ионизации при переходе к 6р – элементам уменьшается, т.к. по мере возрастания числа электронных слоев усиливается экранирование заряда ядер электронами, предшествующими внешним электронам. С увеличением порядкового номера р – элементов в группе неметаллические свойства ослабевают, а металлические усиливаются.
Р – металлы, как правило, проявляют переменную степень окисления, причем в четных группах она четная, а в нечетных – нечетная. Так, у атомов Sb и Bi +3 и +5. При переходе от 3А – к 5А – группе высшая степень окисления р – металлов становится менее устойчивой, что объясняется увеличением энергетического различия между s- и р- орбиталями внешнего слоя атома и, уменьшением возможности участия в образовании химической связи внешних s- электронов.
В подгруппах с ростом порядкового номера устойчивость высшей степени окисления уменьшается. Так, в 3А – подгруппе характерной степенью окисления атома Jn является +3, а атома Tl +1; в 4А - подгруппе у атома Sn +4, а у атома Pb +2; в 5А – подгруппе у атома Sb +5, у атома Bi +3. Это также связано с уменьшением возможности участия в образовании химической связи s – электронов.
В отличие от s-, d- и f- металлов, которые проявляют только восстановительные свойства, р- металлы могут являться и окислителями, т.е. проявляют свойства неметаллов. Так, атомы Ge, Sn и Pb имеют низшую степень окисления (-4), атомы Sb и Bi (-3). Устойчивость отрицательной степени окисления в группах сверху вниз уменьшается, поскольку металлические свойства элементов усиливаются.
Особенностью р- металлов является то, что различия в свойствах соседних элементов как внутри группы, так и по периоду выражены значительно сильнее, чем у s- элементов.
