
§ 5. Парадокс Гиббса
Вновь рассмотрим сосуд объемом V, разделенный перегородкой на две части, но пусть теперь они заполнены разными газами, находящимися в состоянии термодинамического равновесия, между которыми тоже существует термодинамическое равновесие, то есть температуры и давления в обеих частях сосуда одинаковы. Если убрать перегородку, происходит диффузия до нового равновесного состояния, в котором распределение молекул обоих газов равномерно, так как предполагается отсутствие внешних полей.
Рассчитаем изменение энтропии в этом процессе. Данный процесс можно рассматривать как расширение в пустоту каждого из двух газов, и изменение энтропии определить как сумму изменений энтропии в каждом из этой процессов:
![]() . (5.5.1)
. (5.5.1)
Очевидно, изменение энтропии в анализируемом процессе больше нуля. Состояние в сосуде с перегородкой более упорядоченное, по сравнению с конечным состоянием. Самостоятельно смесь не делится на две компоненты, то есть процесс необратим. Происходит уменьшение упорядоченности, увеличение беспорядка, при этом энтропия возрастает.
Д анный
опыт можно произвести и с одним газом
в обеих частях, при этом будет наблюдаться
самодиффузия. Как изменится энтропия
в этом случае? Объективных данных для
различия состояний при протекании
самодиффузии нет, следовательно, энтропия
в этом случае не изменяется (рис. 5.5.1).
анный
опыт можно произвести и с одним газом
в обеих частях, при этом будет наблюдаться
самодиффузия. Как изменится энтропия
в этом случае? Объективных данных для
различия состояний при протекании
самодиффузии нет, следовательно, энтропия
в этом случае не изменяется (рис. 5.5.1).
Таким
образом, возникает парадокс: при
самодиффузии энтропия не изменяется,
при взаимной диффузии - возрастает. Если
устремить массу молекулы первого газа
к массе молекулы второго, тогда при
непрерывном уменьшении разности масс
![]() ,
изменение энтропии осуществляется
скачком. Этот парадокс был сформулирован
Гиббсом, но просуществовал недолго.
Данный парадокс был разрешен квантовой
физикой. Параметры молекулы, как и любых
других квантовых объектов, отличаются
друг от друга на конечную величину.
Таким образом, парадокса нет, так как
непрерывное изменение параметров
молекул невозможно.
,
изменение энтропии осуществляется
скачком. Этот парадокс был сформулирован
Гиббсом, но просуществовал недолго.
Данный парадокс был разрешен квантовой
физикой. Параметры молекулы, как и любых
других квантовых объектов, отличаются
друг от друга на конечную величину.
Таким образом, парадокса нет, так как
непрерывное изменение параметров
молекул невозможно.
§ 6. Вероятностный смысл энтропии
В изолированной системе, как уже говорилось, энтропия возрастает, если происходящие в системе процессы являются необратимыми. С позиции статистической физики, процесс является обратимым, если вероятности осуществления прямого и обратного процессов соизмеримы. Если же обратный процесс маловероятен, то прямой процесс является необратимым. Примером такого процесса является расширение газа в пустоту (самопроизвольное сжатие газа маловероятно).
Вероятность
процесса будет тем выше, чем больше в
результате его существования возрастёт
вероятность
состояния системы
![]() (термодинамическая вероятность).
(термодинамическая вероятность).
Термодинамической
вероятностью системы
![]() называется число различных микросостояний
системы, реализующих данное макросостояние.
Число микросостояний, которое соответствует
некоторому молярному объёму газа
называется число различных микросостояний
системы, реализующих данное макросостояние.
Число микросостояний, которое соответствует
некоторому молярному объёму газа
![]() ,
может быть определено как Ni,
тогда термодинамическая вероятность
первого состояния определяется выражением
,
может быть определено как Ni,
тогда термодинамическая вероятность
первого состояния определяется выражением
![]() (5.6.1)
(5.6.1)
где
![]() – число микросостояний,
– число микросостояний,
![]() – число Авогадро (т.е. число атомов
находящихся в этих состояниях). Считая
газ не очень сжатым (т.е.
– число Авогадро (т.е. число атомов
находящихся в этих состояниях). Считая
газ не очень сжатым (т.е.
![]() »
»
![]() )
и пользуясь формулой Стирлинга
)
и пользуясь формулой Стирлинга
![]()
(5.6.2)
п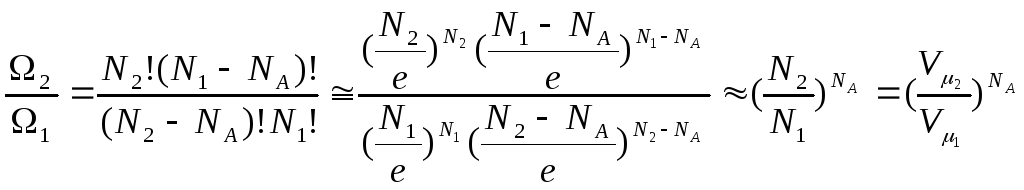 олучим
соотношение термодинамических
вероятностей для двух различных объёмов
газа
олучим
соотношение термодинамических
вероятностей для двух различных объёмов
газа
![]() и
и
![]() :
:
(5.6.3)
С
другой стороны, в соответствии с первым
началом термодинамики, разделим
соотношение
![]() на T
и получим
на T
и получим
![]()
(5.6.4)
Произведя замену
с учетом уравнения состояния идеального
газа
![]() ,
получим
,
получим
![]()
(5.6.5)
Для
обратимого изотермического процесса
![]() ,
и все изменения состояния обусловлены
изменением объёма. Тогда
,
и все изменения состояния обусловлены
изменением объёма. Тогда
![]() и
и
![]()
Но
![]() может быть рассчитан, исходя из
статистических соображений. Логарифмируя
соотношение (5.6.3), связывающее
может быть рассчитан, исходя из
статистических соображений. Логарифмируя
соотношение (5.6.3), связывающее
![]() и
и
![]() ,
получим
,
получим
![]() ,
или
,
или
![]()
Отсюда
![]()
(5.6.6)
Таким образом, энтропию можно определить (с точностью до константы) в виде
![]() . (5.6.7)
. (5.6.7)
Это
- формула Больцмана. Она связывает
энтропию с термодинамической вероятностью
системы. Чем выше вероятность состояния
системы, тем больше энтропия системы.
Т.к. в изолированной системе
![]() ,
т.е. S
возрастает (по крайней мере, не
уменьшается), то это означает, что
термодинамическая вероятность в такой
системе тоже растёт.
,
т.е. S
возрастает (по крайней мере, не
уменьшается), то это означает, что
термодинамическая вероятность в такой
системе тоже растёт.
Все процессы в изолированной системе протекают в сторону увеличения вероятности состояния системы.
Это статистическое толкование второго начала термодинамики.
Из статистики следует что, в относительно малых системах возможны флуктуации, которые могут приводить к кратковременному уменьшению энтропии. Таким образом, 2-е начало не содержит в себе абсолютного запрета убывания энтропии. Другое дело, что на практике для систем с очень большим числом частиц закон неубывания энтропии выполняется без исключений.
