
- •Задание к лабораторным работам Вариант 1
- •Задание к лабораторным работам Вариант 2
- •Задание к лабораторным работам Вариант 3
- •Задание к лабораторным работам Вариант 4
- •Задание к лабораторным работам Вариант 5
- •Задание к лабораторным работам Вариант 6
- •Задание к лабораторным работам Вариант 7
- •Задание к лабораторным работам Вариант 8
- •Задание к лабораторным работам Вариант 9
- •Задание к лабораторным работам Вариант 10
- •Задание к лабораторным работам Вариант 11
- •Задание к лабораторным работам Вариант 12
- •Задание к лабораторным работам Вариант 13
- •Задание к лабораторным работам Вариант 14
- •Задание к лабораторным работам Вариант 15
- •Задание к лабораторным работам Вариант 16
- •Задание к лабораторным работам Вариант 17
- •Задание к лабораторным работам Вариант 18
- •Задание к лабораторным работам Вариант 19
- •Задание к лабораторным работам Вариант 20
- •Задание к лабораторным работам Вариант 21
- •Задание к лабораторным работам Вариант 22
- •Задание к лабораторным работам Вариант 23
- •Задание к лабораторным работам Вариант 24
- •Задание к лабораторным работам Вариант 25
- •Задание к лабораторным работам Вариант 26
- •Задание к лабораторным работам Вариант 27
- •Задание к лабораторным работам Вариант 28
- •Задание к лабораторным работам Вариант 29
- •Задание к лабораторным работам Вариант 30
- •Задание к лабораторным работам Вариант 31
- •Задание к лабораторным работам Вариант 32
- •Задание к лабораторным работам Вариант 33
- •Задание к лабораторным работам Вариант 34
Задание к лабораторным работам Вариант 29
Лаб. раб. 1. Основные классы неорганических соединений
Назовите по систематической номенклатуре следующие вещества:P2O5, HPO3, Na2SiO3, K3PO4.
Рассчитать массу 0,7 м3 водорода при н.у.
Рассчитать температуру, при которой 52 г сероводорода Н2S под давлением 85315 Па займут объем 110 л.
Рассчитать объем аммиака при н.у., необходимый для нейтрализации 0,2 м3 газового выброса, содержащего 8% об. брома по реакции: 3Br2 + 8NH3
 N2
+ 6NH4Br
(н.у.).
N2
+ 6NH4Br
(н.у.).Смешали 4 моля вещества Б и 2 моль вещества А (А + 2Б
 3В). Рассчитать количества А, Б, В в
момент, когда прореагирует 20% Б.
3В). Рассчитать количества А, Б, В в
момент, когда прореагирует 20% Б.
Лаб. раб. 2. Определение энтальпии реакции
Рассчитайте ΔH
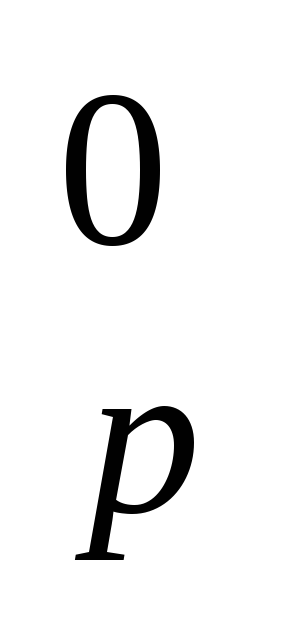 реакции: 2PH3(г)
+ 4O2(г)
↔ P2O5(к)
+ 3H2O(ж),
если
реакции: 2PH3(г)
+ 4O2(г)
↔ P2O5(к)
+ 3H2O(ж),
если
ΔH0обр, кДж/моль 5 0 -1492 -286
Рассчитайте энтальпию образования (ΔH
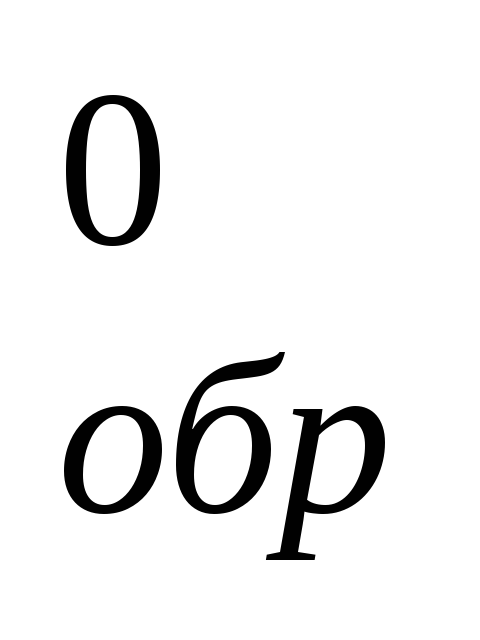 )
H2Se,
если при образовании 0,4 моль его
выделилось 31 кДж.
)
H2Se,
если при образовании 0,4 моль его
выделилось 31 кДж.Укажите знак ΔH0 в процессах: а) Na0 – e- → Na+; б) CH4 + 2O2 → CO2 + 2H2O; в) HCl(к) → HCl(ж).
Лаб. раб. 3. Скорость химических реакций. Химическое равновесие
Выразите математически скорости прямой и обратной реакций, протекающих в гомогенной системе:
C2H5OH ↔ C2H4 + H2O.
Выразите математически скорости прямой и обратной реакций, протекающих в гетерогенной системе:
CO2(г) + SO2(г) ↔ CS2(ж) + O2(г) .
Напишите формулу для вычисления константы равновесия реакции: NH3(г) + O2(г) ↔ NO(г) + H2O(г).
В каком направлении будет смещаться равновесие обратимой реакции: H2S + O2 ↔ H2O + SO2; ΔH<0 при понижении температуры?
Лаб. раб. 4. Растворы электролитов
Рассчитайте степень диссоциации муравьиной кислоты HCOOH в 0,01 М растворе, Кд = 2,0 ∙ 10-4.
Напишите молекулярные и ионные уравнения гидролиза солей: КHCO3, NH4Cl, KCl. Укажите характер (рН) среды в каждом растворе.
Определите рН водных растворов Н2S2О3 и Н2Те (КдI = 2,3 · 10-3), если их концентрация равна 0,02 моль/л.
Рассчитайте растворимость CuCO3 (в % масс.) при комнатной температуре, если ПР = 2,36 ∙ 10-10.
Лаб. раб. 5. Окислительно-восстановительные реакции
1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
B + NaOH + O2 → NaBO2 + H2O
Cr(NO3)3 → Cr2O3 + NO2 + O2
Fe2O3 + KNO3 + KOH → K2FeO4 + KNO2 + H2O
2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
монохлорид брома + вода → бром + бромноватая кислота + …
Лаб. раб. 6. Коррозия металлов и защита от коррозии
В каком из контактов: а) Cr/Zn; б) Ti/Cu; в) Bi/Co скорость коррозии меньше? Ответ подтвердите расчётами.
В контакте с каким из указанных металлов Fe остаётся неповреждённым: Co, Zn, Ni?
Составьте схему работы (катодный и анодный процессы) гальванопары Cr/Sn в кислой среде.
Задание к лабораторным работам Вариант 30
Лаб. раб. 1. Основные классы неорганических соединений
Назовите по систематической номенклатуре следующие вещества: S, CuS, H2SO3, NaHS.
Рассчитать массу 12 молей газа, если вес 10 л его при н.у. составляет 31,7 г.
Рассчитать молярную массу вещества, если 100 г его занимает объем 6,47 л при температуре 2000С и давлении 20 атм.
Рассчитать количество воды и углекислого газа, образующихся по реакции:
С2Н6
+ О2
![]() СО2
+ Н2О
СО2
+ Н2О
15 л 8 г х л у г
Определить массу натрия, которая прореагирует с 35 г 72 % водного этилового спирта С2Н5ОН.
Лаб. раб. 2. Определение энтальпии реакции
Рассчитайте ΔH
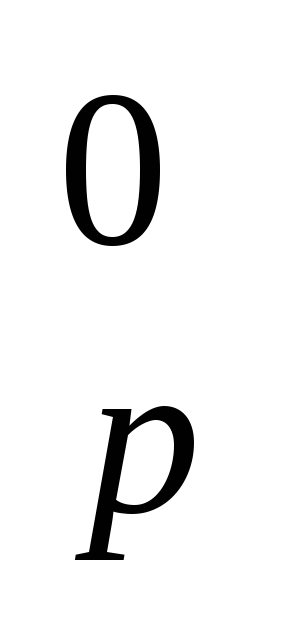 реакции: 3Fe2O3(к)
+ CO(г)
↔ 2Fe3O4(к)
+ CO2(г),
если
реакции: 3Fe2O3(к)
+ CO(г)
↔ 2Fe3O4(к)
+ CO2(г),
если
ΔH0обр, кДж/моль -325 -110 -1120 -394
Рассчитайте энтальпию образования (ΔH
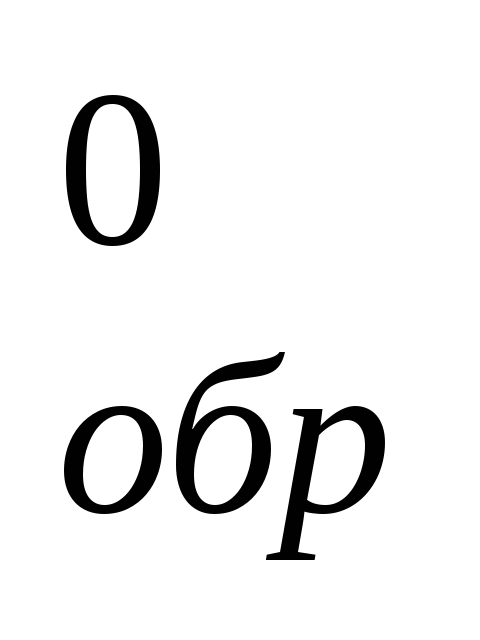 )
NH4NO3,
если при этом образовалось 20 г его и
выделилось 91,25 кДж.
)
NH4NO3,
если при этом образовалось 20 г его и
выделилось 91,25 кДж.Укажите знак ΔH0 в процессах: а) Na(ж) → Na(г); б) 2C2H2 + 5O2 → 4CO2 + 2H2O; в) 2Сl → Cl2.
Лаб. раб. 3. Скорость химических реакций. Химическое равновесие
Выразите математически скорости прямой и обратной реакций, протекающих в гомогенной системе:
SO3 ↔ SO2 + O2.
Выразите математически скорости прямой и обратной реакций, протекающих в гетерогенной системе:
NaCl(к) + H2(г) + Ti(к) ↔ TiCl4(к) + NaH(к).
Напишите формулу для вычисления константы равновесия реакции: CO(г) + H2(г) ↔ H2O(г) + C(к).
В каком направлении будет смещаться равновесие обратимой реакции: COCl2 ↔ CO + Cl2 при понижении давления?
Лаб. раб. 4. Растворы электролитов
Рассчитайте степень диссоциации борной кислоты H3BO3 в 0,1 М растворе, Кд = 5,8 ∙ 10-10.
Напишите молекулярные и ионные уравнения гидролиза солей: Na2SiO3, AlCl3, KClO2. Укажите характер (рН) среды в каждом растворе.
Определите рН водных растворов НВrО4 и Н3РО4 (КдI = 1,8 · 10-4), если их концентрация равна 0,02 моль/л.
Рассчитайте растворимость Fe(OH)2 (в % масс.) при комнатной температуре, если ПР = 1,65 ∙ 10-15.
Лаб. раб. 5. Окислительно-восстановительные реакции
1. Подберите коэффициенты методом электронного баланса в уравнениях реакций:
Br2 + SO2 + H2O → HBr + H2SO4
Cu + HNO3(p.) → Cu(NO3)2 + NO + H2O
PbO2 + HNO3 + H2O2 → Pb(NO3)2 + O2 + H2O
2. Составьте уравнение реакции и подберите коэффициенты методом электронного баланса:
этилен + кислород → диоксид углерода + …
Лаб. раб. 6. Коррозия металлов и защита от коррозии
В каком из контактов скорость коррозии меньше: а) Mg/Fe; б) Mg/Co; в) Mg/Pb? Ответ подтвердите расчетами.
В контакте с каким из указанных металлов Ni является катодом: Cd, Fe, Bi?
Составьте схему работы гальванопары (анодный и катодный процессы) Ni/Co в щелочной среде.
