
Ананьева О.А., Бурухин С.Б., Мачула А.А. и т.д
..pdfНаписать уравнение реакции взаимодействия брома со щелочью, учитывая, что при этом получаются соли бромоводородной и бромноватистой HBrO кислот. Указать, как изменяется степень окисления брома. Какие реакции называются реакциями диспропорционирования?
Б. В пробирку с несколькими каплями пероксида водорода H2O2 прибавить 2н раствор серной кислоты. Какой газ выделяется?
Составить схему реакции диспропорционирования пероксида водорода с образованием кислорода и воды. Подобрать коэффициенты методом полуреакций.
Опыт 5. Восстановительные свойства атомов в низшей степени окисления
В две пробирки внести по 2–3 капли бромной воды. В первую пробирку добавить несколько капель Na2S, во вторую – 25-про- центного раствора аммиака. Что происходит с окраской растворов?
Написать уравнения реакций, учитывая, что одним из продуктов взаимодействия брома с сульфидом натрия является сера, а во втором случае из аммиака образуется азот. Какие свойства в протекавших окислительно-восстановительных реакциях проявляли сера (II) и азот (III)? Могут ли они являться окислителями в химических реакциях?
Контрольные вопросы и упражнения
1. Какие из реакций являются окислительно-восстановительными:
а) Zn + H2SО4 = ZnSО4 + Н2;
б) 3Zn + 4Н2SO4 = 3ZnSO4 + S + 4Н2O;
в) Zn (ОН)2 + H2SO4 = ZnSO4 + 2H2O;
г) Zn (ОН)2 + 2NaOH = Na2 [Zn(OH)4].
2. К какому типу окислительно-восстановительных реакций относится каждый приведенный пример:
а) Nа3АsО3 + I2 + H2O= Na3AsO4 + 2HI;
б) Cl2 + 2NaOH = NaCl+ NaClO + H2O;
в) 2AgNO3 = 2Ag + 2NO2 + O2.
3. Какие из веществ могут проявлять как окислительные, так и восстановительные свойства: КМnO4, МnО2, Na2SO3, V2O5, KI, HNO2?
41
4. По приведенной электронно-ионной схеме составить уравнение
окислительно-восстановительной реакции в молекулярной форме: 10Fe2+ – 10е- =10Fe3+;
2MnO-4 + 10е- + 16H+ = 2Mn2+ + 8H2O.
5. Какой из окислителей является наиболее сильным: МnО2,
PbO2, K2Cr2O7?
6. В каком направлении будет протекать реакция:
2КСгO2 + ЗВг2 + 8КОН ↔ 2KCrO4 + 6KBr + 4Н2О.
7. Дописать уравнения реакций и подобрать коэффициенты:
а) КМnO4 + Zn + H2SO4 = б) Cl2+ I2 + Н2O =
в) K2Cr2O7 + H2SO4 + FeSO4=
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Лабораторная работа
Цель работы
Ознакомление со свойствами комплексных; получение комплексов различного типа; изучение устойчивости комплексных соединений с помощью качественных реакций.
Оборудование и реактивы
Пробирки конические. Растворы: сульфата меди (0,1М), сульфата цинка (0,1М), сульфата кадмия (0,1М), хлорида бария (0,1 М), сульфата алюминия (0,1М), сульфата хрома (0,1М), соли Мора (0,1М), сульфата никеля (0,1М), соляной кислоты (конц.), аммиака (25-про- центный, 0,1М), гексацианоферрата (II) калия(0,5н), сульфид натрия.
Опыт 1. Получение и исследование комплексного соединения сульфата тетраамминомеди (II)
Поместить в две пробирки по 10 капель 1н раствора сульфата меди и добавить, в одну из них 2 капли хлорида бария. На присутствие какого иона указывает выпавший осадок? Во вторую пробирку внести кусочек гранулированного олова и наблюдать выделение на его поверхности красноватого налета меди.
Получить комплексное соединение меди, для чего поместить в пробирку 10–15 капель раствора сульфата меди и по каплям добавлять гидроксид аммония NH4OH. Наблюдать растворение выпав-
42
шего вначале осадка основного сульфата меди [CuOH]2SO4 и изменение цвета раствора при образовании комплексного сульфата тетраамминомеди (II) [Cu(NH3)4]SO4. Полученный раствор разделить в две пробирки и провести те же два опыта, которые были проделаны с раствором медного купороса. Выпадает ли осадок при добавлении хлорида бария? Выделяется ли медь на грануле олова?
Написать уравнения всех проведенных реакций. Есть ли различие в поведении сульфата меди и комплексной соли по отношению к каждому добавленному реактиву? Написать уравнение электролитической диссоциации сульфата тетраамминомеди (II).
Опыт 2. Анионные и катионные комплексы
А. Гидроксокомплексы В три пробирки поместить раздельно растворы солей цинка,
хрома (III) и алюминия. В каждую из них добавлять по каплям раствор щелочи. Наблюдать вначале выпадение осадков, а затем их растворение в избытке щелочи. Написать уравнение реакции обра-
зования растворимых гидроксокомплексов, содержащих ионы
[Zn(OH)4]2-, [Сr(OH)6]3-, [Аl(OH)6]3-.
Б. Комплексное основание никеля
Получить осадок гидроксида никеля (II), внеся в пробирку 3–4 капли раствора сульфата никеля и такой же объем раствора едкого натра. Полоской фильтровальной бумаги удалить жидкую фазу.
К осадку добавить 5–6 капель конц. раствора гидроксида аммония. Что происходит? Сравнить окраску ионов Ni2+ в растворе сульфата никеля с окраской полученного раствора.
Присутствием каких ионов обусловлена окраска раствора? Написать уравнения реакций: образования гидроксида никеля
(II), взаимодействия гидроксида никеля с аммиаком и уравнение электролитической диссоциации образовавшегося комплексного основания (координационное число никеля принять равным шести). Какое основание является более сильным: простое или комплексное? Ответ обосновать.
Опыт 3. Комплексные соединения в реакциях обмена
А. В пробирку к 4–5 каплям раствора сульфата меди добавить такой же объем раствора комплексной соли K4lFe(CN)6]. Отметить
43
цвет образовавшегося осадка гексацианоферрата меди. Написать молекулярное и ионное уравнения реакции.
Б. Получить раствор тетрамминомеди (II) (см. опыт 1), прибавить к полученному раствору 3–5 капель Na2S. Написать уравнение реакции и объяснить выпадение черного осадка, учитывая, что ПРCuS = 8,5 × 10 – 45.
Контрольные вопросы и упражнения
1. Определить степень окисления и координационное число комплексообразователя в следующих соединениях:
K2[PtCl4], [Со(NН3)3С13], [Ti(H2O)4Br2]Br,
K2[Pt(C2O4)Cl2].
2. Представить координационные формулы следующих соединений:
КС1 • АuСl3, 2NH4C1 • PtCl4, Na2C2O4 • СuС2O4, PtCl2 • 4NН3. 3. По Кнест оценить устойчивость комплексных ионов:
[Mg(NH3)6]2+,[Cu(NH3)4]2+, [Ag(NH3)2]+, [Co(NH3)6]2+.
ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ ПРОЦЕССОВ Лабораторная работа
Цель работы
Определение с помощью простейшего калориметра теплоты реакции нейтрализации сильного основания сильной кислотой и теплоты растворения солей.
Описание исследуемых процессов
Согласно теории электролитической диссоциации, реакция между растворами сильной кислоты и сильного основания, например, HCl(p) + NaOH(р) → NaCl(р) +H2O ,
не зависимо от того, какие кислоты или основания были взяты, может быть представлена в виде
Н++ ОН- → Н2О + 569 кДж.
Таким образом, в основе этих реакций лежит одно и то же термохимическое уравнение.
Растворение кристаллических солей представляет сложное фи- зико-химическое явление. При растворении кристаллической соли
44
протекают два основных процесса: первый – эндотермический, связанный с разрушением кристаллической решетки; второй – экзотермический, обусловленный взаимодействием растворенного вещества с молекулами растворителя с образованием гидратированных ионов. В зависимости от того, какой из двух тепловых процессов преобладает, тепловой эффект растворения может быть положительной или отрицательной величиной.
Расчет теплоты из экспериментальных данных
Расчет теплоты, поглощающейся или выделяющейся в калориметре, в данной работе проводим, исходя из следующих допущений:
1)считаем, что тепловой эффект проявляется только в изменении температуры раствора и стекла конической колбы – реактора;
2)пренебрегаем относительно небольшими потерями тепла в окружающую среду;
3)принимаем теплоемкость раствора равной теплоемкости воды. С учетом сделанных допущений выделяющуюся или поглощае-
мую в калориметре теплоту вычисляем по формуле q = (cР mР + cс mс) ∆T,
где сР = 4,184 кДж/(кг К); сс = 0,75 кДж/(кг К) – удельные теплоемкости раствора и стекла; mР и mс – массы раствора и стеклянной колбы-реактора; ∆Т – изменение температуры калориметра в ходе процесса.
Таким образом, задача калориметрического эксперимента сводится к точному определению изменения температуры калориметра ∆T, обусловленному тепловым эффектом.
Оборудование и реактивы
Калориметр, термометр с точностью не хуже 0,1о С, весы с точностью измерения 0,01 г; мерный цилиндр на 100 мл, ареометр.
Реактивы
1М НС1; 1М НNO3; 1М NaOH; 1М КОН; CuSO4 (безводный); CuSO4 5H2O (кристаллогидрат).
Опыт 1. Определение теплового эффекта реакции нейтрализации сильного основания сильной кислотой
В сухую коническую колбу с известной массой с помощью мерного цилиндра залейте 150 мл 1М раствора соляной кислоты и по-
45
местите ее в стакан, внутри которого размещены теплоизолирующие прокладки из пенопласта. Закройте калориметр крышкой с отверстием для термометра.
Налейте в мерный цилиндр 50 мл 3М раствора NaOH и измерьте его температуру. Необходимо, чтобы температуры исходных растворов были одинаковы.
Каждый калориметрический опыт начинают с определения температурного хода калориметрической системы. Для этого в течение нескольких минут измеряют температуру калориметра. Показание термометра фиксируют через каждую минуту. Если в течение 5 мин. изменения температуры невелики и равномерны (эти изменения составляют начальный период опыта), то в определенный момент отсчета вылейте в калориметр через воронку приготовленный раствор щелочи. Перемешайте растворы. С момента сливания растворов начинается главный период опыта. За счет теплового эффекта протекающей химической реакции происходит резкое изменение температуры. По окончании реакции нейтрализации температурный ход в калориметре станет снова равномерным. Момент наступления равномерного хода t° в калориметре является концом главного и началом конечного периода.
В конечном периоде в течение 5 мин. температурные отсчеты проводятся через минуту, как и в начальном периоде.
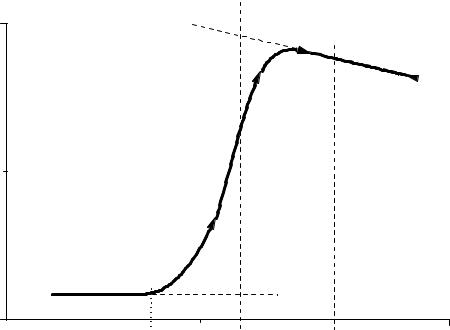
Результаты температурных измерений изображаются в виде графика на миллиметровой бумаге. На рисунке проводится график изменения температуры в реакции нейтрализации. Здесь линии АВ, ВС и СD соответствуют начальному, главному и конечному периодам реакции. Наличие температурного хода линии СD свидетельствуют об имеющем место теплообмене калориметра с окружающей средой. В расчетах максимальной температуры раствора теплообмен учитывается следующим образом. Прямая АВ экстраполируется вправо, а прямая СD – влево. Интервал времени ВС делится пополам и из точки М1 проводится перпендикуляр к оси абсцисс. Отрезок HCT соответствует изменению температуры калориметра ∆Т, вызванному протеканием химического процесса с поправкой на теплообмен.
46
Для расчетов потребуется также значение массы раствора, находящегося в калориметре, которую можно определить либо путем взвешивания, либо из выражения mР = Vρ, где V = 200 мл, а значение ρ можно измерить с помощью ареометра или принять равным –
1 г/мл.
По указанию преподавателя процедуру определения ∆Т можно упростить.
1.Измерьте температуру раствора кислоты в колбе – Тк .
2.Измерьте температуру раствора щелочи в цилиндре – Тщ.
3.Начальную температуру раствора после смешения рассчитайте по формуле
|
Т1 = (Тк 150 + Тщ 50) / 200. |
|
||
0 |
|
CT |
C |
|
|
|
|
||
t ,C |
|
|
|
D |
|
|
|
|
|
A |
B |
H |
|
|
|
|
M1 |
|
τ, мин |
|
|
|
|
|
4.Залейте раствор щелочи в колбу-калориметр. Сразу же после смешения закройте колбу крышкой с термометром. Энергично взбалтывая полученный раствор следите за его температурой. Отметьте максимальную температуру Т2.
5.Рассчитайте ∆Т = Т2 – Т1.
Результаты выполненных измерений запишите в таблицу.
47
№ |
Масса кол- |
Масса |
Начальная |
Изменение |
Использо- |
|
опы- |
бы-кало- |
раствора |
температура |
температу- |
ванная |
|
та |
риметра, |
в колбе, |
раствора |
ры калори- |
кислота |
|
|
mс, г |
mр, г |
|
|
метра ∆Т |
|
|
|
|
|
|
|
|
|
|
|
кисло- |
осно- |
|
|
|
|
|
та |
вание |
|
|
На основании полученных данных определить:
1)количество теплоты [кДж], выделившееся при протекании реакции нейтрализации;
2)число молей образовавшейся в ходе реакции воды (рассчитать из значений концентрации щелочи или кислоты и уравнения химической реакции);
3)рассчитать тепловой эффект реакции нейтрализации
(кДж/моль Н2О) и составить термохимическое уравнение изучаемой реакции;
4)сравнить значения тепловых эффектов нейтрализации 1М раствора НС1 и 1М раствора HNO3; cделать вывод.
Опыт 2. Определение тепловых эффектов растворения солей
Опыт проводится в той же калориметрической установке и по той же методике, которая описана в опыте 1. В колбу налейте 200 мл дистиллированной воды и снимите начальный температурный ход калориметра. Взвесьте 5 г безводной соли с точностью до 0,01 г. Быстро внесите навеску в колбу. При постоянном взбалтывании раствора следите за показаниями термометра. Температурные измерения представьте графически и рассчитайте значения ∆Т.
Результаты опыта запишите в таблицу.
№ |
Масса |
Масса |
Масса |
Масса |
Изменения |
∆ |
опыта |
колбы |
соли |
воды |
раствора |
температуры |
Т |
|
||||||
|
m1, г |
|
|
|
Т1 |
|
|
|
|
|
|
|
|
Опыт повторите с кристаллогидратом соли, взяв навеску 8 г. По данным проведенного эксперимента
1)рассчитать теплоту растворения безводной соли, кДж/моль;
2)рассчитать теплоту растворения кристаллогидрата, кДж/моль;
48
3) используя закон Гесса, по найденным теплотам растворения безводной соли и ее кристаллогидрата, рассчитать теплоту гидратации безводной соли и составить термохимические уравнения этой реакции
CuSO4(кр.) + 5H2O(ж.) = CuSO4 5H2O (кр.) + Q1. (1)
При этом следует иметь в виду, что процесс растворения безводного сульфата меди может быть представлен в виде двух последовательно протекающих процессов: процесса (1) и
CuSO4 5H2O(кр.) = CuSO4(p) + 5H2O + Q2 (2)
или в виде одного суммарного уравнения
CuSO4(кр.) = CuSO4(p) + Q3 ,
где Q2 и Q3 – теплоты растворения кристаллогидрата и безводной соли. Учитывая, что начальное и конечное состояния в обоих случаях одинаковы, на основаниизаконаГесса, Q3=Q1 + Q2, откуда Q1=Q3 – Q2.
Контрольные вопросы
1.Рассчитайте стандартную теплоту образования диоксида азота
NO2(г), если стандартный тепловой эффект реакции 2 NO2(г) ↔ N2O4 (г), при 298К равен – 58,4 кДж/моль, а стандартная теплота образования N2O4(г) равна 9,4 кДж/моль.
2.Установите возможность (или невозможность) самопроиз-
вольного протекания реакции СО(г) + 1/2 О2 = СО2(г) при 298К и 1атм. Ответ подтвердите расчетом.
3.Теплоты образования воды и водяного пара равны соответст-
венно 285,8 и 241,8 кДж/моль. Рассчитайте теплоту испарения воды при 25оС.
ЖЕСТКОСТЬ ВОДЫ Введение
Абсолютно чистой воды в природе не бывает. При взаимодействии воды с атмосферой и почвой в ней растворяются органические и неорганические соединения. Особое значение имеют присутствующие в воде многозарядные катионы Ca2+ и Mg2+. Если концентрация этих ионов велика, то воду называют жесткой, если мала – мягкой. Жесткость воды подразделяют на карбонатную и некарбонатную.
Карбонатной называют жесткость, обусловленную присутствием в воде гидрокарбонатов кальция и магния Ca(HCO3)2 и
49
Mg(HCO3)2. При повышении температуры, особенно при кипячении, эти соли разлагаются с образованием малорастворимых карбоната кальция и гидроксида магния и жесткость устраняется:
t0
Ca(HCO3)2 → CaCO3↓+H2O+CO2↑,
t0
Mg(HCO3) → Mg(OH)2↓ +2CO2↑.
Поэтому карбонатную жесткость еще называют временной. Некарбонатная жесткость определяется содержанием в воде
сульфатов и хлоридов кальция и магния. При кипячении эти соли не удаляются из воды. Поэтому некарбонатную жесткость еще называют постоянной. Сумма постоянной и временной жесткости дает общую жесткость воды.
Жесткость характеризуют числом милли моль эквивалентов со-
лей Са2+ и Mg2+ в 1л воды. Жкарб. – карбонатная жесткость воды, определяется количеством ммоль эквивалентов анионов НСО3- в 1л
воды: Жкарб.= СN(НСО3) 103, мэкв/л. Жобщ. – общая жесткость воды, определяется количеством ммоль эквивалентов катионов Ca2+, Mg2+
в 1л воды: Жобщ.= [СN(Са2+)+СN(Mg2+)] 103, мэкв/л.
Жнекарб.=Жобщ. – Жкарб.
Жесткая вода непригодна в качестве теплоносителя на энергообъектах, ее вкусовые качества невелики, стирка в жесткой воде возможна только при повышенном расходе моющих средств. Поэтому воду умягчают, т.е. снижают содержание ионов Ca2+ и Mg2+.
Один из простейших способов устранения жесткости – кипячение (см. выше уравнения протекающих при этом реакций). В этом случае из воды удаляются лишь гидрокарбонаты. Химические способы устранения жесткости – известкование (добавление в воду гашеной извести Ca(OH)2) и содирование (добавление кальцинированной соды Na2CO3). Современными методами умягчения воды являются дистилляция (испарение воды с образованием концентрированных растворов солей), обратный осмос (молекулярное фильтрование) и ионный обмен (сорбция ионов Са2+ и Mg2+ полимерными смолами, сопровождающаяся поступлением в воду эквивалентных количеств других катионов, например, H+). Определение карбонатной жесткости основано на реакции:
HCO3- + H+ → H2O + CO2 (Н2СО3).
50
