
Презентации 2 Еремин
.pdf

План лекции
1.Понятия окисления и восстановления.
2.Типичные восстановители и окислители.
3.Метод электронно-ионного баланса.
4.Окислительно-восстановительные потенциалы.
5.Уравнение Нернста.
6.Связь ЭДС с термодинамическими свойствами.
7.Диаграммы Латимера.
8.Химические источники тока.
9.Электролиз.
Физтех, 1 курс. Осень 2015 |
|
2 |
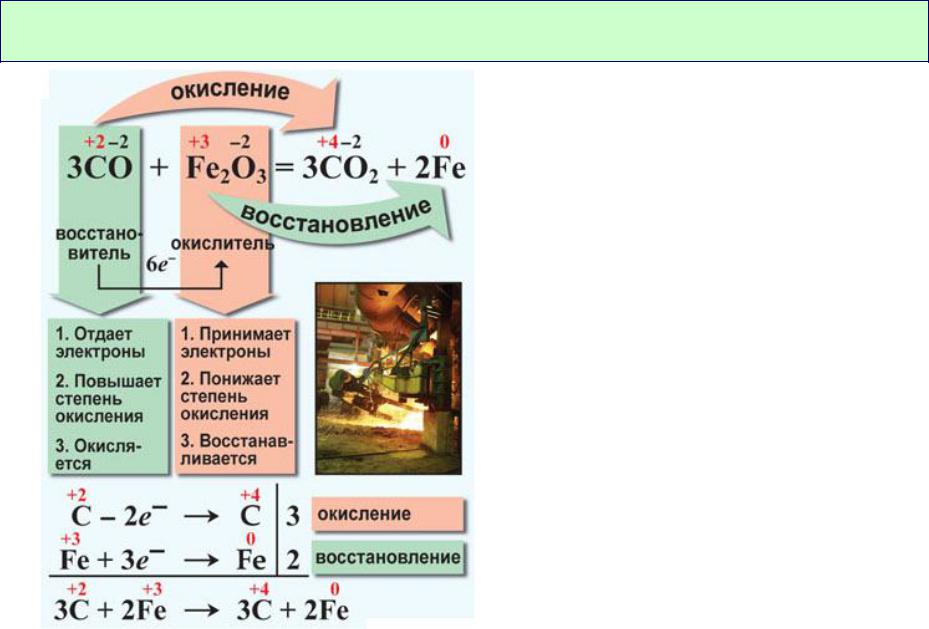
Окислительно-восстановительные реакции
|
|
Окисли- |
Полуреакция |
|
|
|
|
тель |
восстановления |
|
|
|
|
Hal2 |
Hal2 + 2e 2Hal– |
|
|
|
|
O2 |
O2 + 4H+ + 4e 2H2O |
|
|
|
|
H2SO4 |
SO42– + 4H+ + 4e |
|
|
|
|
SO2 + 2H2O |
|
||
|
|
|
|
||
|
|
HNO3 |
NO3– + 4H+ + 3e |
|
|
|
|
NO + 2H2O |
|
||
|
|
|
|
||
|
|
KMnO4 |
MnO4– + 8H+ + 5e |
|
|
|
|
Mn2+ + 4H2O |
|
||
|
|
|
|
||
|
|
K2Cr2O7 |
Cr2O72– + 14H+ + 6e |
|
|
|
|
2Cr3+ + 7H2O |
|
||
|
|
|
|
||
|
|
|
|
|
|
Физтех, 1 курс. Осень 2015 |
|
|
|
3 |
|

Окислитель и восстановитель
Окислитель принимает e, понижает ст.ок.
восстановитель отдает e, повышает ст.ок.
|
|
2 | 2Fe3+ + 6e 2Fe0, |
Fe O |
3 |
– окислитель |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
3 | C0 – 4e C+4, |
C – восстановитель |
|
|
|
|||
|
|
------------------------------------ |
|
|
|
|
|
||
|
|
2Fe2O3 + 3C = 4Fe + 3CO2 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
1 | C+2 + 4e C–2, |
CO – окислитель |
|
|
|
|||
|
|
2 | 2H0 – 2e 2H+1, |
H – восстановитель |
|
|
|
|||
|
------------------------------- |
2 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
CO + 2H2 = CH3OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Физтех, 1 курс. Осень 2015 |
|
|
|
|
5 |
||||
Важнейшие окислители
Кислород O2
Озон O3
Галогены F2 > Cl2 > Br2 > I2
Пероксиды H2O2, KO2
Азотная кислота HNO3
Серная кислота(конц.) H2SO4
Хлорная кислота HClO4
Царская водка: смесь HNO3(конц.) и HCl(конц.) в соотношении
1:3 об.
Оксид марганца (IV) MnO2
Перманганат калия KMnO4
Дихромат калия K2Cr2O7
Фториды благородных газов XeF6
Физтех, 1 курс. Осень 2015 |
|
6 |

Важнейшие восстановители
Углерод: C
Оксид углерода (II): CO
Водород: H2
Водород в момент выделения, [H]: Zn + HCl, Al + NaOH
Активные металлы: Na, Ca, Al
Сероводород и растворимые сульфиды: H2S, Na2S
Гидриды металлов: NaH, CaH2, Li[AlH4]
Соединения, содержащие неметаллы в отрицательных степенях окисления: HI, PH3.
Аммиачные растворы щелочных и щелочноземельных металлов
Физтех, 1 курс. Осень 2015 |
|
7 |

Подбор коэффициентов: Метод электронно-ионного баланса
Уравниваем кислород в полуреакциях, используя ионы H+ и воду:
MnO4– + 8H+ Mn2+ + 4H2O |
Избыточные атомы кислорода |
|
окислителя связываются в воду |
||
|
|
Недостающие атомы кислорода |
SO32– + H2O SO42– + 2H+ |
|
|
|
восстановителя берутся из воды |
|
Уравниваем заряды, добавляя или отнимая нужное число электронов:
2 MnO4– + 8H+ + 5e = Mn2+ + 4H2O
5 SO32– + H2O – 2e = SO42– + 2H+
5SO32– + 2MnO4– + 6H+ = 5SO42– + 2Mn2+ + 3H2O
Окончательно в молекулярном виде
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 +K2SO4 + 3H2O
Физтех, 1 курс. Осень 2015 |
|
9 |
Кислородный баланс (для органических реакций)
CH3CH=CHCH3 + KMnO4 + H2SO4 CH3COOH + …
8 e
C4H8 + 4[O] 2C2H4O2
C6H5CH2CH3 + KMnO4 + H2SO4 C6H5COOH + CO2 + …
12 e
C8H10 + 6[O] C7H6O2 + CO2 + 2H2O
Физтех, 1 курс. Осень 2015 |
|
10 |
