
01 - Теплотехника, курс лекций, часть 1, ТД
.pdf
Vсм |
Vсм |
Vсм |
pсм |
p1 |
p2 |
До разделения |
После разделения |
рис. 1.5
Парциальные давления
V1
Vсм |
pсм |
pсм 
V2
pсм
До разделения |
После разделения |
рис. 1.6
Парциальные объемы
Молярный состав смеси определяется молярными долями. Количество вещества каждого компонента
M i = |
mi |
. |
|
(1.18) |
|||||||
|
|
||||||||||
|
|
|
|
µ |
|
|
|
|
|
||
|
|
|
|
|
|
i |
|
|
|
|
|
Количество вещества смеси |
|
|
|
|
|
|
|
|
|
|
|
M см = ∑Mi . |
|
(1.19) |
|||||||||
Молярные доли |
|
|
|
M i |
|
|
|
||||
yi = |
|
. |
|
(1.20) |
|||||||
|
|
|
|
||||||||
|
|
|
M см |
|
|
||||||
|
∑yi |
=1. |
|
(1.21) |
|||||||
Молярная масса смеси |
|
mсм |
|
|
|
|
∑mi |
|
|
||
µсм = |
|
|
= |
|
. |
(1.22) |
|||||
|
M см |
|
∑Mi |
||||||||
|
|
|
|
|
|
|
|||||

Это так называемая кажущаяся, или условная, молярная масса смеси. Она используется для определения газовой постоянной газовой смеси
R |
= |
µR |
= |
8314 . |
(1.23) |
||
µ |
|
||||||
см |
|
см |
|
µ |
см |
||
|
|
|
|
|
|
||
Часто задается объемный состав смеси. В этом случае используются объемные доли. Пусть имеется смесь из двух компонентов. Если молекулы одного газа собрать в одной части объема, а молекулы другого газа – в другой, то уменьшение объема, занимаемого компонентом, при T = const вызывает увеличение давления
p = Vm RT; V ↓ p ↑.
Подбирая соответствующим образом доли от общего объема, можно добиться того, что каждый газ (компонент) достигнет давления смеси. Объемы Vi, которые занимают эти газы, называются приведенными, или парциальными
(см. рис. 1.6).
При этом
Vсм = ∑Vi . |
(1.24) |
|||
Объемные доли |
Vi |
|
|
|
r = |
. |
(1.25) |
||
|
||||
i |
Vсм |
|||
|
|
|||
До разделения газов
piV = mRiT ;
после разделения газов (при T = const)
pVi = mRiT ,
откуда
piV = pVi ,
или |
|
Vi |
|
|
|
|
|
|
pi |
= |
|
p = ri p . |
(1.26) |
||||
V |
||||||||
|
|
|
|
|
|
|||
Пусть Vµ – молярный объем, м3/кмоль, или объем, занимаемый 1 кмоль |
||||||||
газа. |
|
|
|
|
Vi |
|
|
|
|
V = |
|
. |
(1.27) |
||||
|
|
|
||||||
|
µ |
|
|
M i |
||||
На основании закона Авогадро при p = const и T = const различные газы имеют одинаковый молярный объем. Тогда,
Vµ = Vi = Vсм , M i M см
откуда

Vi = Mi ,
Vсм M см
или
yi = ri . |
(1.28) |
Другие полезные соотношения:
|
gi |
= |
µi ri |
; |
|
|
(1.29) |
|
|
|
|
||||||
|
|
|
∑µi ri |
|
|
|||
r |
= |
|
gi µi |
|
|
; |
(1.30) |
|
∑(gi µi ) |
||||||||
i |
|
|||||||
|
R = ∑gi Ri . |
|
(1.31) |
|||||
1.5.Теплоемкость
Полная теплоемкость тела – это количество теплоты, поглощенное телом в определенном термодинамическом процессе, при изменении его температуры на один градус:
C = |
∆Q |
. |
(1.32) |
|
|||
|
∆T |
|
|
Так как при разной температуре это поглощаемое количество теплоты в общем случае неодинаково, то полная теплоемкость тела представляет собой производную от количества теплоты, поглощенного телом в определенном термодинамическом процессе, по его температуре:
C = dQ . |
(1.33) |
dT |
|
Единица измерения в системе СИ – Дж/К или Дж/°С.
В технических и научных расчетах чаще используется удельная массовая теплоемкость (на 1 кг вещества):
c = |
dC |
= |
d 2Q |
. |
(1.34) |
|
dm |
dTdm |
|||||
|
|
|
|
Если количество теплоты, приходящееся на 1 кг массы, обозначить через q, то:
c = dq |
, |
(1.35) |
dT |
|
|
где |
|
|
q = dQ . |
(1.36) |
|
dm |
|
|
Единица измерения в системе СИ – Дж/(кг К) или Дж/(кг°С).
Так как T = t + 273,15 , то ∆T = ∆t или dT = dt , поэтому для теплоемкости Дж/(кг К) = Дж/(кг°С).
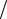
Для твердых тел и для жидкостей теплоемкость не зависит от вида процесса. Для газов, наоборот, теплоемкость зависит от процесса.
Теплоемкость в процессе при постоянном объеме (V = const) называется изохорной:
c |
|
|
∂q |
. |
|
|
v |
= |
|
|
(1.37) |
||
|
||||||
|
|
∂T |
|
|||
|
|
|
|
V =const |
|
|
Теплоемкость в процессе при постоянном давлении (p = const) называется изобарной:
|
∂q |
|
|
|||
c p = |
|
|
|
. |
(1.38) |
|
|
|
|||||
|
∂T p=const |
|
||||
Для газов удельные изохорная и изобарная теплоемкости связаны |
||||||
соотношениями: |
|
|
|
|
|
|
c p −cv = R . |
(1.39) |
|||||
|
cp |
= k |
, |
(1.40) |
||
|
|
|
||||
cv
где k – показатель адиабаты (см. раздел 1.8). Для воздуха k ≈ 1,4.
Для твердых тел и для жидкостей теплоемкость зависит от температуры (зависимостью от давления можно пренебречь). Для газов cp и cv зависят и от давления, и от температуры:
c p = f (p,T ); cv = f (p,T ).
1.6.Первый закон термодинамики
Теплота, подводимая к системе, идет на увеличение внутренней энергии
системы и на совершение системой работы: |
|
Q = ∆U + L , |
(1.41) |
или |
|
∆U = Q − L . |
(1.42) |
В термодинамике элементарную работу, совершаемую газом при изменении объема (работу сил давления), называют деформационной работой.
|
+ |
δp |
f dx , |
(1.43) |
||
dL = p |
2 |
|
||||
|
|
|
|
|
|
|
где p – давление окружающей среды, f – площадь поршня; |
p + δp 2 |
– |
||||
сила, действующая на 1 м2 поршня; |
δp – изменение давления при переходе |
в |
||||
новое положение; dx – перемещение поршня (см. рис. 1.7).
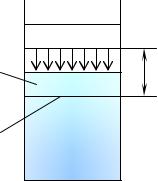
p
Поршень
dx
f
рис. 1.7
Работа сил давления (деформационная работа)
После раскрытия скобок в формуле (1.43) получается
|
|
dL = p f dx + δp f dx . |
(1.44) |
δp |
|
2 |
|
f dx – величина второго порядка малости, следовательно |
|
||
2 |
|
dL ≈ p f dx = p dV , |
(1.45) |
|
|
||
|
|
2 |
|
|
|
L = ∫ p dV . |
(1.46) |
|
|
1 |
|
|
Удельная работа (на 1 кг) |
|
|
|
|
dl = p dv , |
(1.47) |
|
|
2 |
|
|
|
l = ∫ p dv . |
(1.48) |
|
|
1 |
|
|
Таким образом, Первый закон термодинамики может быть записан в виде |
||
|
|
dQ = dU + p dV , |
(1.49) |
или на 1 кг газа |
dq = du + p dv . |
|
|
|
|
(1.50) |
|
|
Здесь q = dQ |
, u = dU – удельная теплота и удельная внутренняя энергия |
|
|
dm |
dm |
|
(на 1 кг газа).
1.7.Энтальпия
Энтальпия – это энергия расширенной термомеханической системы. Классическая иллюстрация расширенной термомеханической системы показана на рис. 1.8.
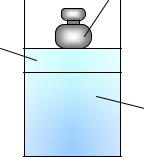
p Груз
Поршень
Газ
рис. 1.8
Расширенная термомеханическая система
Полная энергия расширенной термомеханической системы (полная энтальпия) представляет собой сумму внутренней энергии газа U и
потенциальной энергии поршня с грузом p V: |
|
I =U + p V . |
(1.51) |
Удельная энтальпия (на 1 кг газа): |
|
i = u + p v . |
(1.52) |
В общем случае энтальпия – это сумма внутренней энергии тела и работы, которую надо затратить, чтобы тело объемом V ввести в окружающую среду с давлением p, находящуюся с телом в равновесном состоянии.
Первый закон термодинамики можно записать с использованием
энтальпии: |
|
dq = du + pdv , |
(1.53) |
dq = du + pdv + vdp −vdp = du + d(pv)−vdp , |
|
так как |
|
du + d(pv)= di , |
|
то |
|
dq = di −vdp , |
(1.54) |
или |
|
dQ = dI −Vdp . |
(1.55) |
Формулы (1.54) и (1.55) представляют собой вторую форму записи |
|
Первого закона термодинамики. |
|
Два важных следствия: |
|
∆u = cv (T2 −T1 ); |
(1.56) |
∆i = c p (T2 −T1 ). |
(1.57) |
1.8.Основные термодинамические процессы
Для графического отображения термодинамических процессов используются диаграммы: p – v, T – S и др.
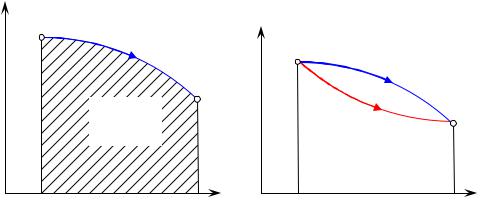
Термодинамический процесс на p – v диаграмме приведен на рис. 1.9. При переходе из состояния 1 в состояние 2 газ совершает работу, которая графически представляет собой площадь фигуры 1–2–3–4.
p |
1 |
p |
|
|
|
1 |
|
||
|
|
а |
||
|
|
|
||
|
|
2 |
|
|
|
|
|
2 |
|
|
Работа |
|
|
|
|
газа |
|
|
б |
|
4 |
3 |
|
|
|
v |
|
|
v |
рис. 1.9
Термодинамические процессы на p – v диаграмме
Термодинамический процесс определяется не только начальной и конечной точкой, но и зависит от пути, по которому происходит изменение параметров при перемещении на диаграмме от точки 1 к точке 2. Процесс а и процесс б – это разные термодинамические процессы.
Термодинамические процессы могут быть циклическими.
Цикл – замкнутый термодинамический процесс, в ходе которого рабочее тело, пройдя ряд состояний, возвращается в первоначальное. Это так называемый круговой процесс (рис. 1.10).
Классические термодинамические процессы (изохорный, изобарный,
изотермический, адиабатный, политропный) описываются зависимостями вида |
|
f (p,v,T )= const . |
(1.58) |
Если выполняется условие |
|
du = ϕdq , где ϕ = const , |
(1.59) |
то такой процесс называется политропным. |
|
dq = cϕdT , |
(1.60) |
где сϕ – теплоемкость политропного процесса.
p
1 2
4 |
3 |
v
рис. 1.10
Круговой термодинамический процесс
В соответствии с (1.57)
du = cv dT .
Из (1.59) и (1.60) следует
du = ϕdq = ϕcϕdT ,
откуда с учетом (1.61)
cϕ = cϕv .
Из уравнений (1.50), (1.59) и (1.60) можно получить
|
n |
dv |
+ |
dp |
= 0 . |
|
|
|||||
|
|
p |
|
|
||||||||
|
|
|
v |
|
|
|
|
|
|
|
||
Здесь |
|
|
|
|
|
|
|
|
|
|
||
n = |
cϕ −cp |
= |
cp −cϕ |
. |
||||||||
|
|
|||||||||||
|
c |
ϕ |
−c |
|
c |
−c |
ϕ |
|||||
|
|
|
|
v |
|
v |
|
|||||
При интегрировании уравнения (1.64) в предположении получается
2 dv |
|
2 dp |
|
|
|
|||||
n∫ |
|
|
= −∫ |
|
|
|
, |
|
||
v |
|
p |
|
|
||||||
1 |
|
1 |
|
|
|
|
|
|||
n (ln v2 −ln v1)= ln p1 −ln p2 , |
||||||||||
n ln |
v2 |
= ln |
p1 |
|
, |
|||||
v |
|
|||||||||
|
|
|
|
p |
2 |
|
|
|||
|
|
|
1 |
|
|
|
|
|
||
p1v1n = p2v2n ,
или
pvn = const .
Коэффициент n представляет собой показатель политропы. Для идеального газа pv = RT , тогда
(1.61)
(1.62)
(1.63)
(1.64)
(1.65)
n = const
(1.66)
(1.67)

RT1 vn = |
RT2 vn , |
||
|
1 |
|
2 |
v1 |
v2 |
||
T1v1n−1 =T2v2n−1 ,
или
Tvn−1 = const .
Аналогично можно получить, что
T n− = const . pn 1
Удельная работа политропного процесса (на 1 кг газа)
2
l = ∫ pdv .
1
В соответствии с (1.66) p = const v−n , тогда l = constn −1 (v12−n −v11−n ),
или
l = p1v1 − p2v2 . n −1
С учетом того, что pv = RT
l = R(T1 −T2 ). n −1
Другие удобные для расчета зависимости:
(1.68)
(1.69)
(1.70)
(1.71)
(1.72)
(1.73)
|
p1v1 − p2v2 |
|
|
|
p1v1 |
|
|
p2v2 |
|
|
p1v1 |
|
|
T2 |
|
|
|||||||||||
l = |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
= |
|
|
|
1 |
− |
|
|
|
= |
|
|
|
1 |
− |
|
. |
(1.74) |
||||||
|
n −1 |
|
n −1 |
|
p v |
|
n −1 |
T |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 1 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
n−1 |
|
|
|
|
|
|
|
|
|
|
n−1 |
|
|
||||
|
|
p1v1 |
|
|
|
p2 |
n |
|
|
|
RT1 |
|
|
|
p2 |
|
n |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
l = n −1 |
1 |
|
p |
|
= n −1 |
1 |
|
p |
|
. |
|
(1.75) |
|||||||||||||||
− |
|
− |
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Из (1.63) и (1.65) с учетом того, что cp cv = k следует, что |
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
cϕ = cv |
k −n . |
|
|
|
|
|
|
|
|
|
|
(1.76) |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1−n |
|
|
|
|
|
|
|
|
|
|
|
|||
Формула для подводимого тепла в политропном процессе имеет вид |
|
||||||||||||||||||||||||||
|
|
q = c |
k −n |
(T −T ) |
= c (T −T )+l . |
|
|
(1.77) |
|||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
v |
1−n |
2 |
|
1 |
|
v |
2 |
|
|
1 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Если тепло отводится, то T2 < T1 и рассчитанная по формуле (1.77) теплота получится отрицательной (при условии, что начало процесса в точке 1, а конец – в точке 2).
Далее рассматриваются частные случаи политропного процесса.

1.8.1. Изобарный процесс (p = const)
Если n = 0, то из pv0 = const следует, что p = const.
Из уравнения состояния pv = RT следует p = RTv ,
RT1 = RT2 , v1 v2
или
T1 = T2 . v1 v2
Формула (1.78) отражает известный закон Гей-Люссака.
При p = const
l = p(v2 −v1 )= R(T2 −T1 );
q= cp (T2 −T1 )= i2 −i1 = ∆i .
1.8.2.Изотермический процесс (T = const)
Если n = 1, то pvn = pv =const.
Из уравнения состояния pv = RT при T = const следует p1v1 = p2v2 ,
или
v2 = p1 , v1 p2
(1.78)
(1.79)
(1.80)
(1.81)
(1.82)
Формула (1.82) отражает известный закон Бойля-Мариотта.
При T = const внутренняя энергия не меняется: du = const. Тогда из Первого закона термодинамики следует dq = dl,
q = l ;
l = RT ln p1 . p2
1.8.3. Изохорный процесс (v = const)
Если n = ±∞, то 1n = 0 .
pvn = const p1 nv = const ; при n = ±∞ получается v = const.
nv = const ; при n = ±∞ получается v = const.
Второй закон Гей-Люссака:
p2 = T2 . p1 T1
Так как v = const, то dv = 0, поэтому работа не совершается:
