
Сосудистая хирургия часть 2
.pdf
184 Раздел VIII. Цереброваскулярная недостаточность
двукратное увеличение диаметра по сравнению с нормальным прилегающим сосудом является показанием для реконструкции.
Наилучшим способом восстановить нормальный кровоток и достичь долговременной проходимости является замещение аневризматического сегмента венозным протезом. Во время такого вмешательства возможна перевязка наружной сонной артерии. Более сложные артериальные реконструкции могут включать реанастомозирование наружной сонной артерии или, при возможности, использование бифуркационного сегмента подкожной вены для замещения резецированной бифуркации. Аутологичный материал является более привлекательным кондуитом, если у больного существует любой риск инфицирования. Если вена адекватного диаметра недоступна, следует использовать синтетический материал. В целом, рутинная для окклюзирующих поражений сонной артерии хирургическая техника применяется и для аневризматических поражений.
При протезировании после установления контроля за проксимальным и дистальным артериальными сегментами возможна установка прямого внутрипросветного шунта для сохранения мозгового кровотока во время реконструкции. Аневризма вскрывается на протяжении, необходимом для введения шунта. Перед установкой последнего на шунт надевается кондуит. Шунт фиксируется проксимально и дистально с помощью турникетов Rummel. Далее могут быть наложены анастомозы конец-в-конец, пока во внутренней сонной артерии поддерживается кровоток. Шунт удаляется непосредственно перед завершением проксимального анастомоза. Подкожная вена, забранная с бедра, обычно имеет тот же диаметр как и внутренняя сонная артерия [39].
Впервые об успешно выполненном простом лигировании каротидной аневризмы доложил около двух веков назад Astley Cooper
в Лондоне [40]. Хирурги совершенствовали инструментарий, например зажим Selverstone, который накладывался на несколько дней, позволяя развиться коллатеральному кровообращению пока мониторировался неврологический статус пациента [41]. С появлением эндоваскулярных покрытых стентов стало возможным выключать большинство дистальных крупных или симптомных аневризм внутренней сонной артерии с помощью катетерной техники. Не следует рассматривать процедуру окклюзии внутренней сонной артерии при возможности реконструкции, однако аневризмы, вовлекающие самый дистальный отдел артерии, могут препятствовать наложению анастомоза до перехода артерии в интракраниальный сегмент. Окклюзия может считаться оправданной при угрозе эмболии или разрыва аневризмы. Аневризматические изменения ветвей наружной сонной артерии доступны обычному лигированию без неврологических последствий или эмболизации чрескожным путем. Последняя методика особенно привлекательна у пациентов, которым мог бы потребоваться обширный доступ при открытой операции, в частности при поражении ветвей, прилежащих к лицевому нерву, основанию черепа, носоглотке или пазухе верхней челюсти.
Расслоение сонной артерии
Расслоение сонной артерии является редким событием и, хотя иногда описывается как «спонтанное», обычно связано с определенным механическим воздействием на сосуд. Тривиальная травма, часто разнесенная по времени с появлением такой симптоматики, как чрезмерное вытягивание, сгибание или поворот шеи либо
A |
|
Б |
|
|
|
Рис. 71.3. (А) Изображение сонной артерии при спонтанном расслоении при введении контраста в истинный просвет. Границы ложного просвета (стрелки) образуют «клюв» в дистальной точке расслоения. Устье наружной сонной артерии не перфузируется, поскольку расслоение распространяется через бульбус. (Б) Селективное введение контрастного вещества проксимальнее начала расслоения сдавливает ложный просвет, вследствие чего полностью контрастируется бифуркация и ее ветви.
Глава 71. Неатеросклеротические цереброваскулярные заболевания |
185 |
|
|
даже сильный кашель и высмаркивание, могут привести к разрыву интимы, формирующегося в фенестрацию артериальной стенки. Истинные спонтанные расслоения могут сочетаться с разорвавшимися атеросклеротическими бляшками, фибромышечной дисплазией или кистозным медионекрозом.
Расслоение сонной артерии чаще проявляется очаговым неврологическим дефицитом, который может включать полушарные моторные и сенсорные нарушения, дисгевзию, потерю функции блуждающего и подъязычного нервов, боль в шее, болезненность кожи черепа или головную боль [42, 43]. Воспалительная реакция вокруг расслоенной артерии рассматривается в качестве причины различных неврологических дефектов. При артериографии выявляется коническое сужение шейной порции сонной артерии (рис. 71.3). Указанный конус образуется из-за выбухающей субадвенциальной гематомы при нарушении кровотока в нормальном просвете за счет сдавления последнего ложным [44]. Компьютерная томография и магнитно-резонансная томография обеспечивают отличное изображение артериального расслоения в поперечном срезе и определяют протяженность ложного просвета [45, 46].
Начало расслоения возникает в разрыве интимы, распространяясь до наружных слоев медии, но ограничено адвентицией. Кроме того, при наличии организованного тромба, пенетрирующего в гладкомышечные слои артериальной стенки, гистологическое исследование расслоенных фрагментов выявляет разрыв внутренней эластической мембраны и снижение количества эластической ткани [42]. Хотя наличие протяженного конического сужения заставляет клинициста думать о спонтанном расслоении, данный ангиографический признак может присутствовать и в иных случаях сужения просвета, как при атеросклерозе, фибромышечной дисплазии, артериите, болезни моя-моя и вазоспазме.
Первоначальный опыт хирургического лечения при расслоениях внутренней сонной артерии заключался в фенестрации и облитерации ложного канала для восстановления кровотока по нормальному анатомическому просвету. Эти попытки сопровождались разочаровывающими результатами из-за высокой частоты периоперационных инсультов и окклюзий реконструированных сегментов [42]. Лучшие исходы отмечались при неоперативном лечении путем системной антикоагуляции гепарином в сроки от 10 до 14 дней. Считается, что в течение этого периода возможна ретракция субадвентициального сгустка и заживление дефекта интимы. Антикоагулянтное состояние снижает риск тромбоза внутренней сонной артерии и дистальной церебральной эмболизации из зоны повреждения [47]. Следует избегать применения гепарина, если расслоение привело к возникновению инсульта с внутримозговой геморрагией или же расслоение распространяется до основания черепа, так как в последнем случае антикоагуляция может быть связана с риском субарахноидального кровоизлияния. Гепаринотерапия может заменяться на варфарин, назначение которого возможно в амбулаторных условиях до разрешения поражения. Динамика заживления расслоения легко отслеживается при дуплексном сканировании без ка- кого-либо риска для больного. Хирургическое вмешательство в виде протезирования расслоенного сегмента аутовеной рекомендуется, если гематома при расслоении не разрешается или отмечается ухудшение неврологического статуса и рецидив очагового дефицита. При наличии персистирующих симптомов в случае невозможности каротидной реконструкции на шее следует выполнять перевязку внутренней сонной артерии и экстра-интра- краниальное шунтирование [48].
Фибромышечная дисплазия сонных артерий
Фибромышечная дисплазия является подробно описанной нозологической единицей, этиология которой не совсем понятна. У пациентов отмечаются последовательные стенозы внутренней сонной артерии, проявляющиеся симптомами сосудисто-мозговой недостаточности. Длинные мобильные артерии среднего размера (как внутренняя сонная) поражаются более часто, чем таковые с ветвями (как наружная сонная) [49]. Большинство теорий подразумевают некоторую форму хронической травмы артерии, вызывающей нарушение кровоснабжения через vasa vasorum, первично поражающего медиальный слой сосуда [50]. Это приводит к дезорганизации внутренней эластической мембраны и выраженному утолщению медиального слоя из-за гипертрофии гладкомышечных клеток и инфильтрации и пролиферации фибробластов. Процесс часто вовлекает артерию сегментарно, когда гипертрофированные участки сочетаются с разрывом эластических мембран. Из-за неравномерности поражения сосудистой стенки ангиографическое исследование подтверждает четкообразность изменений. Также может развиться извитость или изгиб артерии, поскольку в гипертрофированном сосуде возникают последовательные участки стенозов. Больные с фибромышечной дисплазией внутренней сонной артерии, вероятнее всего, имеют вовлечение и других артериальных сегментов, включая позвоночные, берцовые, почечные и висцеральные артерии. Патогистологическое исследование интракраниальных мешотчатых аневризм позволяет предположить, что подобная причина может вносить вклад в развитие и этой артериальной аномалии.
Фибромышечные нарушения могут выявляться при очаговых полушарных неврологических симптомах, включающих парез конечностей или amaurosis fugax. Как и следовало ожидать, при физикальном исследовании стенозированной артерии наиболее важным признаком каротидного поражения является систолический шум. Симптомокомплекс неотличим от такового при атеросклеротическом окклюзионном процессе, и клинический диагноз фибромышечной дисплазии обычно устанавливается во время ангиографии. Патологические изменения наиболее часто вовлекают внутреннюю сонную артерии дистальнее бифуркации, выше угла нижней челюсти и могут распространяться до интракраниального отдела сосуда. Поражение обычно является двусторонним. Фибромышечные изменения сочетаются с атеросклеротическим поражением менее чем у четверти пациентов.
Ангиографическая «четкообразная полоска» присутствует более чем у 75% больных. Этот ангиографический признак считается патогномоничным для фибромышечной дисплазии. Реже при ангиографии выявляется тубулярный стеноз, который может развиваться единично или в нескольких сегментах пораженной артерии [51].
Так как у женщин заболевание встречается в 10 раз чаще, исследователи обращали внимание на взаимоотношение между фибромышечной дисплазией и эстрогенами, контрацептивными гормонами, а также связанными с полом генетическими факторами. Изменения в медии артерий среднего и крупного диаметра во время беременности описаны достаточно подробно [52]. Ряд авторов связывали это с назначением женских репродуктивных стероидов для контрацепции или постменопаузальной терапии, но сопоставления не подтвердились [53]. Модификация гормонального профиля и сопутствующий сдвиг напряжения в относительно нефиксированном среднем сегменте

186 Раздел VIII. Цереброваскулярная недостаточность
внутренней сонной артерии, вероятно, вместе влияют на структурные изменения в стенке сосуда, приводя к типичным сегментарным повреждениям.
Больные с неврологическими симптомами в отсутствие расслоения считаются кандидатами на хирургическое лечение, так как между нарушениями структуры артерий и инсультом существует выраженная взаимосвязь [54, 55]. Множественные зоны стенозов, выявляемые при ангиографии, могут легко оказаться источниками эмболии, сгустками крови или агрегатами тромбоцитов, формирующимися на неровностях поверхности стенки в виде перемычек и стенозов просвета. Симптомы также могут быть обусловлены уменьшением кровотока из-за часто встречающихся множественных выраженных сужений просвета. В отличие от атеросклеротического поражения экстракраниальных сегментов сонных артерий у больных с фибромышечной дисплазией эндартерэктомия неэффективна или невозможна, а наиболее адекватным методом коррекции является чреспросветная дилатация [54].
Во время операции следует тщательно мобилизовывать общую сонную артерию с ее внутренней и наружной ветвями и выделять внутреннюю сонную артерию насколько возможно дистально. Пережатие внутренней сонной артерии следует выполнять нетравматичным способом — эластичная артериальная петля эффективно блокирует ретроградный кровоток и позволяет удерживать и манипулировать пораженным артериальным сегментом. Разрез на внутренней сонной артерии следует увеличивать за счет продольного рассечения каротидного бульбуса. После артериотомии в сосуд последовательно заводятся внутрипросветные дилататоры возрастающего диаметра, начиная с размера 1,5 или 2 мм. Повышение диаметра дилататора должно составлять 0,5 мм, проведение через стенозированный участок достигается мягким давлением до того, как продолжает ощущаться сопротивление. Чтобы не допустить повреждения интимальной поверхности, максимальный размер дилататора не должен превышать 4 мм. После максимальной дилатации проводится энергичное промывание ретроградным кровотоком, позволяющее удалить сгустки и разорванные фрагменты интимы, которые могли накопиться во время проведения процедуры. Альтернативной техникой является внутрипросветная баллонная дилатация [56]. Размер баллона следует подбирать такой длины, чтобы она позволяла свободно манипулировать в пораженном сегменте, а диаметр допускал возможность достичь результата, аналогичного описанному при использовании последовательных дилататоров. Из-за риска тромбоэмболии некоторые хирурги настаивают на открытой технике и после использования баллона ретроградным кровотоком отмывают из сосуда возможные обрывки интимы или сгустки. Стентирование сонных артерий является более совершенной процедурой, позволяя дилатировать указанные поражения из отнесенного доступа чрескожным катетером с защитным устройством, уменьшающим риск осложнений, связанных с дистальной эмболизацией.
Опухоли каротидного тельца
Опухоли каротидного тельца, более точно обозначаемые в номенклатуре заболеваний человека как каротидные параганглиомы, являются наиболее часто встречающимися внеадреналовыми параганглиомами [57]. Хотя указанные поражения не проистекают
из системы экстракраниальной каротидной циркуляции, они рассматриваются из-за интимного соседства с сонными артериями и вследствие того, что сосудистые хирурги часто диагностируют и лечат указанные заболевания при необходимости оперативного вмешательства.
В норме каротидное тельце представлено небольшим объемом нейроваскулярной ткани, расположенной билатерально по медиальным поверхностям сосудов каротидной бифуркации. Фетальное каротидное тельце развивается внутри артериальной стенки между адвентицией и медией. Кровоснабжение осуществляется преимущественно через ветви наружной сонной артерии, а иннервация — мелкой ветвью нерва Hering, волокна которого вступают в продолговатый мозг с языкоглоточным нервом. Оно имеет богатое кровоснабжение и при сравнении с эквивалентными массами ткани объемный кровоток в нем в 10 раз превышает поступающий в сердце и в 25 раз — в мозг [58]. Хеморецепторы каротидного тельца чувствительны к гипоксии, гиперкапнии и ацидозу, объемный кровоток позволяет этим клеткам принимать участие в регуляции дыхания, хотя точный механизм такого действия подробно не определен. Каротидное тельце не следует путать с каротидным синусом, расположенным внутри стенки внутренней сонной артерии и ответственного за регуляцию артериального давления.
Параганглиомы каротидного тельца вырастают также из нейроэктодермальных клеток. Последние мигрируют во время эмбриогенеза вместе с автономными ганглионарными клетками, формирующими каротидное тельце. Гистологически опухоли каротидного тельца представлены избыточно растущими параганглионарными клетками. Кроме локализации в каротидном тельце подобные опухоли могут прилегать к блуждающему нерву на протяжении от дуги аорты до основания черепа. Интракраниально параганглиомы могут поражать нервы среднего уха. Хотя поражения обычно являются дискретными, со временем измененные параганглионарные клетки могут пролиферировать из каротидного тельца и прорастать кости черепа.
Несмотря на то что термин «опухоль» исторически связывается с этими образованиями, они не являются карциномами, а неопластический процесс в действительности представлен гипертрофией ткани каротидного тельца. Гипертрофия последнего связывается с гипоксией, однако большинство пациентов с такими опухолями не испытывали недостатка кислорода по физиологическим причинам [59]. Указанные поражения расцениваются как злокачественные, если присутствуют инфильтрация параганглионарной ткани в прилегающие лимфатические узлы или дистальные метастазы, и приблизительно 10% описанных случаев попадают под определение злокачественности. Около 10% больных имеют двусторонние поражения. Существует семейная предрасположенность к развитию опухолей каротидного тельца, и при установлении диагноза должны быть обследованы братья или сестры для раннего выявления заболевания [60]. Другие параганглиомы на шее включают опухоли яремного тельца и гломуса, которые могут вовлекать структуры среднего уха после прорастания основания черепа [61].
У больных с опухолями каротидного тельца симптоматика обычно связана с наличием самого образования и сдавлением прилегающих структур в относительно ограниченном каротидном фасциальном пространстве. Помимо ощущения тяжести или давления у угла нижней челюсти, пациент может ощущать дисфагию, осиплость голоса, звон в ушах или головную боль. Часто может ощущаться пульсация опухоли из-за интимного предлежания к каротидной бифуркации, однако само по себе васкуляризирован-
Глава 71. Неатеросклеротические цереброваскулярные заболевания |
187 |
|
|
ное образование не пульсирует и обычно настолько мобильно, что может быть повернуто радиально вокруг оси каротидных сосудов. Поскольку опухоль имеет склонность к стимуляции прилежащего каротидного синуса, больные могут ощущать брадикардию или переносить обмороки.
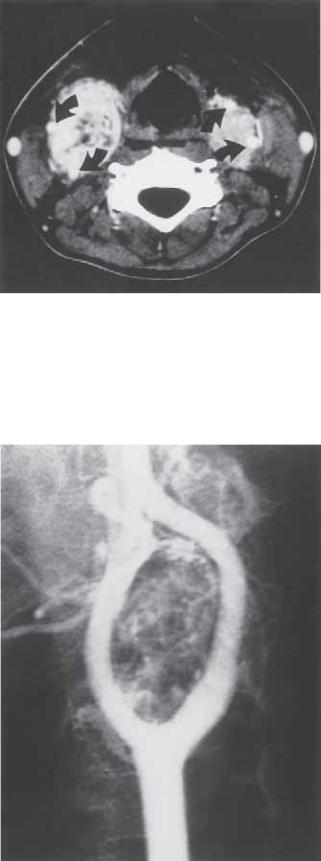
Ультрасонография позволяет адекватно различать опухоли каротидного тельца от обычных кист шеи или заболеваний щитовидной железы. Из-за обильной васкуляризации при описываемом состоянии дополнение цветового картирования кровотока к визуализации в В-режиме делает возможным определить границы опухоли каротидного тельца и ее связь с бифуркацией сонной артерии. Компьютерная или магнитно-резонансная томография шеи подтверждает протяженность поражения и его анатомическое взаимоотношение с прилегающими структурами (рис. 71.4). Дооперационное обследование должно включать селективную каротидную артериографию для изучения артериальной анатомии и определения связи опухоли каротидного тельца с каротидной бифуркацией. Классическое огибание наружной и внутренней сонными артериями сильно васкуляризированной опухолевой массы является патогномоничным для данного поражения (рис. 71.5). Обильное кровоснабжение опухоли каротидного тельца происходит через ветви наружной сонной артерии и знание специфической артериальной анатомии важно для контроля за возможным интраоперационным кровотечением. Также через эти ветви можно выполнять эмболизацию опухоли, особенно в случаях поражения на значительном протяжении, достигающем основания черепа. Не имеет никакого значения, производить биопсию опухолей каротидного тельца открытым или чрескожным пункционным методом. Принципы хирургического вмешательства при этих опухолях заключаются в полной резекции и реконструкции артериальных сосудов при показаниях.
Хирургическая резекция является методом выбора в лечении опухолей каротидного тельца и должна выполняться, если нет противопоказаний по оперативному риску либо имеется асимптомное течение в пожилом возрасте. Во всех остальных случаях даже небольшие образования следует резецировать, так как со временем они только увеличиваются. При более выраженных опухолях повышается частота хирургических осложнений из-за прилежания или прорастания окружающих структур. Хирургическое иссечение технически затруднено из-за гиперваскуляризации поражения, что может приводить к обильной интраоперационной кровопотере, и из-за интимного предлежания образования к окружающим структурам шеи (в частности, блуждающему и подъязычному нервам). При инвазии опухолью стенки сонной артерии требуется резекция сегмента сосуда для радикального удаления всех патологических тканей.
Доступ к опухолям каротидного тельца осуществляется через стандартный разрез не шее, используемый при реконструкции каротидной бифуркации. Из-за значительной рутинной кровопотери при этих операциях необходимо пользоваться аппаратом для возврата аутокрови. При некоторых поражениях возможно удаление опухоли путем субадвентициального отделения от артерии. Манипуляции с опухолью, имеющей консистенцию «размокшей салфетки», требуют медленного тщательного выделения с детальным контролем гемостаза, включающим использование лигатур, электрокоагуляции и местных гемостатиков. Основное кровоснабжение опухоли осуществляется через наружную сонную артерию, поэтому пересечение многочисленных мелких, питающих параганглиому, сосудов может быть облегчено одномоментным контролем наружной сонной артерии на уровне бифуркации и дисталь-
Рис. 71.4. Поперечный срез при компьютерной томографии у больного с двусторонними опухолями каротидного тельца. Обследование больного было предпринято в связи с жалобами на дисфагию, возникшую еще до проведенной тиреоидэктомии при подозрении на злокачественное новообразование. Обращает внимание отношение контрастированных внутренней и наружной сонной артерий (стрелки) к объемному образованию.
Рис. 71.5. Артериограмма бифуркации сонной артерии при опухоли каротидного тельца. Обращает внимание огибание наружной и внутренней ветвями опухолевой массы и степень васкуляризации последней.

188 Раздел VIII. Цереброваскулярная недостаточность
нее опухоли каротидного тельца. Указанный сегмент наружной сонной артерии даже может быть иссечен единым блоком с опухолью каротидного тельца. Прорастающие и неотделимые от внутренней сонной артерии поражения также могут потребовать удаления сегмента артерии. В указанных случаях для сохранения мозгового кровотока следует выполнять артериальную реконструкцию в виде аутовенозного протезирования с использованием проксимального отдела большой подкожной вены как наиболее соответствующего по диаметру. До протезирования внутренней сонной артерии максимальное удаление опухоли и гемостаз следует завершить, поскольку требуется системная гепаринизация больного. Для поддержания в дистальном отделе внутренней сонной артерии кровотока во время резекции через венозный протез проводится шунт, накладываются анастомозы по типу конец- в-конец и перед пуском кровотока шунт удаляется. При обширных опухолях, особенно вовлекающих дистальную порцию внутренней сонной артерии, хирургу следует выбрать сохранение резидуальной опухоли, нежели быть вынужденным лигировать артерию. Это чревато крайне высоким риском инсульта и гемиплегии [62]. При расширенной мобилизации ближе к основанию черепа, при возникновении анатомических ограничений возрастает риск повреждения черепномозговых нервов. Патологическое каротидное тельце может покрывать или обхватывать оба (подъязычный и блуждающий) нерва.
Эмболизация опухоли через чрескожный катетер может оказаться эффективной в уменьшении кровоснабжения параганглиомы, однако данный метод является лишь приложением к хирургической резекции [63]. Изолированная эмболизация не блокирует кровоснабжение в степени, достаточной для гибели опухоли. Операцию необходимо выполнять быстро, сразу после эмболизации, так как сеть многочисленных коллатералей быстро восстанавливает кровоснабжение в эмболизированных участках. При планировании чрескожного вмешательства также следует учитывать риск выраженных манипуляций катетером в зоне каротидной бифуркации и предупреждать возможность повреждения или попадания эмболов во внутреннюю сонную артерию.
На сегодняшний день удаление опухолей каротидного тельца сопровождается инсультами и смертями с частотой менее 1% [64]. Хирургическое вмешательство является лечением выбора при этих поражениях. Тем не менее микроскопические резидуальные проявления заболевания возможно пропустить, что вызывает рецидив опухоли. Хирургические пациенты должны прослеживаться с помощью долговременных программ наблюдения, поскольку может миновать 10 или 20 лет, прежде чем метастатические проявления станут клинически очевидными [60].
Радиационные поражения сонных артерий
Радиационная терапия в высоких дозах обычно назначается для лечения чешуеклетчатой карциномы головы и структур шеи как дополнительное лечение после обширных хирургических резекций, так и вместо операций в случаях, когда она является первичным лечебным мероприятием. Также радиационная терапия может использоваться при лечении небольших злокачественных новообразований: болезни Ходжкина, неходжкинской лимфомы, аденокарциномы околоушной железы, метастаз рака молочной железы, рака щитовидной железы. При успешном лечении этих злокачественных поражений и отдаленном выжи-
вании пациента наиболее частой проблемой становятся радиа- ционно-обусловленные поражения сонных артерий [65]. Радиационные изменения в остальном нормальных артерий очень похожи на атеросклеротическую дегенерацию у больных с гиперхолестеринемией, курением или в пожилом возрасте.
Клинические проявления аналогичны атеросклеротическим окклюзирующим поражениям сонных артерий, но их присутствие вероятнее у облученных больных, не имеющих других проявлений атеросклероза [65]. Поскольку пациенты, выжившие после лечения тяжелых злокачественных образований головы и шеи, обычно находятся под постоянным наблюдением, большинство поражений выявляется на асимптомной стадии; тем не менее описаны случаи очагового неврологического дефицита при радиационных каротидных стенозах [66]. Указанные изменения могут проявляться спустя годы после проведения лучевой терапии. Свидетельств того, что физиология артерии подвержена неблагоприятному прямому влиянию злокачественного процесса, у этих больных не выявлено.
Воздействие наружного пучка излучения на нормальную артерию сопровождается как острыми, так и хроническими гистологическими изменениями. В течение 48 ч после экспозиции радиации происходит значительное спадение эндотелиальных клеток с разрывом их ядер [67]. Медиальный и адвентициальный слои во время этого острого ответа не задействуются. Как и можно было бы полагать при интимальном повреждении, вскоре начинается репаративный процесс в сочетании с агрегацией тромбоцитов и отложением фибрина на пораженном участке.
Хотя интимальная поверхность быстро покрывается новым слоем эндотелиальных клеток, последние имеют отклонения от нормальной морфологии и физиологии. Хронические изменения включают разрывы медиального слоя с инфильтрацией фиброцитами. Возникают локальные зоны медиального некроза и очаговые разрывы частей адвентициального слоя, характерные для хронического воспалительного процесса. В связи с повреждением функции гладкомышечных клеток возрастает проницаемость стенки сосуда, что приводит к ее инфильтрации циркулирующими липидами. Зажившая артерия лишается нормальных эластических характеристик, что сопровождается хроническим фиброзом, жировой инфильтрацией и разрывами адвентиции. Повреждение vasa vasorum вызывает дальнейшее ослабление целостности сосуда. Изменения в параадвентициальной ткани после облучения в дальнейшем могут нарушать податливость и адаптацию, которые должна выдерживать артерия.
Радиационное повреждение приводит к сужению артериального просвета, часто неотличимого от такового при выраженном атеросклеротическом поражении. Однако кроме стенозов и окклюзий такие артерии подвержены значительному риску разрыва из-за повреждения адвентициального слоя. Артериальный разрыв чаще происходит у пациентов, которым проводились обширные хирургические вмешательства в сочетании с лучевой терапией по поводу злокачественных новообразований. У таких больных может оставаться только слой кожи, покрывающий сонную артерию, и в присутствии инфекции защитный барьер ослабляется. Часто сосудистые катастрофы связаны с инфекцией, осложняющей злокачественный процесс, вовлекающий ротовую полость, или как результат ослабления кожного лоскута вследствие хронической ишемии после обширного вмешательства на шее. Любое кровотечение из такой раны требует экстренной операции в виде протезирования пораженного сегмента сонной артерии [68]. Возможность выявления самой артериальной катастрофы или ее угрозы служит обоснованием проведения программ по наблюдению. По

Глава 71. Неатеросклеротические цереброваскулярные заболевания |
189 |
|
|
данным McReady с соавторами, в 11 наблюдениях разрывов сонных артерий лигирование потребовалось у 9 пациентов и в 5 случаях был отмечен инсульт или больной погиб [69]. У 2 пациентов из этой серии, которым производилось только облучение шеи по поводу карцином той же локализации, возникли подкожные кровотечения из сонной артерии.
Частота стенозов сонных артерий значительно выше при облучении шеи, чем у необлученных больных [70]. Наблюдения за пациентами с облучением сонных артерий с помощью дуплексного сканирования вполне достаточно, так как чувствительность методики позволяет выявлять повреждение сосудов до возникновения симптомов. По данным Moritz и соавторов, в группе больных с обширными карциномами шеи у 30% пациентов после лучевой терапии проявился стеноз сонной артерии в сравнении с 5,6% в необлученной контрольной группе [66]. Вышеуказанная диагностическая методика позволяет выявлять присутствие бляшки, часто составленную из инфильтрированных липидов и свежих тромбов, так же как и степень выраженности артериального стеноза.
Кроме предотвращения сосудистой катастрофы хирургическое вмешательство, направленное на коррекцию этих поражений, показано для предупреждения инсульта. Последний может оказаться еще более инвалидизирующим для пациента, который уже потерял трудоспособность после радикальной операции на шее или ларингэктомии. Из-за выраженных изменений, развивающихся на всю глубину артериальной стенки после облучения, стандартная эндартерэктомия как метод хирургической коррекции обычно неприменима . Даже если удается добиться отслоения по медиальному слою артерии, целостность поврежденной адвентиции обычно препятствует ее безопасному сохранению в артериальной циркуляции. В качестве пластического материала для замещения вовлеченного сегмента предпочтительнее использовать протез из аутовены, забирая трансплантат из большой подкожной вены на бедре. Часто требуется резекция порции общей сонной артерии, ее бифуркации и пораженной внутренней сонной артерии на шее. Обычно лигирование наружной сонной артерии без-
опасно, если нет сомнений в сохранении жизнеспособности кожных лоскутов через коллатеральное кровообращение. Для поддержания адекватной церебральной перфузии требуется внутрипросветное шунтирование, шунт проводится через венозный протез перед наложением анастомозов по типу конец-в-конец с общей и внутренней сонными артериями. Нередко для адекватного закрытия зоны каротидной реконструкции возникает потребность в перемещении мышечного лоскута. Если закрытие раны после артериальной реконструкции в облученном поле только кожей невозможно, для закрытия дефекта используется мышечнокожный лоскут.
Каротидные рестенозы после эндартерэктомии
После того как каротидные эндартерэктомии стали выполняться в многочисленных группах больных, при отдаленном наблюдении стало очевидно, что эффект от вмешательства в 100% случаев не сохраняется, хотя в небольших подгруппах пациентов рестеноз сонной артерии будет развиваться даже при технически безупречной эндартерэктомии с первичным швом или пластикой заплатой. В некоторых случаях причиной рестеноза является атеросклероз. Признаки рестенозирования у таких больных, как правило, выявляются через 2 года после первичной эндартерэктомии (рис. 71.6). Рецидивное поражение коррегируется технически так же, как и при первичных операциях при атеросклерозе — удалением бляшки на границе медиального и адвентициального слоев. В другой подгруппе пациентов в течение 2 лет после эндартерэктомии рестеноз мог развиваться и без связи с атеросклерозом [71]. В этих случаях причиной рецидивирования окклюзирующего процесса служит фиброз интимы в зоне проведенной ранее эндартерэктомии. После того как хирурги начали отслеживать состояние своих больных после каротидной эндартеркэтомии с помощью послеопе-
|
|
|
Рис. 71.6. (А) Каротидная ангиограмма боль- |
|
|
|
ного с полушарными моторными транзитор- |
|
|
|
ными ишемическими атаками. Ему была вы- |
|
|
|
полнена каротидная эндартерэктомия с |
|
|
|
первичным швом. (Б) Через 7 лет повторная |
|
|
|
каротидная ангиограмма рестеноза. При по- |
|
|
|
вторной операции была удалена изъязвленная |
A |
|
Б |
атероматозная бляшка. |
|
|
|
|

190 Раздел VIII. Цереброваскулярная недостаточность
рационного протокола наблюдения, представление о рестенозах удалось сформировать более четко [72]. При длительном наблюдении за пациентом после операции становится возможным разграничить рестенозы с резидуальными послеоперационныим поражениями и выявить больных с риском неврологических осложнений до того как они станут симптомными.
Пролиферация миоинтимальных клеток происходит как нормальный ответ на артериальное повреждение в виде медленного, систематического восстановления и пролиферации многоклеточного слоя на участке интимальной травмы. Гиперплазия миоинтимальных клеток, наблюдающаяся у части больных после реконструкции сонной артерии, представляет собой усиление нормального процесса восстановления эндотелия, при котором отмечается неконтролируемая пролиферация гладкомышечных клеток медиального слоя артериальной стенки. Считается, что у таких пациентов во время формирования плоскости эндартерэктомии в сонной артерии воздействие на слой гладких мышц вызывает реакцию последних с циркулирующими элементами крови, что опосредует избыточный пролиферативный ответ [73]. Ряд исследователей теоретически предполагают, что гладкомышечные клетки медии воспроизводятся и мигрируют через внутреннюю эластическую мембрану в интимальный слой, где их количество умножается и они начинают выделять экстрацеллюлярный матрикс, который вместе с соединительной тканью вносит вклад в утолщение интимы, приводящее к рестенозу сосуда [74]. Макроскопически такой рестеноз представляет собой ограниченный, плотный гомогенный слой с блестящей гладкой поверхностью, обращенной к просвету артерии [71]. Гистологически присутствует диффузный фиброзный слой под интимальным слоем эндотелиальных клеток и над преобразованным медиальным слоем. Такое утолщение составлено из мукополисахаридной основной субстанции, инфильтрированной массой свободно связанных фиброцитов. Характерная для атеросклеротических поражений инфильтрация холестерином и липидными фракциями отсутствует.
Ангиографически описываемые поражения выглядят как гладкие стенозы в зоне эндартерэктомии (рис. 71.7). При дуп-
лексном сканировании рестенозы проявляются некоторым уменьшением диаметра, фиксированным на основании критерия скорости кровотока, и редко прогрессируют до критического, предокклюзивного состояния. С учетом вышеприведенных характеристик артериальной стенки, рестеноз вследствие миоинтимальной гиперплазии менее склонен к симптомному течению, нежели атеросклеротический стеноз той же степени. Гладкая поверхность при миоинтимальной пролиферации редко содержит тромботические наслоения и приводит к дистальной эмболизации в сравнении с более неоднородными атеросклеротическими поражениями. В надежде на то, что пролиферативный процесс, развивающийся после взаимодействия с элементами крови, возможно блокировать, хирурги рутинно назначают больным после каротидной эндартерэктомии постоянную дезагрегантную терапию. Однако исследования в этом направлении не доказали торможение миоинтимальной пролиферации снижением адгезии и агрегации тромбоцитов. Дезагреганты в предупреждении неврологических осложнений могут быть более эффективны при рецидивном атеросклеротическом процессе. Помимо взаимодействия между элементами крови и эндартерэктомированной артериальной стенкой, такие технические факторы хирургического вмешательства, как травма зажимом, резидуальные лоскуты интимы, а также атеросклеротические бляшки либо стеноз при закрытии артериотомии, могут приводить к нарушениям кровотока и вносить свой вклад в пролиферацию миоинтимальных клеток.
Из-за того, что первым клиническим проявлением рестеноза может оказаться инсульт, не следует недооценивать значения активной послеоперационной программы наблюдения за пациентом [74]. Регулярные последовательные обследования больного должны проводиться в течение первых 2 лет после артериальной реконструкции, когда наиболее вероятно развитие стеноза на почве миоинтимальной гиперплазии. Также необходимо максимально раннее послеоперационное обследование, чтобы зафиксировать возможный резидуальный стеноз, который способен в дальнейшем маскировать рецидивное поражение [75]. При выяв-
A |
|
Б |
|
B |
|
|
|
|
|
Рис. 71.7. (А) Каротидная ангиограмма критического локального стеноза проксимальной порции внутренней сонной артерии у больного с amaurosis fugax. (Б) После каротидной эндартерэктомии при артериографии выявляется нормальное контрастирование реконструированного сегмента внутренней сонной артерии. (В) Через восемь месяцев по программе послеоперационного наблюдения был диагностирован рестеноз, подтвержденный при повторной ангиографии. Поражение вследствие фибромышечной гиперплазии было коррегировано пластикой венозной заплатой.
Глава 71. Неатеросклеротические цереброваскулярные заболевания |
191 |
|
|
лении значимого стеноза в рамках программы наблюдения следует придерживаться агрессивной хирургической тактики [76]. Рестеноз вследствие миоинтимальной гиперплазии традиционно коррегируется пластикой заплатой без эндартерэктомии, так как часто невозможно выявить линию отслоения медии после первичной операции. Разрыв миоинтимального поражения может приводить к разрушению адвентициальных слоев артериальной стенки, обеспечивающих ее структурную целостность. Другим способом выбора при повторных реконструкциях сонной артерии остается протезирование сегмента, содержащего рестеноз. В лечении рецидивных стенозов сонной артерий привлекательными терапевтическими альтернативами быстро стали баллонная ангиопластика и стентирование. Катетерное вмешательство позволяет избежать повторной операции на шее и возможного повреждения сопровождающих черепных нервов. С появлением систем защиты мозга снизился риск дистальной эмболизации и инсультов. Отдаленных результатов эндоваскулярного лечения каротидных рестенозов не существует.
Даже если рецидивные поражения, предположительно вызванные миоинтимальной гиперплазией, протекают бессимптомно, пациенты должны наблюдаться и в дальнейшем. По данным программ наблюдения, значительная часть таких изменений действительно регрессирует со временем. Причины первичных окклюзирующих каротидных поражений полностью непонятны, и так же как факторы, влияющие на рецидивный процесс, требуют более глубокого изучения.
Литература
1.Huston KA, Hunder CC, et al. Temporal arteritis: a 25-year epidemiologic, clinical and pathologic study. Ann Intern Med 1978; 88: 162–167.
2.Mambo NC. Temporal (granulomatous) arteritis: a histopathological study of 32 cases. Histopathology 1979; 3: 209.
3.Klein RG, Campbell RJ, et al. Skip lesions in temporal arteritis. Mayo Clin Proc 1976; 51: 504.
4.Huston KA, Hunder GG. Giant cell (cranial) arteritis: a clinical review. Am Heart J 1980; 100: 99.
5.Wong RL, Korn JH. Temporal arteritis, without an elevated erythrocyte sedimentation rate. Am J Med 1986; 80: 959.
6.Allsop CJ, Gallagher PJ. Temporary artery biopsy in giant-cell arteritis. Am J Surg Pathol 1981; 5: 317–323.
7.Hall S, Persellin S, et al. The therapeutic impact of temporal artery biopsy. Lancet 1983; 2: 1217–1220.
8.Rosenfeld SI, Dosmorsky GS, et al. Treatment of temporal arteritis with ocular involvement. Am J Med 1986; 80: 143.
9.Bengtsson BA, Malmvall BE. Giant cell arteritis. Acta Med Scand 1982; 658: 1.
10.Takayasu M. Case with unusual changes ofthecentral vessels in the retina. Acta Soc Ophthalmol Jpn 1908; 12: 554.
11.Veno A, Awane Y, et al. Successfully operated obliterative brachiocephalic arteritis (Takayasu) associated with elongated coarctation. Jpn Heart J 1967; 8: 538.
12.Lupi-Herrera E, Sanchez TG, et al. Pulmonary artery involvement in Takayasu’s arteritis. Chest 1975; 67: 69.
13.Lupi-Herrera E, Sanchez TG, et al. Takayasu’s arteritis: clinical study of 107 cases Am Heart J 1977; 93: 94–103.
14.Wolfe SM. Takayasu’s arteritis. J Am Med Assoc 1989; 89: 90–94.
15.Lagneau P, Michel JB, Vuong PN. Surgical treatment of Takayasu’s disease. Ann Surg 1987; 205: 157–168.
16.Robbs JV, Human RR. Rajaruthnam P. Operative treatment of nonspecific aortoarteritis (Takayasu’s arteritis). J Vasc Surg 1986;
3:605–616.
17.Bloss RS, Duncan JM, et al. Takayasu’s arteritis: surgical considerations. Ann Thorac Surg 1979; 27: 574.
18.Hodgins GW, Dutton JH. Transluminal dilation for Takayasu’s arteritis. Can J Surg 1984; 27: 355.
19.Hodgins GW, Dutton JH. Subclavian and carotid angiopia sties for Takayasu’s arteritis. Can Assoc Radiol J 1982; 33: 205.
20.Behçet H. Ucher rezidivierende, aphthoese, durch em Virus verursachte Geschwuere am Mund, am Auge und an den Genitalien. Dermatol Monatsschr 1937; 105: 1152–1157.
21.James DG. Behçet’s syndrome. N Engl J Med 1979; 301: 431–432.
22.Enoch BA, Castillo-Olivares JL, et al. Major vascular complications in Behçet’s syndrome. Post Grad Med J 1968; 44: 453–459.
23.Little AG, Zarins CK. Abdominal aortic aneurysm and Behçet’s disease. Surgery 1982; 91: 359–362.
24.Schwartz P, Weisbrot M, et al. Peripheral false aneurysms in Behçet’s disease. Br J Surg 1987; 74: 67–68.
25.Hamia M. Large artery involvement in Behçet’s disease. J Rheumatol 1987; 14: 554–559.
26.Sarkari NBS, MacDonald Holmes J, Bickerstaff ER. Neurological manifestations associated with internal carotid loops and kinks in children. J Neurol Neurosurg Psychiatr 1970; 33: 194–200.
27.Vannix RS, Joergenson FJ, Carter R. Kinking of the internal carotid artery: clinical significance and surgical management. Am J Surg 1977; 134: 82.
28.Quartlebaum JK Jr, Wade JS, Whiddon CM. Stroke associated with elongation and kinking of the carotid artery: long-term fol- low-up. Arch Surg 1973; 177: 572.
29.Freeman RT, Lippitt WH. Carotid artery syndrome due to kinking: surgical treatment in forty-four cases. Am Surg 1962; 28: 745.
30.Stanton PE Jr, McClusky DA Jr, Lamis PA. Hemodynamic assessment and surgical correction of kinking of the internal carotid artery. Surgery 1973; 84: 793.
31.Metz H, Murray-Leslie RM, et al. Kinking ofthe internal carotid artery in relation to cerebrovascular disease. Lancet 1961; 1: 424.
32.McCollum CH, Wheeler WG, et al. Aneurysms of the extracranial carotid artery. Am J Surg 1979; 137: 196.
33.Kirby CK, Johnson J, Donald JG. Aneurysms of the common carotid artery. Ann Surg 1949; 130: 913–920.
34.Mokri B, Piepgras DC, et al. Extracranial internal carotid artery aneurysms. Mayo Clin Proc 1982; 57: 310.
35.Perdue CD, Barreca JP, et al. The significance of elongation and angulation of the carotid artery: a negative view. Surgery 1975;
77:45.
36.Welling RE, Kakkasseril JS, Pechiera J. Pseudoaneurysm of the cervical internal carotid artery secondary to blunt trauma. J Trauma 1985; 25: 1108.
37.Bergamini TM, Seabrook CR, et al. Symptomatic recurrent carotid stenosis and aneurysmal degeneration after endarterectomy. Surgery 1993; 113: 580–586.
38.El-Sabrout R, Cooley DA. Extracranial carotid artery aneurysms: Texas Heart Institute experience. J Vasc Surg 2000; 31: 702–712.
39.Busuttil RW, Davidson RK, et al. Selective management of extra cranial carotid arterial aneurysms. Am J Surg 1980; 140: 85–91.
40.Cooper A. Account of the first successful operation performed on the common carotid artery for aneurysm in the year of 1808 with post mortem examination in the year 1821. Guy’s Hosp Rep 1836; 1: 53.

192 Раздел VIII. Цереброваскулярная недостаточность
41.Webb RC, Barker WE. Aneurysms of the extracranial internal carotid artery. Arch Surg 1969; 99: 501.
42.Ehrenfeld WK, Wylie EJ. Spontaneous dissection of the internal carotid artery. Arch Surg 1976; 111: 1294–1301.
43.Bogousslavshy J, Despland P, Regli E. Spontaneous carotid dissection with acute stroke. Arch Neurol 1987; 44: 137.
44.Bradac GB, Kaerobach A, et al. Spontaneous dissecting aneurysm of cervical cerebral arteries. Neuroradiology 1981; 21: 149–154.
45.Petro CR, Witwer CA, et al. Spontaneous dissection of the cervical internal carotid artery: correlation of arteriography, CT and pathology. Am J Radiol 1987; 148: 393.
46.Goldberg HI, Grossman RI, et al. Cervical internal carotid artery dissecting hemorrhage: diagnosis using MR. Radiology 1986;
158:157.
47.McNeill DH, Dreisbach J, Marsden RI. Spontaneous dissection of the internal carotid artery: its conservative management with heparin sodium. Arch Neurol 1980; 37: 54.
48.Miyamoto S, Kikuchi H, et al. Surgical treatment for spontaneous carotid dissection with impending stroke. J Neurol 1984;
61:382.
49.Ehrenfeld WK, Wylie EJ. Fibromuscular dysplasia of the internal carotid artery: surgical management. Arch Surg 1974; 109: 676.
50.Stanley JC, Gewertz BL, et al. Arterial fibrodysplasia: histopathologic character and current etiologic concepts. Arch Surg 1975;
110:561.
51.Osborn AG, Anderson RE. Angiographic spectrum of cervical and intracranial fibromuscular dysplasia. Stroke 1977; 8: 617.
52.Manalo-Estrella P, Barker AE. Histopathologic findings in human aortic media associated with pregnancy: a study of 16 cases. Arch Pathol 1967; 83: 336.
53.Irey NS, Norris HJ. Intimal vascular lesions associated with femal reproductive steroids. Arch Pathol 1973; 96: 227.
54.Effeney DH, Ehrenfeld WK, et al. Fibromuscular dysplasia of the internal carotid artery. World J Surg 1979; 3: 179–186.
55.Effeney DJ, Ehrenfeld WK, et al. Why operate on carotid fibromuscular dysplasia? Arch Surg 1980; 115: 1261.
56.Smith LL, Smith DC, et al. Operative balloon angioplasty in the treatment of internal carotid artery fibromuscular dysplasia. J Vasc Surg 1987; 6: 482.
57.Glenner GG, Grimely PM. Tumors of the extraadrenal paraganglion system (including chemoreceptors). In: Atlas of Tumor Pathology, second series, fasc 9. Washington, DC: Armed Forces Institute of Pathology, 1973.
58.Daly MD, Lambertsen CJ, Schwietzer A. Observations on the volume of blood flow and oxygen utilization of the carotid body in the cat. J Physiol 1954; 125: 67–89.
59.Pacheco-Oieda L, Durango E, et al. Carotid body tumors at high altitudes: Quito, Ecuador, 1987. World J Surg 1988; 12: 856–860.
60.Dent TL, Thompson NW, Fry WJ. Carotid body tumors. Surgery 1976; 80: 365–372.
61.Lack FE, Cubilla AL, et al. Paragangliomas of the neck and head region: a clinical study of 69 patients. Cancer 1977; 39: 397–409.
62.Lahey FH, Warren KW. Tumors of the carotid body. Surg Gynecol Obstet 1947; 85: 281–288.
63.Schick PM, Hieshima GB, et al. Arterial catheter embolization followed by surgery for large chemodectoma. Surgery 1980; 87: 459–464.
64.Hallett JW, Nora JD, et al. Trends in neurovascular complications of surgical management for carotid body and cervical paragangliomas: a fifty-year experience with 153 tumors. J Vasc Surg 1988; 7: 284–291.
65.Silverberg GD, Britt BH, Goffinet RD. Radiation induced carotid artery disease. Cancer 1978; 41: 130–137.
66.Moritz MW, Higgins RF, Jacobs JR. Duplex imaging and incidence of carotid radiation injury after high-dose radiotherapy for tumors of the head and neck. Arch Surg 1990; 125: 1181–1183.
67.Fonkalsrud EW, Sanchez R, et al. Serial changes in arterial structure following radiation therapy. Surg Gynecol Obstet 1977; 145: 395.
68.Marcial-Rojas RA, Castro JR. Irradiation injury to elastic arteries in the course of treatment for neoplastic disease. Ann Otol 1962; 71: 945–958.
69.McCready RA, Hyde GL, et al. Radiation-induced arterial injuries. Surgery 1983; 93: 306–312.
70.Elerding SC, Fernandez RN, et al. Carotid artery disease following external cervical irradiation. Ann Surg 1981; 194: 609–615.
71.Stoney RJ, String ST. Recurrent carotid stenosis. Surgery 1976; 80: 705–710.
72.Zierler RE, Bandyk DF, et al. Carotid artery stenosis following endarterectomy. Arch Surg 1982; 117: 1408–1415.
73.Chervu A, Moore WS. An overview of intimal hyperplasia. Surg Gynecol Obstet 1990; 171: 433–447.
74.Clowes AW, Clowes MM, et al. Regulation of smooth muscle cell growth in injured artery. J Cardiovasc Pharmacol 1989; 14(Suppl 6): 512–515.
75.Kinney EV, Seabrook GR, et al. The importance of intraoperative detection of residual flow abnormalities after carotid artery endarterectomy. J Vasc Surg 1993; 17: 912–923.
76.O’Hara PJ, Hertzer NR, et al. Reoperation for recurrent carotid stenosis: early results and late outcome in 1999 patients. J Vasc Surg 2001; 34: 5–12.

Раздел IX
Сосуды внутренних органов
