
- •Кафедра «Производство строительных изделий и конструкций»
- •1. Введение
- •1.1. Общие сведения о вяжущих веществах, их значение для народного хозяйства
- •1.2. Краткие сведения о развитии производства вяжущих веществ
- •1.3. Классификация и номенклатура минеральных вяжущих материалов
- •2. Гипсовые и ангидритовые вяжущие
- •2.1. Сырье для производства гипсовых вяжущих
- •2.2. Дегидратация двуводного гипса и модификации водного и безводного СаSо4
- •2.3. Технология производства гипсовых вяжущих
- •2.4. Твердение гипсовых вяжущих
- •2.5. Свойства гипсовых вяжущих и их применение
- •2.6. Ангидритовые вяжущие вещества
- •3. Воздушная строительная известь
- •3.1. Разновидности строительной извести, ее состав
- •3.2. Сырьевые материалы для производства строительной воздушной извести
- •3.3. Технология производства строительной извести
- •3.4. Виды твердения воздушной строительной извести
- •3.5. Свойства строительной извести и ее применение
- •4. Магнезиальные вяжущие вещества
- •4.1. Сырье для производства магнезиальных вяжущих веществ
- •4.2. Производство каустического магнезита и каустического доломита
- •4.3. Твердение магнезиальных вяжущих веществ
- •4.4. Свойства магнезиальных вяжущих веществ
- •4.5. Применение магнезиальных вяжущих веществ
- •5. Гидравлическая известь
- •6. Портландцемент
- •6.1. Общая характеристика и вещественный состав портландцемента
- •6.2. Химический и минеральный состав клинкера
- •6.3. Сырьевые материалы для производства портландцемента
- •7. Технология производства портландцемента
- •7.1. Способы производства портландцемента
- •7.2. Добыча и транспортирование сырьевых материалов
- •7.3. Складирование сырья, добавок, топлива
- •7.4. Измельчение материалов и приготовление сырьевой смеси
- •7.5. Обжиг сырьевой смеси и получение клинкера
- •7.6. Помол клинкера и добавок и получение портландцемента
- •8. Физико-химические основы схватывания и твердения портландцемента. Структура цементного теста и камня
- •8.1. Взаимодействие цемента с водой и химический состав новообразований
- •8.2. Теория твердения портландцемента
- •8.3. Формирование структуры и свойств цементного теста
- •8.3. Структура цементного камня
- •10. Стойкость портландцемента к химической коррозии
- •11. Разновидностипортландцемента
- •11.1 Быстротвердеющий и высокопрочный портландцементы
- •11.2. Портландцемент с поверхностно-активными добавками
- •11.3. Сульфатостойкий портландцемент
- •11.4. Портландцемент с умеренной экзотермией
- •11.5. Портландцемент для дорожного строительства
- •11.5. Портландцемент для производства асбестоцементных изделий
- •11.6. Белый и цветные портландцементы
- •12. Многокомпонентные цементы с природными минеральными добавками
- •12.1. Активные минеральные добавки
- •12.2. Пуццолановый портландцемент
- •12.3. Известково-пуццолановое вяжущее вещество
- •12.4. Цементы с микронаполнителями
- •12.5. Композиционные гипсовые вяжущие
- •13. Шлаковые цементы
- •13.1. Шлаки и их свойства
- •13.2. Шлакопортландцемент
- •13.3. Извсстково-шлаковое вяжущее
- •13.4. Известково-зольное вяжущее
- •13.5. Сульфатно-шлаковые вяжущие
- •14. Цементы из специальных клинкеров
- •14.1. Глиноземистый цемент
- •14.2. Расширяющиеся и напрягающие цементы
- •14.3. Сверхбыстротвердеющие цементы
- •15. Органические вяжущие вещества
- •15.1. Полимерные вяжущие
- •15.2. Битумные и дегтевые вяжущие
- •15.3. Неорганические вяжущие с добавками полимерных веществ
2.2. Дегидратация двуводного гипса и модификации водного и безводного СаSо4
Двуводный гипс по мере повышения температуры постепенно дегидратируется и переходит в безводное состояние, превращаясь в итоге в нерастворимое соединение. Регулируя температуру обжига, получают гипсовые вяжущие, отличающиеся строительно-техническими свойствами. Степень дегидратации двуводного гипса зависит от температуры и длительности тепловой обработки, а также от давления водяных паров. Продукт тепловой обработки практически представляет собой смесь отдельных фаз системы CaSO4–H2O. Термические превращения двуводного гипса могут быть представлены схемой.
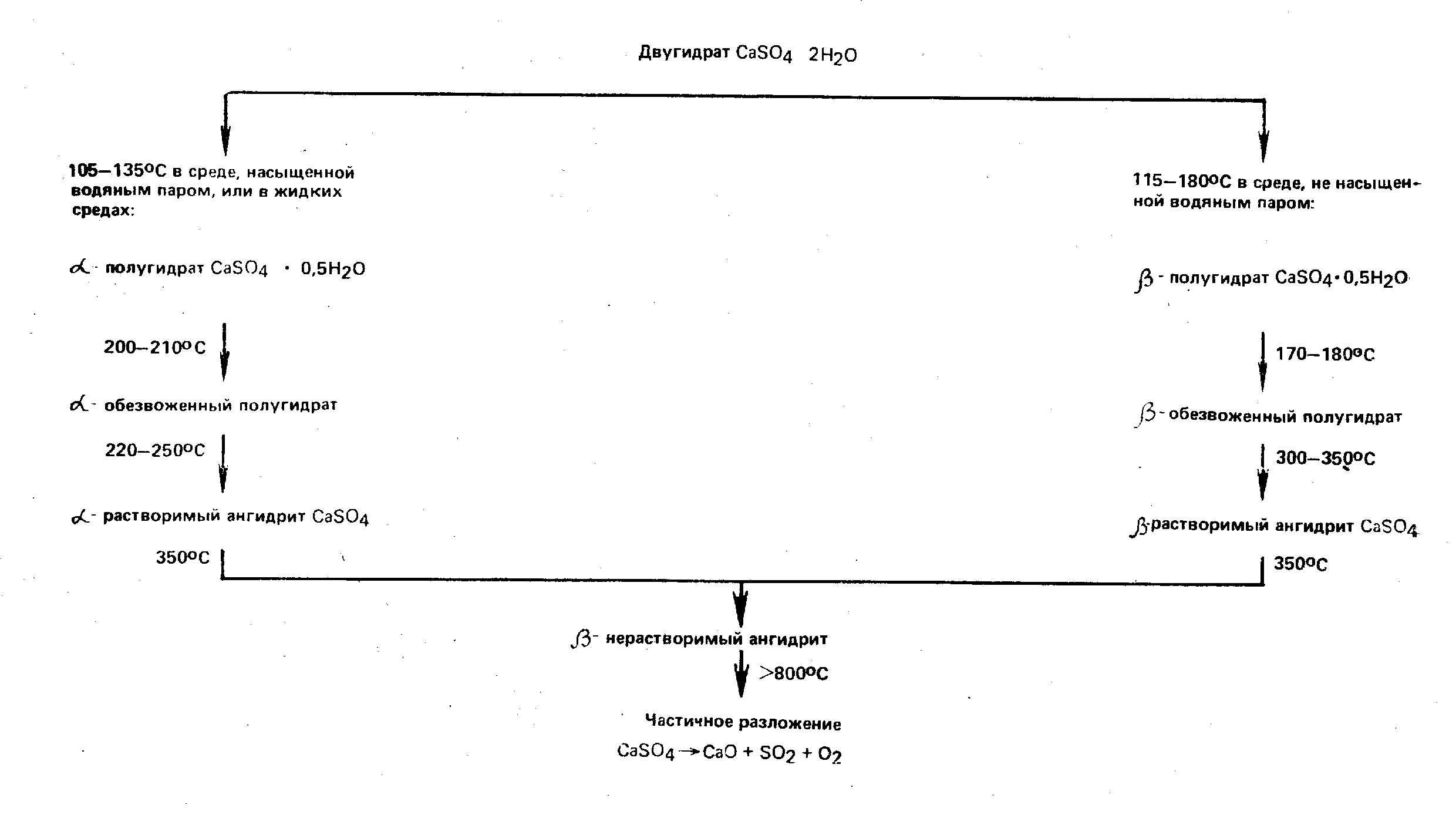
При 105—135 °С двуводный гипс сравнительно быстро теряет кристаллизационную воду и переходит в полугидрат. С дальнейшим повышением температуры гипс постепенно превращается в безводную модификацию — обезвоженный полугидрат, который, в свою очередь, переходит в растворимый ангидрит. Полуводный гипс, а также обезвоженный полугидрат и растворимый ангидрит могут существовать в виде α- и -модификаций, отличающихся своей структурой. α -полугидрат образуется в результате тепловой обработки гипсового камня при температуре выше 100°С в среде насыщенного пара, а также при кипячении его в растворах солей. Отщепляемая вода удаляется из гипса в жидком состоянии и не вызывает разрыхления или разрушения зерен, что обеспечивает плотную упаковку и гладкий рельеф поверхности кристаллов α -полугидрата. -полугидрат получают, если вода при дегидратации выходит в виде пара, что приводит к сильному механическому диспергированию зерен, образованию шероховатого, «изъеденного» рельефа поверхности. Его кристаллы тем мельче, чем ниже давление водяного пара и выше температура. Структурные отличия заметно отражаются на свойствах α- и -модификаций полуводного гипса. -полугидрат характеризуется повышенной растворимостью в воде, большей скоростью гидратации, для получения подвижного гипсового теста он требует большего количества воды (50—70 % массы гипса), для α -полугидрата достаточно 30—45% воды.
При переходе полугидратов в обезвоженные полугидраты тип кристаллической решетки не меняется, однако резко снижается степень ее упорядоченности и в результате водопотребность возрастает на 5—6 %. При воздушном хранении обезвоженные полугидраты легко поглощают влагу и превращаются в водные полугидраты.
Переход обезвоженных полугидратов в растворимые ангидриты сопровождается перестройкой моноклинной кристаллической решетки в ромбическую. Растворимый ангидрит отличается высокой удельной поверхностью и пористостью, поэтому требует воды на 25—30 % больше, чем полугидраты, и создает камень меньшей прочности. При тепловой обработке гипсового камня следует избегать образования растворимого ангидрита.
Начиная с 400°С растворимый ангидрит переходит в нерастворимый, «намертво» обожженный, который почти совсем не схватывается. Этот переход происходит без изменения кристаллической решетки, но сопровождается интенсивным снижением удельной поверхности и соответственно уменьшением водопотребности, удлинением сроков схватывания и продолжительности твердения вяжущего. С повышением температуры до 900—1000 °С безводный гипс снова приобретает способность схватываться и твердеть. Начинается частичная диссоциация сернокислого кальция, и в составе продукта обжига появляется свободная известь.
В зависимости от вида сырья, режима обжига и других факторов кристаллы каждой модификации сульфата кальция могут в известных пределах отличаться друг от друга формой, размером и свойствами. В целом все известные модификации сульфата кальция имеют три типа кристаллических решеток: двуводного гипса, полугидрата и ангидрита. Их общий структурный элемент— цепочки Са — SO4—Са— SO4. При обезвоживании полугидрата ионы в них преимущественно сохраняют свою ориентацию, но в то же время смещаются перпендикулярно или параллельно направлению цепочек. При обезвоживании двугидрата до полугидрата или растворимого ангидрита расстояние между ионами Са2+ и SO42- несколько увеличивается, а при образовании нерастворимого ангидрита уменьшается.
