
23209 (1)
.pdfПри физической абсорбции процесс поглощения не сопровождается химиче-
ской реакцией.
При хемосорбции абсорбируемый компонент вступает в химическую реакцию с веществом абсорбента.
Согласно закону Генри растворимость газа в жидкости пропорцио-
нальна давлению, под которым газ находится, но при условии, что газ при растворении не образует новых соединений и молекулы его неполимеризуются.
Всякое плотное тело сгущает довольно значительно прилегающие не-
посредственно к его поверхности частицы окружающего его газообразного вещества. Если такое тело пористое, как например,древесный угольили губ-
чатаяплатина, то это уплотнение газов имеет место и по всей внутренней по-
верхности его пор, а тем самым, следовательно, и в гораздо более высокой степени. При всяком уплотнении выделяется тепло.
Вещества, которые абсорбируют-поглощают из воздуха водяной пар,
сгущают его тоже в себе, образуя воду, и от этого становятся влажными, как,
например, нечистая поваренная соль, поташ, хлористый кальций и т.п. Такие тела зовутся гигроскопическими.
Чем легче газ сгущается в жидкость, тем сильнее он поглощается. При малом наружном давлении и при нагреванииуменьшается количество по-
глощаемого газа. Чем мельче поры поглотителя, т.е. чем он плотнее, тем большею, в общем, он обладает поглотительной способностью; слишком од-
нако же мелкие поры, как например графита, не благоприятствуют абсорб-
ции.
По закону Дальтона из смеси газов каждый газ растворяется в жидко-
сти пропорционально своему парциальному давлению, вне зависимости от присутствия остальных газов. Степень растворения газов в жидкости опреде-
ляется коэффициентом, показывающим, сколько объёмов газа поглощается в одном объёме жидкости при температуре газа 0° и давлении в 760 мм ртутно-
го столба.
Коэффициенты абсорбции для газов и воды 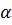 вычисляются по формуле
вычисляются по формуле

, |
(1) |
где -температура газа, 0С;
А,В,С – постоянные коэффициенты, определяемые для каждого от-
дельного газа.
По исследованиям Бунзена коэффициенты важнейших газов имеют значения, представленные в таблице1.
В качестве адсорбентов применяют пористые вещества с большой удельной поверхностью, обычно относимой к единице массы вещества. Ад-
сорбенты характеризуются своей поглотительной или адсорбционной спо-
собностью. Для осушки воздуха наиболее часто применяют силикагель, ко-
торый представляет собой продукты обезвоживания геля кремниевой кисло-
ты, получаемые путем обработки раствора силиката натрия (растворимого стекла) минеральными кислотами.
Таблица 1. Коэффициенты определяющие поглотительную способ-
ность газов
|
|
|
|
Действительны |
Вид газа |
А |
В |
С |
при , 0C |
|
|
|
|
|
|
|
|
|
|
Cl |
+3,0361 |
-0,046196 |
+0,0001107 |
0…40 |
|
|
|
|
|
CO |
+1,796 |
-0,07761 |
+0,0016424 |
0…20 |
|
|
|
|
|
O |
+0,4115 |
-0,00108986 |
-0,000022563 |
0…20 |
|
|
|
|
|
H2S |
+4,3706 |
-0,083687 |
+0,0005213 |
0…40 |
|
|
|
|
|
N |
+0,020346 |
0,.00005388 |
+0,000011156 |
0…20 |
|
|
|
|
|
H |
+0,0193 |
- |
- |
0…20 |
|
|
|
|
|
Удельная поверхность силикагелей от 400 до 770 м2/г. Размер гранул от
0,2 до 7 мм, насыпная плотность 400…800 г/л. Обводненность силикагеля в конце периода его эффективной работы достигает 9…11 % от общей его мас-
сы. При помощи силикагеля достигается глубокое осушение воздуха, харак-
теризуемое конечным влагосодержанием 0,02 г/кг, чему соответствует тем-
пература точки росы осушенного воздуха минус 50 °С. Однако по мере ув-
лажнения силикагеля эффективность осушки уменьшается, и при достиже-
нии предельной влажности слой сорбента прекращает поглощение влаги из воздуха.
Для восстановления адсорбционных свойств сорбент подвергают акти-
вации путем удаления из капилляров, накопившейся в них влаги. Активацию производят нагревом сорбента до температуры выше 100 °С или продувкой через слой сорбента горячего воздуха, имеющего температуру 150…180 °С.
Сущность адсорбции влаги из воздуха состоит в следующем. Водяной пар, адсорбированный поверхностью капилляра и сконденсировавшийся на ней, образуют в капилляре вогнутый мениск воды. Парциальное давление насыщенного водяного пара над вогнутой поверхностью воды ниже, чем над плоской поверхностью при той же температуре. Вследствие этого пар из воз-
духа будет диффундировать в полость капилляров и там конденсироваться.
Интенсивность осушки воздуха твердыми сорбентами определяется разно-
стью парциальных давлений насыщенного водяного пара над поверхностью мениска в капилляре и водяного пара в осушаемом воздухе. Этот перепад давлений зависит от диаметра капилляров, определяющих кривизну мениска,
температуры и влагосодержания осушаемого воздуха.
При повышении температуры воздуха или снижении парциального давления водяного пара в осушаемом воздухе интенсивность осушки снижа-
ется, так как в результате действия каждого из этих факторов уменьшается разность между парциальными давлениями водяного пара в осушаемом воз-
духе и на поверхности мениска в капилляре. При некоторой температуре эти давления могут стать одинаковыми, и тогда перенос влаги прекратится. При дальнейшем повышении температуры сорбента парциальное давление насы-
щенного водяного пара над мениском воды в капиллярах станет выше давле-
ния водяного пара в воздухе, и тогда начинается обратный процесс переноса влаги из капилляров сорбента в воздух. Это свойство используется при вос-
становлении влагопоглотительной способности (активации) сорбентов.
В процессе тепло-и массообмена при осушении воздуха адсорбентами выделяется теплота сорбции, которая состоит из скрытой теплоты конденса-
ции и теплоты смачивания, освобождавшейся при контакте жидкой и твердой поверхностей. В результате преобразования скрытой теплоты в явную темпе-
ратура осушаемого воздуха повышается и может достигнуть 40…50 °С, что является недостатком твердых сорбентов. Обычно процесс осушения воздуха адсорбентами изображается в I-d диаграмме по линии I = const
Согласно существующей методике определения эффективности работы сорбционной установки определяют необходимое количестве сорбента, пло-
щадь лобового сечения слоя сорбента и его толщину.
Количество влаги, подлежащей удалению из воздуха определяется по зависимости:
W = G (d1 − d2)∙τc, |
(2) |
где G − расход воздуха, кг/с;
d1, d2 − соответственно начальное и конечное влагосодержание возду-
ха, кг/кг;
τc − длительность цикла адсорбции влаги, с;
Требуемая масса Gс и объем Vc адсорбента определяется по формулам:
Gс = W/αс; |
(3) |
Vc = Gс/ρс, |
(4) |
где αc − сорбционная способность, для силикагеля αc = 0,1;
ρс − плотность насыпного слоя сорбента, кг/м3, для силикагеля ρс = 600
кг/м3.
Фильтрующая поверхность Fс, определяется из формулы:
Gc ρc w Fc , |
(5) |
|||||
где w – скорость воздуха, м/с. |
|
|
|
|
|
|
Толщина слоя адсорбента равна: |
|
|
||||
δ |
|
|
Vc |
, |
(6) |
|
с |
Fc |
|||||
|
|
|
|
|||
|
|
|
|
|
||
Приблизительно толщину слоя при w = 0,15…0,5 м/с можно опреде- |
||||||
лить по приблизительной формуле: |
|
|
|
|
|
|
δс = 0,07(d1 − d2)∙τC∙w |
(7) |
|||||
Аэродинамическое сопротивление слоя силикагеля определяется по
формуле: |
|
р = 9,81δс∙w1,5 |
(8) |
3. ОПИСАНИЕ ЭКСПЕРЕМЕНТАЛЬНОЙ УСТАНОВКИ
Схема экспериментальной установки приведена на рисунке 1.
Установка представляет собой закрытый корпус 1 с разветвленным воз-
душным каналом 2 внутри и встроенным вентилятором. Выходные каналы воздушной системы прикрыты решеткой 3 и регулятором воздушного потока
5 через адсорбент 4. Входной канал так же оснащен защитной решеткой 6.
Контроль энергопотребления можно осуществлять с помощью встроенного амперметра 7.
Работает установка следующим образом: поток влажного воздуха вса-
сывается в установку через отверстие при помощи вентилятора, далее воздух попадает в каналы выходные диаметром 110 мм ,расход воздуха через аб-
сорбент регулируется при помощи клапана 5. Част воздуха, проходящего че-
рез адсорбент осушается и выбрасывается в окружающую среду.
Контроль влажности воздуха осуществляется электронным измерителем влажности. Скорость воздушного потока - электронным анемометром.
Рисунок 1. Схема лабораторной установки
4.ПОДГОТОВКА УСТАНОВКИ К РАБОТЕ
4.1.Включить электрический увлажнитель воздуха на максимальный
режим.
4.2.Поставить в непосредственной близости лабораторную установку от увлажнителя воздуха.
4.3.Включить установку в сеть
4.4.Тумблером включить установку.
5.ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
5.1Ознакомиться с конструкцией лабораторной установки.
5.2Убедится в исправности установки и наличии измерительных
приборов.
5.3Подготовить лабораторную установку к пуску, подключить электропитание установки ( 220 В).
5.4Включить установку тумблером (8), циркуляционный насос термостата – тумблером (9). По истечении 2…3 мин осуществить отсчет времени работы установки с помощью секундомера.
5.5С помощью измерителя влажности каждые 5 минут измерять параметры воздуха на входе и на выходе установки (температуру и относительную влажность).
5.6При установленном положении регулятора расхода воздуха каждые 5 минут определять скорость воздушного потока через адсорбент с помощью электронного анемометра.
5.9Повторить опыт для вновь заданного (отличного от предыдущего) расхода воздуха.
5.10Выключить установку. Таблица 2 Ведомость эксперимента
№ |
|
,0C |
|
,0C |
|
, с |
м/с |
,% |
,% |
||
п/п |
|
|
|
|
|
1
…
10

6.ЗАДАНИЕ ПО РАБОТЕ
6.1.Записать данные показаний приборов ведомость эксперимента.
6.2 Определить с помощью H-d диаграммы влажного воздуха влагосодержание воздуха на входе и на выходе установки согласно показаниям измерителя влажности.
6.3. Рассчитать по формулам (2)…(8) искомые параметры.
6.4Занести результаты расчетов в таблицу 3.
6.5Записать вывод о проделанной работе.
Таблица 3. Результаты обработки опытных данных
№ п/п , кг/кг |
, кг/кг |
, кг/с |
, м2 |
, м |
, Па |
1…
…10
7. СОСТАВЛЕНИЕ ОТЧЕТА
Отчет выполняется в тетради. Он должен содержать в себе принципиальную схему установки, ведомость испытаний, расчетные формулы и примеры расчетов одного режима.
8.КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАНИЯ
1.Что такое абсорбция?
2.Что такое адсорбция?
3.Назовите движущие силы сорбционных процессов.
4.Укажите зависимость коэффициента поглотительной способности сорбента от его природы.
5.Напишите уравнение Генри.
6.Объясните устройство и принцип действия лабораторной установки.
7.Назовите виды осушки влажного воздуха.
8.Что такое «влагосодержание» и «относительная влажность» воздуха?
9.Какие требования предъявляются к сорбентам?
10.Изобразите изотермическую осушку воздуха на H-d диаграмме влажного воздуха.
Лабораторная работа №14 «Исследование тепломассообменных процессов при ректификации»
1. ЦЕЛЬ РАБОТЫ
Определение основных парметров, характеризующих тепломассооб-
менные процессы при ректификации спирта.
2. ОБЩИЕ СВЕДЕНИЯ
Всем хорошо известно, что этиловый спирт находит широкое примене-
ние не только как пищевой продукт, используемый для приготовления на-
питков, но и как консервирующее средство в заготовках плодов, ягод и со-
ков. Он незаменим при изготовлении лекарственных настоек, стимулирует кровообращение, и поэтому применяется как эффективное средство для ком-
прессов и растирок.
Этиловый спирт (этанол или винный спирт) - С2Н5ОН - бесцветная жид-
кость с характерным запахом. Получается сбраживанием пищевого сырья,
гидролизом растительных материалов и синтетически - гидратацией этилена.
Очищается ректификацией.
Синтетический путь получения этанола (из газа этилена) технически дос-
таточно сложен, а результатом является технический спирт-ректификат, со-
держащий некоторое количество не отделяемых ректификацией примесей.
Этот путь широко применяется в промышленности.
Другой путь получения спирта более доступен и связан с технологией сбраживания простых сахаров дрожжами. Именно так получается обычное вино и именно поэтому первое имя этилового спирта - винный спирт. Хими-
ческая формула этого превращения в очень упрощенном виде выглядит так: С6Н1206 = 2С2Н5ОН + 2С02 + ТЕПЛО (1)
То есть из одной молекулы сахара с помощью дрожжевых клеток обра-
зуется две молекулы этилового спирта, две молекулы углекислого газа и вы-
деляется приличное количество тепла. Для определения соотношения массо-
вых превращений достаточно подставить в предыдущую химическую фор-
мулу мольные массы атомов водорода Н=1, углерода С=12 и кислорода 0=16:
(12-6+1-12+166) = 2(12-2+1 5+16+1) + 2(12+ 16-2),
или
180 = 92 + 88;
и тогда можно сделать вывод, что из 180кг сахара получается 92кг спирта и
88кг углекислого газа. Таким образом, теоретический выход спирта из сахара составляет 92/180=0,511 кг/кг, или, с учетом плотности этилового спирта (р = 0,8кг/л), - 0,639л/кг.
1кг (сахар) ► 0, 639л (спирт)
Если спирт получают не из сахара, а из сахаросодержащего сырья (ви-
ноград, сахарная свекла, топинамбур и т.д.), то, зная сахаристость продукта,
легко определить выход из него спирта. Так, например, если яблоки содержат
12% сахара, то теоретический выход спирта из сока этого сырья (выход сока из яблок составляет 70%) будет равен 54мл/кг
1кг (яблоки) ► 0,7кг (сок) ► 0,084кг (сахар) ► 0,054л (спирт).
Чаще всего спирт получают из крахмалосодержащего сырья (карто-
фель, зерно и т.д.). Тогда в технологической цепочке приготовления спирта появляется процесс осахаривания крахмала - превращение (гидролиз) крах-
мала под воздействием определенных ферментов в сахар, после чего произ-
водится его сбраживание (С6Н10О5)п + п-Н20 + ФЕРМЕНТ = п-С6 Н1206, (2)
Практический выход спирта всегда на 10... 15% меньше теоретического.
Такие потери считаются нормальными и, главным образом, связаны с:
-«недобродом», то есть с ситуацией, когда часть сахара остается в бражке
ине превращается в спирт;
-неправильным брожением, то есть когда часть сахара превращается не в спирт, а в некоторые другие вещества - примеси;
-прямыми потерями, когда часть спирта просто улетучивается вместе с углекислым газом в процессе брожения, или теряется при перегонке и рек-
тификации.
В таблице 1 приведены ориентировочные значения практического выхо-
да пищевого спирта (в миллилитрах) из одного килограмма исходного сырья.
Таблица 1 Выход спирта из различных видов сырья при 15% потерь на
всей технологической цепочке
|
Спирт, |
|
Спирт, |
|
Спирт, |
|
Спирт, |
|
Сырьё |
мл/кг |
Сырьё |
мл/кг |
Сырьё |
мл/кг |
Сырьё |
мл/кг |
|
|
|
|
|
|
|
|
|
|
Крахмал |
603 |
Кукуруза |
420 |
Рожь |
300 |
Сахар |
543 |
|
|
|
|
|
|
|
|
|
|
Горох |
220 |
Купырь |
80 |
Сорго |
440 |
Виноград |
110 |
|
|
|
|
|
|
|
|
|
|
Гречиха |
430 |
Овес |
260 |
Фасоль |
340 |
Инжир |
110 |
|
|
|
|
|
|
|
|
|
|
Жёлуди |
210 |
Просо |
250 |
Чечевица |
310 |
Меласса |
270 |
|
|
|
|
|
|
|
|
|
|
Картофель 20 |
120 |
Пшеница |
360 |
Чистяк |
70 |
Свёкла сах. |
100 |
|
|
|
|
|
|
|
|
|
|
Картофель 15 |
90 |
Пшено |
400 |
Чумиза |
360 |
Топинам- |
120 |
|
бур |
||||||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Каштаны/к |
210 |
Рис |
460 |
Ячмень |
350 |
Яблоки |
60 |
|
|
|
|
|
|
|
|
|
Практический выход в значительной степени зависит от содержания крахмала или сахара в реальном сырье, от точности соблюдения технологи-
ческого процесса приготовления бражки, а также от требований, предъяв-
ляемых к качеству получаемого спирта.
Для приготовления бражек можно использовать некондиционное сырье:
частично подгоревшее зерно, подгнившие фрукты, мороженый картофель и т.п. Однако при этом необходимо помнить, что чем выше качество исходного сырья, тем выше качество получаемого из него спирта.
Перегонка бражки
Простая перегонка (дистилляция) - процесс, при котором происходит од-
нократное испарение наиболее летучих компонентов из кубовой жидкости и однократная конденсация этих паров.
При кажущейся простоте процесс перегонки бражки является весьма от-
ветственным в общей технологической схеме получения спирта. Точность соблюдения технологии перегонки определяет качество спирта-сырца, и, в
конечном итоге, качество спирта-ректификата. Дело в том, что среди много-
численных вредных примесей, содержащихся в спирте-сырце (а
