
20
.docxБилет №20
-
Запишите уравнение гидролиза FeC
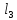
-
FeC
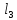 + HOH →
+ HOH →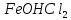
F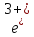 +3C
+3C +
+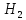 O→
FeO
O→
FeO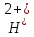 +2
C
+2
C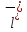 +
+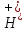 +
C
+
C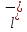
F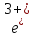 +
+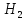 O→
FeO
O→
FeO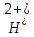 +
+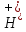
-
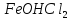 +
HOH→Fe
+
HOH→Fe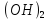 Cl+HCl
Cl+HCl
FeO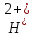 +2
C
+2
C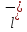 +
+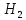 O→Fe
O→Fe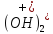 +
C
+
C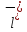 +
+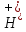 +
C
+
C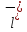
FeO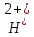 +
+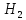 O→Fe
O→Fe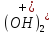 +
+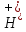
-
Fe
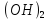 Cl+
HOH→ Fe
Cl+
HOH→ Fe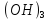 +HCl
+HCl
Fe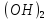 +
+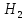 O→
Fe
O→
Fe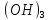 +
+
-
Запишите ур-я диссоциации кислых и основных солей.
При растворении
кислых солей в растворе оразуются
катионы Me
и сложные ионы кислотного остатка,
которые в свою очередь подвергаются
диссоциации с образованием
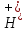 :
:
Na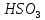 →
→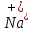 +
+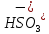
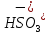 →
→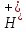 +
+
При диссоциации основных солей образуются анионы кислоты основных и сложные катионы , сост. Из Me и гидроксильной группы :
ZnOHCl→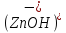 +
C
+
C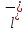
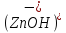 →
Z
→
Z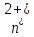 +
+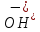
-
Поясните уравнение скорости хим. р-ции.
Скорость хим. Р-ции – это изменение концентрации исходных веществ за единицу времени.
V=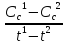
4.Рассчитайте моляльность 30% раствора серной кислоты.
Пусть нам дано 100 г раствора (серной кислоты), тогда m(H2SO4)= 30г
n(H2SO4)= 30г/98(г/моль)=0,306моль
Масса растворителя= 70 г
Сm= (0,306/70)*1000= 4,37 моль/кг
Сm=1000*C%/M*(100-C%) (сокращенная формула нахождения моляльности)
М- молярная масса растворенного вещества
С-его концентрация
5.
Рассчитайте величину степени гидролиза NH4Cl в 10%-ном Р-ре.
Пусть нам дано 1000 г раствора , тогда m(NH4Cl)=100г
N(NH4Cl)=100/53.5=1.8 моль/л
CM=1.8 моль/л
Кдис=1,75*10^-5
NH4Cl+HO→NH4OH+HCl
NH4(+) + H2O→ NH4OH+H(+)
Kh(константа гидролиза) = Kw/Kd(NH4Cl)= 10^(–14)/ 1,75*10^-5=5,7*10(-10)
Kw = 10^(–14) – ионное произведение воды при 25°С
h (степень гидролиза)= Sqrt(Kh/CM)= Sqrt(5,7*10(-10)/ 1.8 моль/л)=1.8*10(-5)
