
- •Альдегиды
- •Фармакологические свойства
- •Химические свойства
- •I. Реакции окисления.
- •II. Реакции нуклеофильного присоединения.
- •Получение
- •Описание
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Хлоралгидрат
- •Получение
- •Описание
- •Растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Чистота
- •Хранение
- •Применение
- •Углеводы: моносахариды и полисахариды. Общие понятия о группе.
- •Анализ химической структуры моносахаридов.
- •Изомерия моносахаридов.
- •Характеристика химической активности углеводов.
- •Превращения под действием кислот и щелочей.
- •Глюкоза (декстроза) Glucosum
- •Описание
- •Подлинность
- •Чистота
- •Количественное определение По фс сахара в порошке количественно не определяют
- •Хранение
- •Применение
- •Особенности приготовления и контроля качества в условиях аптек
- •Характеристика химической активности
- •Применение
- •Сахароза Sacharum (мнн)
- •Описание
- •Химические свойства.
- •Подлинность
- •Описание
- •Подлинность
- •Применение
Подлинность
устанавливают по продуктам щелочного распада хлоралгидрата
ФС щелочной гидролиз (гидролитическое разложение) при комнатной температуре:
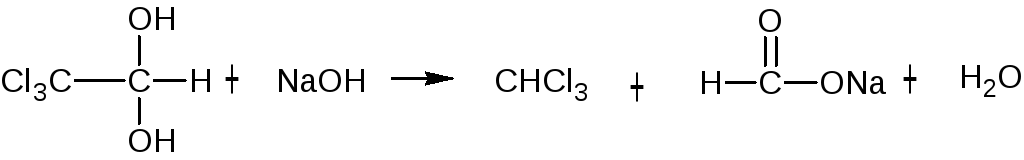
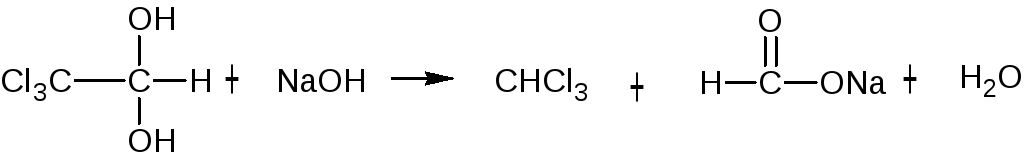
при добавлении к раствору ЛВ щелочи образуется натрия формиат и хлороформ (обнаруживается по запаху и помутнению жидкости):
ФС Реакция "серебряного зеркала"с реактивом Толленса (альдегидная группа).
При добавлении к щелочному раствору хлоралгидрата аммиачного раствора нитрата серебра мгновенно (без нагревания) выпадает черный осадок серебра.
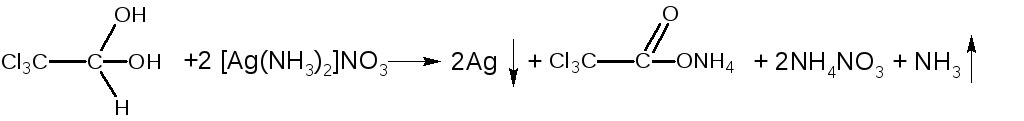
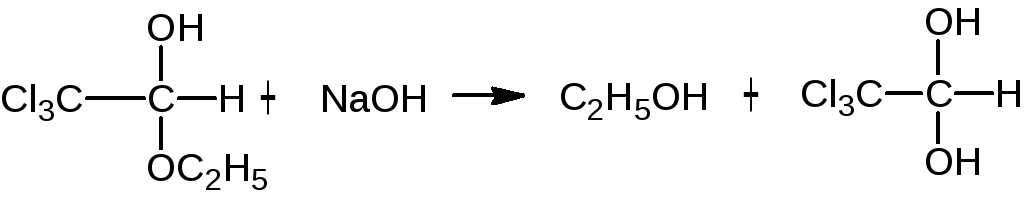
Гидролитическое разложение при нагревании с раствором щелочи (ковалентно связанный хлор):
Если щелочной раствор ХГ нагреть и после добавить нитрат серебра, то выпадет белый творожистый осадок хлорида серебра.
CHCl3 + 4NaOH → 3NaCl + HCOONa + H2O
NaCl + AgNO3 → AgCl↓ + NaNO3
Чистота
Т°плав.
Прозрачность и цветность раствора
избыточная кислотность – с метилоранжем раствор должен окраситься в желтый цвет( рН = 3,0-4,4).
в определенных пределах допускаются примеси хлоридов, тяжелых металлов, сульфатной золы.
специфические примеси (исходя из процесса получения):
возможная примесь промежуточного продукта получения – хлоралалкоголята (недопустимая).
Открывают реакцией «йодоформной пробы» после щелочного разложения. После добавления гидроксида натрия и йода не должен ощущаться запах йодоформа и выпадать желтый осадок:
![]()
Количественное определение
ФС метод обратной алкалиметрии. Метод основан на реакции щелочного гидролитического разложения хлоралгидрата избытком стандартного раствора гидроксида натрия, остаток которого определяется ацидиметрически по фенолфталеину:
избыток
остаток NaOH + HCl → NaCl + H2O
fэкв (хлоралгидрата) = 1
Проводят контрольный опыт.
2. Йодометрия обратная по методике формальдегида :
I2 + 2NaOH → NaI + NaIO + H2O
ХГ+ NaIO + NaOH → CCl3COONa + NaI + 2 H2O
NaIO + NaI + H2SO4 → I2 + Na2SO4 + H2O
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
![]()
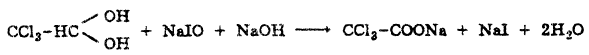
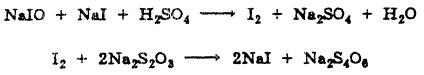
fэкв (хлоралгидрата) = ½ (если окисление до кислоты)
Хранение
по сп. Б, в хорошо укупоренной таре, предохраняющей от действия света, в прохладном месте. Учитывается опасность улетучивания при нарушении условий и разложения на свету.
Применение
В дозах 0,2-0,5 г на прием оказывает успокаивающее, а в дозах 0,5-1,0 г - снотворное и противосудорожное действие.
Введение в молекулу ацетальдегида хлора усилило наркотическое действие этого вещества, а переведение его в гидратную форму значительно снизило токсичность.
Гексаметилентетрамин (ГМТА)
Hexamethylentetraminum (ЛН) (уротропин)
Метенамин – Methenaminum (МНН)
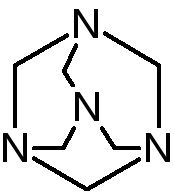 или (СН2)6N4
или
или (СН2)6N4
или
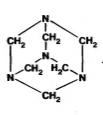
Химическое название 1,2,5,7-тетраазотрицикло(3,3,1,1)-декан
Впервые синтезирован в 1860 г А.М.Бутлеровым, применяться в медицине стал только через 40 лет в 1899г. По своей структуре является гетероциклическим соединением, производным 1,3,5-триазина. Горюч, может использоваться как «сухой спирт».
И методы анализа, и фармакологическая активность основаны на гидролизе и выделении формальдегида. Поэтому относится метенамин к производным альдегидов.
Получение
получают ГМТА, упаривая в вакууме при 40-50оС раствор формальдегида 40% и избыток 25% раствора аммиака:
6НСОН + 4NH3 → (CH2)6N4 + 6H2O
Описание
бесцветные кристаллы или белый кристаллический порошок без запаха, при нагревании улетучивается, не плавясь. Легко растворим в воде, растворим в спирте и хлороформе, очень мало растворим в эфире.
бесцветные кристаллы или белый кристаллический порошок без запаха, вкус жгучий сладкий горьковатый
Подлинность
ФС ИК- спектры поглощения испытуемого метанамина в области 4000-400 см-1 и сравнивают с прилагаемым к ФС рисунком спектра.
ФС Реакция кислотного гидролиза с последующим доказательством продуктов гидролиза:
(CH2)6N4 + 2H2SO4 + 6H2O → 6HCOH + 2(NH4)2SO4
сначала ощущается запах формальдегида, а после добавления щелочи запах аммиака
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH3↑ + H2O
Нефармакопейные реакции
Выделяющийся формальдегид и аммиак можно обнаружить всеми известными реакциями:
формальдегид по реакции окислительной конденсации с фенолами – с салициловой (зозовое окр) или хромотроповой кислотой (фиолетовое);
аммиак – с реактивом Несслера и по посинению красной лакмусовой бумажки.
Реакции с общеалкалоидными осадительными реактивами (на основные свойства третичного амина). Подобно большинству азотсодержащих гетероциклических соединений метанамин образует малорастворимые комплексные соединения с реактивами:
с пикриновой кислотой → желтый осадок пикратов
с фосфорномолибденовой кислотой → желтый осадок H3PO4•12MoO3•3H2O
с фосфорновольфрамовой кислотой → белый аморфный осадок
H3PO4 •12WoO3•3H2O
с бромной водой – оранжево-желтый осадок
с раствором йода – красно-бурый осадок тетрайодида
(CH2)6N4 + 2I2 →(CH2)6N4·I4↓
с раствором йода в калия йодиде – красно-бурый осадок полийодида
(CH2)6N4 +2I2 + КI →(CH2)6N4·I4·КI↓
с серебра нитратом – белый осадок,
2(CH2)6N4 + 3AgNO3 → 2(CH2)6N4 ∙ 3AgNO3↓
с фосгеном COCl2 → (CH2)6N4· COCl2 (защита от фосгена)
с кальция хлоридом → (CH2)6N4·СаCl2 (таблетки «Кальцекс»)
