Fizkhimia
.docx80 г NaOH (М = 40 г/моль) растворено в 144 г Н2О. Найти молярную долю Х (NaOH) и Х(Н2О) в этом растворе. В) 0,2; 0,8;
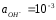 ;
Чему равен рН раствора, и какая это
среда? D) 11, щелочная;
;
Чему равен рН раствора, и какая это
среда? D) 11, щелочная;
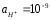 ;
Чему равен рОН, и какая это среда? D) 5,
щелочная;
;
Чему равен рОН, и какая это среда? D) 5,
щелочная;
k = 0,3 л/мольмин. Укажите порядок реакции. С) 2;
k = 8,9 л2/моль2мин. Укажите порядок реакции. D) 3;
k = 2,3 сек-1. Укажите порядок реакции. В) 1;
AAAAA
Автокаталитические реакции – это реакции, в которых промежуточные вещества или продукты реакции могут катализировать процесс;
Азеотроп – это нераздельно кипящая смесь компонентов Активные центры на поверхности твердого катализатора называются мультиплетами
ВВВВВ
В гальваническом элементе -Pt(H2)H+ (aH+=1)Cu2+Cu+ при Т = 298 К и Р = 1,013 Н/м2 ЭДС равна 0,34 В. Чему равен потенциал медного электрода? С) = 0,34 В.;
В каких единицах выражается скорость химической реакции? D)[концентрация][время]-1};
В каком количественном соотношении находятся константы скорости двух реакций первого порядка, если известно, что период полураспада первой реакции в пять раз больше, чем второй? С) К2 = 5К1;
В
каком соотношении находятся константы
скорости реакций третьего порядка,
если при исходной концентрации С0
= 1 моль/л, периоды полураспада равны
 ;
;
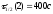 ?
D)
к1
= 2к2;
?
D)
к1
= 2к2;
Во сколько раз возрастает скорость реакции, если температура увеличивается с 330К до 360К, а = 3? E) в 27 раз
Во сколько раз возрастет скорость реакции (Еа=250 кДж/моль) при применении катализатора( Еа=180 кДж/моль) ,Т=1800 К. В) в 108 раз;
Во сколько раз увеличится скорость реакции, если температура возрастет на 200, а = 2? С) в 4 раза;
Вещество, добавление которого увеличивает активность катализатора, называют… Е) промотором.
Вещество, добавление которого полностью или частично ликвидирует активность катализатора, называют… А) каталитическим ядом;
Водный раствор, содержащий нелетучее растворенное вещество (неэлектролит), замерзает при 271,5К. Определить температуру кипения раствора, если температура замерзания воды 273 К; температура кипения воды 373,2К. Криоскопическая постоянная воды 1,86; эбулиоскопическая постоянная воды 0,52. А) 373,62 К;
Вычислить
э.д.с. гальванического элемента:
ZnZn2+
Ag+Ag
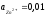 ;
;

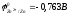 ;
;
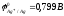 1,503B.
1,503B.
Вычислить
ЭДС.
гальванического
элемента:
PtFe3+,
Fe2+
Cu2+,
Cu+Pt
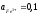 ;
;
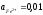 ;
;

 ;
;
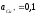 ;
;
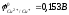 0,811;
0,811;
ДДДДДД
Для какого из ниже перечисленных процессов работа расширения одного моля идеального газа максимальна? Изобарного
Для какого процесса справедлива формула: q = H? для изобарного.
Для каких процессов справедливо соотношение: S = q/T ? D) для обратимых изотермических;
Для реакции А + В= Д при СА = 0,3 моль/л, СВ = 2 моль/л был обнаружен второй порядок и измерена скорость, равная 1,210-4 моль/лс. Определите К. A) 210-4 л/мольс;
Для реакции первого порядка при С0 = 1 моль/л 1/2 = 500С. Каково значение 1/2 при С0 = 2 моль/л? С) 500 с.;
Для
эндотермической реакции: А + В = С, Ср0.
Каково соотношение между изменениями
энтальпии реакции при температурах Т1
и Т2,
если Т2Т1?
B)
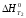
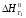 ;
;
Давление
насыщенного пара над водным раствором
Na2SO4
(М=142г/моль)
c
массовой долей 10% при 40°С равно 53,6
мм.рт.ст. Рассчитайте степень
электролитической диссоциации этой
соли, если давление насыщенного пара
воды в данных условиях
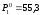 мм.рт.ст. А) 0,6;
мм.рт.ст. А) 0,6;
ЕЕЕЕЕ
Если 2 моля гелия нагреть на 1º в закрытом сосуде объемом 1 м³, то чему будет равна работа этого процесса? А) 0 кДж;
Если давление не оказывает влияния на химическое равновесие в идеальной газовой системе, то для нее справедливо следующее соотношение: C) КР = КХ = КР;
Если в системе идет одновременно несколько реакций, причем протекание некоторых из них возможно лишь при условии протекания других реакций, то такие реакции называются… D) сопряженными;
Если для экзотермической реакции в интервале температур от Т1 до Т2
Ср 0, то при температуре Т2: А) тепла выделяется больше, чем при Т1;
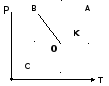
Если компоненты системы неограниченно растворимы в жидкой и твердой фазах, то диаграмма плавкости будет иметь вид:

ЗЗЗЗ
Зависят ли константа скорости и скорость реакции от температуры и концентрации ? D) скорость зависит от концентрации и температуры, а константа скорости только от температуры;
ИИИИИ
Из жидкого расплава свинца и сурьмы, частично выпали кристаллы сурьмы. Сколько степеней свободы имеет такая система при Р = const? В) 1;
Имеется растворитель (I), разбавленный раствор летучего вещества (II) и разбавленный раствор нелетучего вещества (III) в этом же растворителе той же концентрации. В каком соотношении будут находиться температуры кипения этих жидкостей? В) Т2 < Т1 < Т3 ;
Используя
какую зависимость, можно определить
графически энергию активации?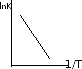
КККК
К
какому типу относится электрод, потенциал
которого определяется уравнением:
 ?
А)
окислительно-восстановительный;
?
А)
окислительно-восстановительный;
К
какому типу относятся электроды, если
потенциалы их выражается уравнениями:
1.
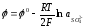 2.
2.
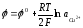 Е) 1 - II
рода , 2 - I
рода.
Е) 1 - II
рода , 2 - I
рода.
КАК
Как
выражается
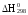 реакции через теплоты сгорания веществ
(
реакции через теплоты сгорания веществ
( )?
СН 3OH(г)
=
2Н2
+ СО
)?
СН 3OH(г)
=
2Н2
+ СО
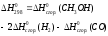 Как выражается
Как выражается
 реакции через теплоты образования
веществ (
реакции через теплоты образования
веществ (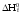 )?
С + 2Н2О
= СО2 +
2Н2
С)
)?
С + 2Н2О
= СО2 +
2Н2
С)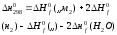 Как выражается тепловой эффект реакции
Как выражается тепловой эффект реакции
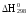 через теплоты сгорания веществ (
через теплоты сгорания веществ ( )?
2СО + S2
= 2COS
)?
2СО + S2
= 2COS
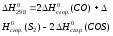 Как выражается
Как выражается
 реакции через теплоты образования
участвующих в ней веществ (
реакции через теплоты образования
участвующих в ней веществ ( ):4СО
+ 2SО2
= S2
+ 4CO2
):4СО
+ 2SО2
= S2
+ 4CO2
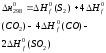 Как
изменяется энтропия при увеличении
давления при T
= const?
В) убывает;
Как
изменяется энтропия при увеличении
давления при T
= const?
В) убывает;
Как изменяется энтропия вещества: а) при нагревании , б) при плавлении при p = const? D) а) и б) увеличивается;
Как ведет себя энергия Гельмгольца при сжатии газа при Т =const? С) возрастает;
Как изменяются температуры кипения и замерзания воды с ростом давления? D) температура кипения увеличивается, а температура замерзания уменьшается;
Как изменяется температура плавления веществ с повышением атмосферного давления? Е) может и увеличиваться, и уменьшаться.
Как изменяется связанная энергия системы ТS при нагревании жидкости и при ее кипении? А) увеличивается в обоих случаях;
Как ведет себя энергия Гиббса вещества при его нагревании при Р = const? В) всегда убывает;
Как изменяется Кр с ростом температуры, если данная реакция эндотермическая ? А) возрастает;
Как ведет себя энергии Гиббса вещества при увеличении давления при T = const?А) возрастает;
Как изменятся константы равновесия Кх следующих реакции при увеличении давления?1)С2 Н4 (г) + Н2(г) = С2Н6(г) 2)N2 + O2 = 2NO D) Кх(1) - увеличивается; Кх(2) - не изменяется;
Как изменятся константы равновесия Кх следующих реакции при увеличении давления? 1) 2C(т) + О2 = 2СО 2) 2NO + O2= 2NO2 С) Кх(I) - уменьшается; Кх (2) - увеличивается;
Как изменятся константы равновесия Кх следующих реакции при увеличении давления? 1) N2O4 = 2NO2 2) 6C(т) + 3H2(г)=C6H6(г) А) Кх(1) - уменьшается; Кх(2) - увеличивается;
Как изменится значение константы равновесия Кр реакции А+2В=АВ2, если общее давление в системе увеличить в 2 раза? Все вещества находятся в идеальном газообразном состоянии. А) не изменится;
Как изменяется константа равновесия химической реакции с ростом температуры, если реакция идет с выделением тепла? C) уменьшается;
Как изменяется энтропия (S),объем (V), энергия Гиббса (G) при образовании идеального раствора? D) S > 0; V = 0; G < 0;
Kак изменяется растворимость газа в жидкости с увеличением давления газа и температуры? D) увеличивается с увеличением давления и уменьшается с увеличением температуры;
Как изменяется давление насыщенного пара растворителя над раствором с увеличением концентрации растворенного вещества (Х2) и растворителя (Х1). С) увеличивается с увеличением Х1 и уменьшается с увеличением Х2;
Как называется точка на диаграмме плавкости, в которой из жидкого расплава происходит кристаллизация двух твердых фаз одновременно? А) эвтектическая; Как называется линия, изображающая на диаграмме состояния зависимость температуры начала кристаллизации от состава двухкомпонентной смеси? В) ликвидуса;
Как изменится период полураспада для реакции второго порядка, если
исходная концентрация увеличится в 2 раза? В) уменьшится в 2 раза;
Как изменится период полураспада для реакции третьего порядка, если исходная концентрация увеличится в 2 раза? С) уменьшится в 4 раза;
Как изменится константа скорости реакции СН3СОСН3 = С2Н4 + СО + Н2 если концентрацию исходного вещества увеличить в 2 раза? А) не изменится;
Как изменится скорость реакции 4HCl + О2 = 2H2О + 2Cl2 , если объем системы увеличить в 2 раза? Е) уменьшится в 32 раза.
Как
выглядит зависимость константы скорости
реакции от концентрации исходных
веществ?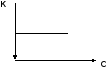
Как изменится скорость реакции: N2 + 3H2 = 2NH3, если концентрацию Н2 увеличить в 2 раза? D) увеличится в 8 раз;
Как зависят степень () и константа диссоциации (КД) слабого электролита от концентрации (С)? D) с увеличением С уменьшается, КД остается постоянной;
Как зависит коэффициент активности иона i в разбавленном растворе от его заряда Zi и от ионной силы раствора ( J )? А) i тем меньше, чем больше Zi и J;
КАКАЯ
Какая из приведенных ниже цепных реакцией является разветвленной? E) H2 + O2
Какая из приведенных стадии цепной реакции описывает рост цепи? D) H2 + CI HCI + H;
Какая линия на диаграммах состояния называется «нодой»? Е) прямая, соединяющая точки равновесных фаз.
Какая из характеристик системы, приведенной на рисунке, верна?
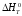
В)
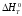 0
; Ср
= 0;
0
; Ср
= 0;
КАКОЕ
Какое количество работы будет совершено 1,1 кг СО2 при повышении его температуры на 2000 при постоянном давлении? 41550 Дж;
Какое из ниже приведенных уравнений записано неверно? В) Cp = (S/T)p;
Какое из ниже приведенных уравнений записано неверно? Е) DS = q/DT.
Какое из следующих положений не является признаком катализатора? E) катализатор увеличивает выход продукта реакции.
Какое из следующих утверждений неверно? D ) система не может иметь более трех фаз одновременно;
КАКОЙ
Какой из электродов относится к электродам первого рода? А) AgAgNO3 ;
Какой электрод относится к электродам второго рода?D) AgAgCICI-;
Какой из гальванических элементов не относится к концентрационным? Е) ZnZn2+Ag+Ag
Какой из кинетических параметров реакции не изменяется в присутствии катализатора? E) константа равновесия.
Какой из растворов замерзает при более низкой температуре, если мо- ляльные концентрации данных веществ в воде равны? С) Са(ОН)2;
Какой
из перечисленных ниже наборов
термодинамических данных нужно найти
в справочнике для расчета
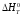 химической реакции , используя
приближенное уравнение Кирхгофа? С)
химической реакции , используя
приближенное уравнение Кирхгофа? С)
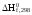 ,
Ср
;
,
Ср
;
КАКОВ
Каков обычно знак изменения энтальпии при растворении твердого тела в жидкости? Е) может быть любым, в зависимости от природы твердого тела.
Каково поведение энтропии изолированной системы при протекании в ней самопроизвольных процессов? B) растет и достигает максимального значения;
Какова размерность константы равновесия для химической реакции 2А + В=С, если концентрации выражены в моль/л? D) л2/моль2;
Какова моляльная концентрация раствора, приготовленного из 20 г NaOH и 500 г Н2О (MNaOH = 40 г/моль)? D) 1 моль/кг;
КАКИЕ
Какие из уравнений определяют периоды полураспада реакций первого , второго и третьего порядков?
а)
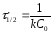 ;
б)
;
б)
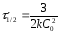 ;
в)
;
в)
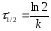 ;
г)
;
г)
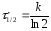 ;
д)
;
д)
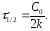
Е) в – 1 , а – 2, б – 3 порядков;
Какие
из следующих утверждений: 1) закон Рауля
соблюдается для каждого компонента
раствора
 2) Vсмеш.
= 0; 3) Sсмеш.
= 0; 4) Gсмеш.
= 0; 5) Hсмеш.
= 0. справедливы для идеального раствора?
С) 1), 2), 5);
2) Vсмеш.
= 0; 3) Sсмеш.
= 0; 4) Gсмеш.
= 0; 5) Hсмеш.
= 0. справедливы для идеального раствора?
С) 1), 2), 5);
Какие параметры системы необходимо поддерживать постоянными, чтобы по знаку изменения энтропии можно было бы судить о направлении самопроизвольного протекания процесса? E) U = const, V = const.
Когда теплота не зависит от пути проведения процесса? E) Р = const.
Какую функцию необходимо рассчитать, чтобы узнать, возможно ли данная реакция при Р и Т = const? С) G = H – Т S ;
Каким из приведенных методов можно определить дробный порядок реакции? E) по периоду полураспада.
Количество диссоцированного вещества в 0,05 молярном растворе равно 0,025 моль/л. Определите степень диссоциации вещества.D) 0,50;
ММММ
Массовая доля NaOH в водном растворе ω=8%. Определить молярную концентрацию NaOH, если плотность этого раствора ρ=1 г/см3. Е) 2 моль/ л.
Могут ли порядок реакции и молекулярность быть дробными величинами? С) порядок может, молекулярность нет;
Можно ли сказать, как влияет температура на величину теплового эффекта реакции, не проводя опыта? D) можно, если определить Cp или Cv реакции;
ННННН
На какой из параметров оказывает влияние катализатор? C) на энергию активацию;
На диаграмме кипения проведена нода аb. Чему равно отношение масс жидкой и газообразной фаз?
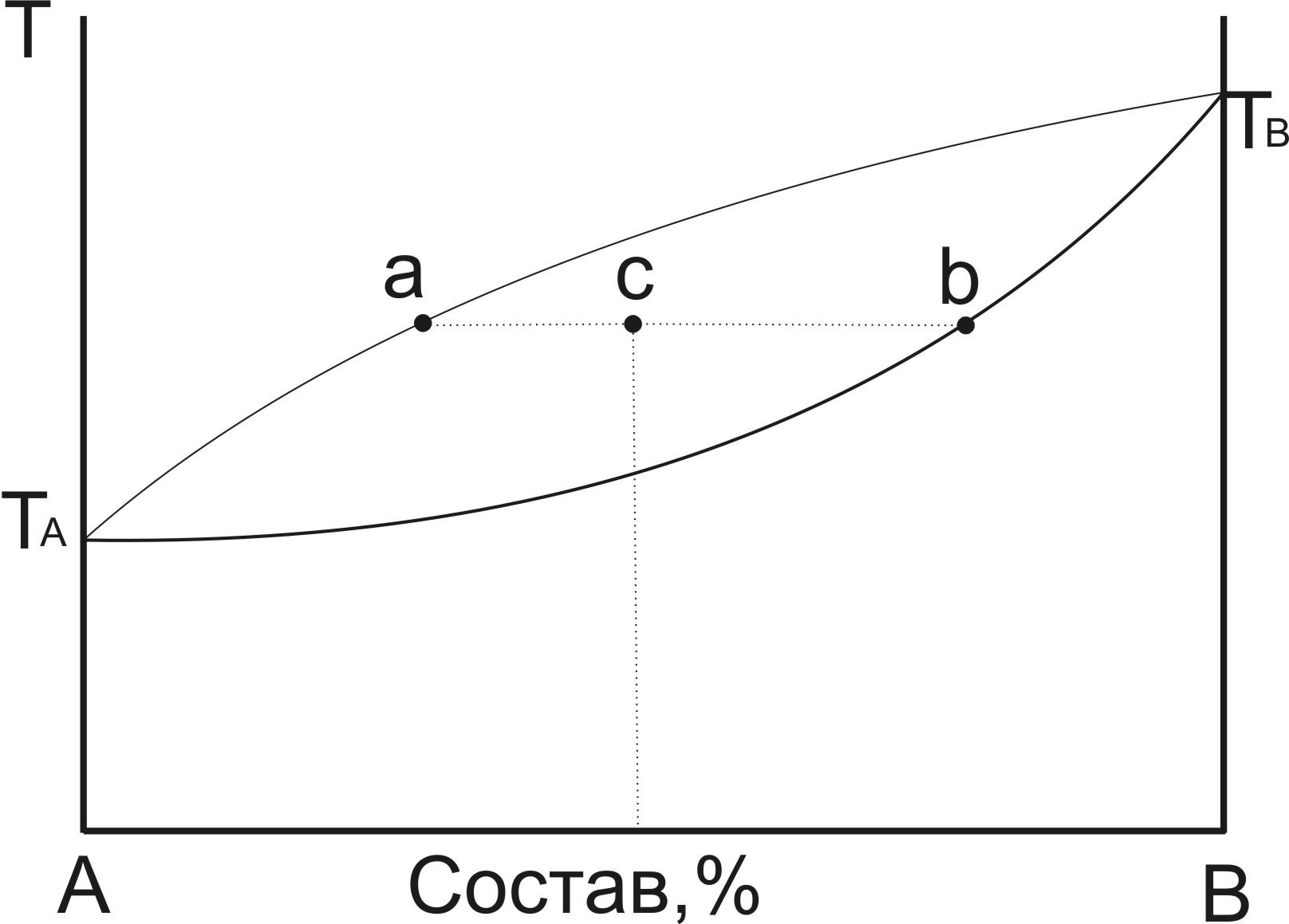
А) ас/сb;
Найдите
константу равновесия Кс
реакции: N2
+ 3H2
=2NH3,
если равновесные концентрации веществ
равны:
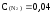 моль/л,
моль/л,
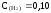 моль/л,
моль/л,
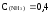 моль/л. А)
4000;
моль/л. А)
4000;
Найдите константу равновесия реакции: 2Ag +½ O2 = Ag2O, если давление диссоциации Ag2O при данной температуре равно 4· 10-8Па. Е) 0,5· 104
Найдите
константу равновесия реакции: 2SO2
+ O2
=2SO3
если
равновесные концентрации веществ
следующие:
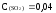 моль/л,
моль/л,
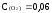 моль/л;
моль/л;
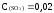 моль/л. В)
4,17;
моль/л. В)
4,17;
Найдите константу равновесия Кр следующей реакции: CaO +CO2 = CaCO3 ,если давление диссоциации CaCO3 при данной температуре равно 400 Па. Е) 0,0025.
ОООО
Обратимыми называются такие процессы, в результате которых: С) в исходное состояние возвращаются и система, и среда;
Определить состав смеси в момент равновесия для реакции, протекающей в доменной печи: FeO + CO = Fe + CO2, если при Т=1273 К константа равновесия равна KP =2,5. В) Х(CO)= 28,6%; Х (CO2)= 71,4%;
От каких факторов зависят константы равновесия Кр и Кх данной реакции? Е) Кр от температуры; Кх от температуры и давления.;
Определить, на сколько понизится давление насыщенного пара растворителя над раствором, содержащем 80 г нелетучего вещества (М = 40 г/моль) в 144 г Н2О. А) на 20%;
От каких параметров зависит коэффициент распределения? С) от температуры и природы веществ;
Определите температуру кипения и замерзания раствора сахара в воде, если 68,4 г сахара растворено в 100 г воды (М сахара=342г/моль). (Ек = 0,520; Eз = 1,860) D) 101,040С; - 3,720С;
Определите вариантность системы (С), состоящей из раствора К2SO4 и Na2SO4 в воде, в присутствии паров воды и кристаллов обеих солей? В) 1;
От каких факторов зависит скорость реакции E) от природы веществ, температуры и концентрации веществ.
От каких факторов зависит константа скорости? A) температуры (Т);
Определить скорость реакции третьего порядка, если k = 100 л2/моль2мин, а С = 0,1 моль/л. D) 0,1;
Определить скорость реакции нулевого порядка, если k = 2,5 моль/лмин, а С = 0,1 моль/л. А) 2,5;
Определить скорость реакции первого порядка, если k = 0,2 мин-1, а С = 0,5 моль/л. А) 0,1;
Определить скорость реакции второго порядка, если k = 10 л/мольмин, а С = 0,2 моль/л. В) 0,4;
Определить, какая доля исходного вещества распадется в течение 10 минут, если К=0,1 мин-1. С) 63 %;
Определите константу диссоциации бинарного электролита КА, если его концентрация в растворе 1 моль/л, а степень диссоциации 0,6. А) 0,9;
Определите константу диссоциации электролита К2А, если его концентрация С = 1 моль/л; = 0,5. В) 1;
Определите рН 0,01 молярного раствора СН3СООН, если степень диссоциации кислоты 10%. А) 3;
Определите рН раствора Н2S, если = 0,001, а С = 0,05 моль/л. D) 4;
Определите ЭДС концентрационного гальванического элемента при Т =298К и Р = 1 атм: AgAg+ Ag+Ag a1 =0,1 a2 = 0,001 C) 0,118;
Определить
ЭДС гальванического элемента при
Т=298К:Pt(Cl2)
HCl
(Cl)2Pt.
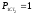 атм,
атм,
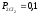 атм. В) 0,0295 В;
атм. В) 0,0295 В;
ППППП
При каких условиях изменение внутренней энергии системы может быть
полностью переведено в теплоту? D) V = const;
При каком процессе вся теплота, данная идеальному газу, превращается в работу его расширения? D) при изотермическом;
При постоянных V и Т самопроизвольные процессы протекают, если Е) убывает энергия Гельмгольца (F < 0).
При уменьшении температуры системы энергия Гельмгольца при
V = const…? А) возрастает;
При изотермическом расширении 1 моля идеального газа в первом опыте объем увеличился от 2 до 4 м³ , во втором – от 500 до 1000 м³ , Укажите , в каком из опытов изменение энтропии больше? А) S1 =S2;
По
какому из графиков можно определить
теплоту испарения?C)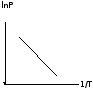
При постоянных Р и Т самопроизвольно протекают процессы, если В) убывает энергия Гиббса (G <0);
При каких условиях изменение энтропии может быть равно работе процесса? E) ни при каких.
При каких условиях численное значение константы равновесия не зависит от способа выражения состава реагирующей смеси? D) = 0;
При 220С и давлении 52 .103 Па растворимость H2S в анилине равна 10,6 кг/м3. Чему равна растворимость H2S в анилине при 155 . 103 Па и той же температуре согласно закону Генри? В) 31,6 кг/м3.
При растворении 5 г вещества в 200 г воды получается раствор, кристаллизующийся при -1,450С. Определите молярную массу (г/моль) растворенного вещества. Криоскопическая постоянная воды 1,860. Е) 32.
При некоторой концентрации Mg(NO3)2 изотонический коэффициент раствора равен 2,4. Найти кажущуюся степень диссоциации вещества. Е) 70%.
РРРРР
Рассчитать ионную силу (J) 0,01 молярного раствора K3РО4. В) 0,06;
Рассчитайте ионную силу раствора SnCI4 (в = 0,01 моль/кг). А) 0,1;
Рассчитайте ионную силу раствора (NH4)2SO4 (в = 0,2 моль/кг). E) 0,6.
Раствор 0,8293 г хлорида бария (М=208,27 г/моль) в 1000 г воды замерзает при -0,0209ºС, криоскопическая постоянная воды равна 1,86. Определить степень диссоциации раствора BaCI2. Е) 0,91.
Растворимость йода в сероуглероде при Т=298 К С1=200,6 кг/м3 , а в воде С2=0,340 кг/м3. Определите коэффициент распределения йода между сероуглеродом и водой. С)590;
Рассчитать G, если H = 20,0 кДж, S = 100 Дж, а Т = 300К? А) -10 кДж;
Рассчитайте изменение энтропии для 100 кратного обратимого расширения 1 моля идеального газа при постоянной температуре. В) 38,3 Дж/моль·К;
Работа какого процесса не зависит от пути его проведения? адиабатического.
СССС
Стандартная
теплота сгорания углерода (С ) равна
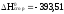 кДж/моль. В какой из приведенных реакции
тепловой эффект при Т = 298К равен этой
величине? С
+ О2
= СО2;
кДж/моль. В какой из приведенных реакции
тепловой эффект при Т = 298К равен этой
величине? С
+ О2
= СО2;
Стандартная
энтальпия образования газообразной
воды
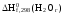 равна -241,84 кДж/моль, а жидкой воды
равна -241,84 кДж/моль, а жидкой воды
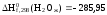 кДж/моль.
Чему равна энтальпия фазового перехода
(процесса испарении) Н2О(ж)
Н2О(г)
? 44,11 кДж/моль;
кДж/моль.
Чему равна энтальпия фазового перехода
(процесса испарении) Н2О(ж)
Н2О(г)
? 44,11 кДж/моль;
Стандартная энтальпия образования NH4Cl составляет -314,4 кДж/моль. Какому процессу соответствует эта величина? Укажите соответствующую реакцию. B) ½ N2 +2 H2+½Cl2 = NH4Cl ;
Стандартная
теплота образования диокcида
азота
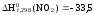 кДж/моль. В какой из приведенных реакций
тепловой эффект при Т = 298К равен этой
величине? C)
1/2N2
+ O2
= NO2;
кДж/моль. В какой из приведенных реакций
тепловой эффект при Т = 298К равен этой
величине? C)
1/2N2
+ O2
= NO2;
Стандартная
теплота образования HCI
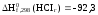 кДж/моль.
кДж/моль.
Чему равен стандартный тепловой эффект реакции? 2HCI(г) = H2 + CI2 С) 184,6 кДж/моль;
Стандартная теплота образования 1 моля C6H5NO2(ж) – это тепловой эффект следующей химической реакции: 6С(графит) + 2,5Н2 + 0,5N2 + O2 = 6H5NO2(ж);
Соотношение между величинами констант равновесия КР, КХ, КС для идеальных газовых систем должно быть следующим: Е) соотношение может быть любым, зависящем от реакции.
Сколько молей неэлектролита должен содержать 0,5 л раствора, чтобы его осмотическое давление при 180С равнялось 96728 Па? С) 0,02;
Сколько можно получить 5% раствора сахара из 2 кг 40% раствора? D) 16 кг;
Сколько
фаз и какие находятся в равновесии в
т. К
и т. М
на диаграмме состояния воды?