
- •Сборник задач по общей химии
- •Содержание
- •Предисловие
- •Тема 1. Способы выражения состава раствора Медико-биологическое значение темы
- •Основные параметры, характеризующие состав раствора
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 2. Титриметрические методы количественного анализа Кислотно-основное титрование. Оксидиметрия Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 3. Химическая термодинамика. Химическое равновесие Медико-биологическое значение темы
- •Основные параметры, используемые для характеристики термодинамических процессов
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 4. Элементы химической кинетики Медико-биологическое значение темы
- •Основные кинетические параметры, характеризующие кинетические закономерности
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 5. Лигандообменные процессы и равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Тема 6. Редокс-процессы и редокс-равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Тема 7. Осмотические свойства растворов
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Тема 8. Свойства растворов электролитов Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 9. Гетерогенные процессы и равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 10. Протолитические процессы и равновесия Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 11. Буферные растворы и их свойства Медико-биологическое значение темы
- •Задачи для самостоятельного решения
- •Тема 12. Физико-химия поверхностных явлений Медико-биологическое значение темы
- •Обучающие задачи с решениями
- •Задачи для самостоятельного решения
- •Тема 13. Физико-химия дисперсных систем Медико-биологическое значение темы
- •Обучающие задачи с решениями.
- •Задачи для самостоятельного решения
- •Приложение
- •Использованная литература
Тема 11. Буферные растворы и их свойства Медико-биологическое значение темы
Для поддержания кислотно-щелочного баланса жидких сред в живых организмах служат различные буферные системы. Главными из них являются гидрокарбонатная, гидрофосфатная, белковая и гемоглобиновая. Действия всех буферных систем организма взаимосвязаны, что обеспечивает постоянное значение рН. Особо важным является поддержание рН крови (7,4±0,05). Кислотно-основные пары, выполняющие роль буферных систем крови, распределяются между плазмой и эритроцитами. Буферное действие плазмы обеспечивается преимущественно гидрокарбонатной системой (38%). Буферное действие эритроцитов в основном обеспечивается гемоглобиновой буферной системой (35%)
Гидрофосфатная буферная система содержится не только в крови, но и во внутриклеточной жидкости тканях, слюне. Особо важную роль она играет в физиологических процессах, протекающих в почках.
Дыхательная система и ренальная регуляция (деятельность почек) помогают буферным системам корректировать постоянство рН жидких сред. Нарушение кислотно-основного равновесия может быть вызвано нарушениями в процессах метаболизма, при ослаблении деятельности почек или легких. Такое нарушение приводит или к увеличению рН в жидких системах (алкалоз), либо к уменьшению рН (ацидоз). В благоприятных условиях компенсация рН происходит за счет восстановления деятельности легких и почек.
Таблица 10. Основные параметры, используемые для характеристики буферных растворов
|
Параметр |
Обозначение, единица |
Смысловое значение |
|
рH кислотной буферной системы |
рН=
рКа+lg
ρН
= ρКа
+lg рН=
рКа
+ lg |
Кислотный буферный раствор содержит слабую кислоту (донор протона) и соль этой кислоты (акцептор протона) |
|
рH основной буферной системы |
рН=
рКа+lg
ρН
=pКа
+lg рН
= 14 – (ρКb
+ |
Основной буферный раствор содержит слабое основание (акцептор протона) и соль этого основания (донор протона) |
|
Буферная емкость по кислоте |
|
Число моль-эквивалентов сильной кислоты, которое нужно добавить к одному литру буферного раствора, чтобы изменить величину рH на единицу |
|
Буферная емкость по основанию |
|
Число моль-эквивалентов щелочи, которое нужно добавить к одному литру буферного раствора, чтобы изменить величину рН на единицу |
Обучающие задачи с решениями
1..Как изменится рН, если к ацетатному буферному раствору, состоящему из 100 мл кислоты и 100 мл раствора соли c концентрациями компонентов по 0,1 моль/л, прибавить 10 мл раствора с концентрацией гидроксида натрия 0,1 моль/л рКа=4,76?
Решение: Ацетатный буфер состоит из уксусной кислоты и соли – ацетата натрия, т.е. сопряженной пары CH3COOH/CH3COO-.При добавлении сильного основания положение равновесия в растворе
CH3COOH ↔ CH3COO- + H+
будет сдвинуто вправо, так как уксусная кислота будет взаимодействовать с добавленными гидроксид-ионами:
CH3COOH + OH- → CH3COO- + H2O
рН
= рКа
+ ![]()
рН
= 4,76 + ![]() = 4,76
= 4,76
Количество израсходованной кислоты равно количеству добавленной щелочи, а количество ацетат-ионов (соли), соответственно, на эту же величину возрастает; в связи с этим уравнение Гендерсона-Гассельбаха принимает вид
рН
= рKa(CH3COOH)
+
![]()
pH=
4,76 + lg![]()
∆ ρН = 4,85-4, 76 = 0,09
Этот результат демонстрирует возможность буферной системы достаточно стойко сохранять постоянство рН.
Ответ: рН изменится на 0,09 ед.
2.Определите в каком соотношении находятся компоненты фосфатной и гидрокарбонатной буферных систем в плазме крови при рН=7,36, если для плазмы рКа(H2PO-4) = 6,8; рКаI(H2CO3) = 6,3.
Решение:
рН
(![]() =
рКа(НРО-4)
+
=
рКа(НРО-4)
+ ![]() ;
;
рН
(![]() =
рКа(Н2СО3)
+
=
рКа(Н2СО3)
+ ![]() ;
;
![]()
![]() =
7,36 – 6,8 = 0,56;
=
7,36 – 6,8 = 0,56; ![]()
![]()
![]() =
7,36 – 6,3 = 1,06;
=
7,36 – 6,3 = 1,06;
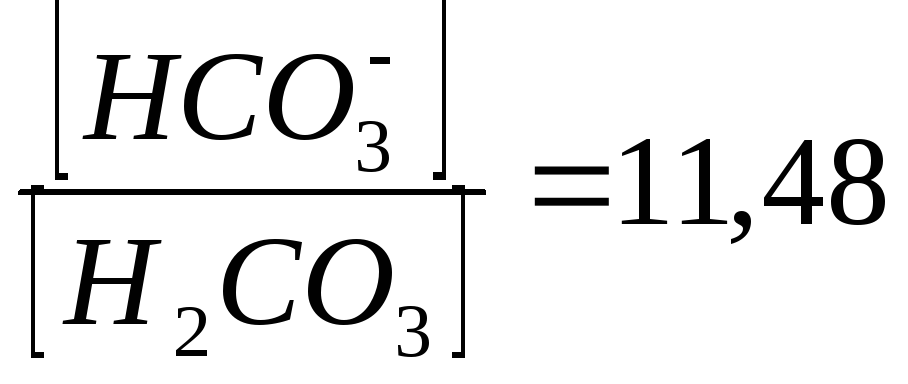
И в фосфатной, и гидрокарбонатной буферных системах сопряженных оснований больше, чем кислот, что необходимо для живых организмов, в результате метаболизма которых образуется значительно больше кислот, чем оснований.
Ответ: исходные компоненты фосфатной и гидрокарбонатных буферных систем (основание: кислота) находятся соответственно в соотношениях: 3,63:1 и 11,48:1.
3. К 100 мл крови для изменения рН от 7,36 до 7,00 надо добавит 3,6 мл соляной кислоты с концентрацией 0,1 моль/л. Какова буферная емкость крови по кислоте?
Решение: буферная емкость определяется числом моль эквивалентов сильной кислоты или щелочи, которое надо добавить к 1 л буферного раствора, чтобы изменить его рН на единицу:
![]()
ƒэкв(НCl) = 1, поэтому С(НCl) = С1/z(НCl)
Ва
= ![]()
Ответ: буферная емкость по кислоте составляет 0,01 моль/л.
