
8. Растительная клетка представляет собой осмотическую систему. Пектоцеллюлозная оболочка хорошо проницаема как для воды, так и для растворенных веществ. Однако плазмалемма и тонопласт обладают избирательной проницаемостью, легко пропускают воду и менее проницаемы, а в некоторых случаях непроницаемы для растворенных веществ. В этом можно убедиться, рассмотрев явления плазмолиза и тургора. Если поместить клетку в раствор более высокой концентрации, чем в клетке, то под микроскопом видно, что цитоплазма отстает от клеточной оболочки. Это особенно хорошо проявляется на клетке с окрашенным клеточным соком. Клеточный сок остается внутри вакуоли, а между цитоплазмой и оболочкой образуется пространство, заполненное внешним раствором. Явление отставания цитоплазмы от клеточной оболочки получило название плазмолиза. Плазмолиз происходит в результате того, что под влиянием более концентрированного внешнего раствора вода выходит из клетки (от своего большего химического потенциала к меньшему), тогда как растворенные вещества остаются в клетке. При помещении клеток в чистую воду или в слабо концентрированный раствор вода поступает в клетку. Количество воды в клетке увеличивается, объем вакуоли возрастает, клеточный сок давит на цитоплазму и прижимает ее к клеточной оболочке. Под влиянием внутреннего давления клеточная оболочка растягивается, в результате клетка переходит в напряженное состояние — тургор.
Наблюдения за явлениями плазмолиза и тургора позволяют изучить многие свойства клетки. Явление плазмолиза показывает, что клетка жива и цитоплазма сохранила полупроницаемость. В мертвых клетках мембрана не обладает полупроницаемостью, не контролирует потоки веществ, и осмотический выход воды не происходит. По скорости и форме плазмолиза можно судить о вязкости цитоплазмы. Наконец, явление плазмолиза позволяет определить величину осмотического потенциала в клетке (плазмолитический метод). Этот метод основан на подборе изоосмотического, или изотонического, раствора, т. е. имеющего осмотический потенциал (Ψосм. р-ра) , равный осмотическому потенциалу клеточного сока (Ψосм. кл.). Раствор, при котором в клетке начался плазмолиз, имеет осмотический потенциал, примерно равный осмотическому потенциалу клетки. Зная концентрацию этого наружного раствора в молях, можно вычислить его осмотический потенциал, а следовательно, осмотический потенциал клетки (Ψосм. р-ра = Ψосм. кл.).
Определение величины осмотического потенциала имеет большое значение, в частности для экологических исследований. Величина осмотического потенциала позволяет судить о максимальной способности растения поглощать воду из почвы и удерживать ее, несмотря на иссушающее действие атмосферы. Осмотический потенциал колеблется в широких пределах, от —5 до —200 бар. Осмотический потенциал около —1 бара наблюдается у водных растений. Осмотический потенциал, равный —200 бар, обнаружен у выжатого сока талофта Atriplex confertifolia. В 1 л сока этого растения содержится 67,33 г хлоридов. У большинства растений средней полосы осмотический потенциал колеблется от —5 до —30 бар. Вместе с тем необходимо отметить, что факторы, действующие на изменение осмотического потенциала, чрезвычайно разнообразны. Даже соседние, рядом расположенные клетки могут отличаться по величине осмотического потенциала. Обычно отрицательная величина осмотического потенциала больше у мелких клеток по сравнению с крупными. Установлены определенные градиенты осмотического потенциала в пределах одной ткани. Так, в тканях стебля отрицательный осмотический потенциал возрастает от периферии к центру и от основания к верхушке. В корне отрицательный осмотический потенциал, наоборот, постепенно снижается от основания к верхушке. В проводящих элементах стебля и корня, как правило, отрицательная величина осмотического потенциала очень низка (от —1 до —1,5 бара). В листьях осмотический потенциал колеблется от -10 до -18 бар. Осмотический потенциал различен у разных жизненных форм. У древесных Пород он более отрицателен, чем у кустарников, а у кустарников более отрицателен, чем у травянистых растении. Разные экологические группы различаются по величине осмотического потенциала. У растений пустынь осмотический потенциал более отрицателен, чем у степных растений; у степных более отрицателен, чем у луговых. Еще меньше осмотическая концентрация у растений болотных и водных местообитаний (соответственно наименее отрицательный осмотический потенциал). У светолюбивых растений осмотический потенциал более отрицательный, чем у теневыносливых. На величину осмотического потенциала влияет концентрация растворенных веществ в клеточном соке — это осмотически активные вещества (органические кислоты, соли, аминокислоты, сахара). Растение в определенной степени регулирует величину осмотического потенциала. Ферментативное превращение сложных нерастворимых веществ в растворимые (крахмала в сахара, белков в аминокислоты) приводит к возрастанию концентрации клеточного сока и повышению отрицательной величины осмотического потенциала. Увеличенное накопление растворимых солей также делает более отрицательным осмотический потенциал. Несмотря на то, что осмотический потенциал меняется в зависимости от внешних условий, все же для каждого вида эти изменения происходят в своих определенных пределах. Величину осмотического потенциала многие физиологи считают одной из характеристик данного вида растений.
Водный потенциал клетки.
Величина осмотического потенциала имеет большое значение для определения силы, которая вызывает поступление воды в клетку. Однако надо учесть, что клеточная оболочка, свободно пропуская воду и питательные вещества, обладает ограниченной растяжимостью. При поступлении в клетку воды, в ней развивается гидростатическое давление, которое заставляет плазмалемму прижиматься к клеточной оболочке. Клеточная оболочка растягивается и, в свою очередь, оказывает противодавление — это потенциал давления; он тем больше, чем больше поступает воды в клетку. Благодаря ограниченной растяжимости клеточной оболочки наступает такой момент, когда давление оболочки целиком уравновешивает силу осмотического поступления воды. С термодинамической точки зрения направление движения воды определяется величиной водного потенциала. Водный потенциал — это мера энергии, с которой вода поступает в клетку. Водный потенциал показывает, насколько активность воды в системе (клетке) меньше активности чистой воды. Водный потенциал чистой воды равен нулю. Присутствие растворимых веществ в водном растворе или в клетке уменьшает концентрацию воды, снижает ее активность. Когда на водный раствор действует давление (в случае клетки противодавление оболочки, или Ψдавл) молекулы воды сближаются друг с другом, и это приводит к увеличению энергии системы, к возрастанию активности воды.
Относительное изменение объема клетки.
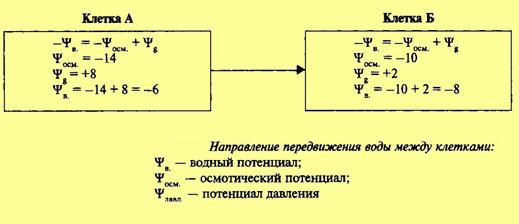
Таким образом водный потенциал клетки зависит прежде всего от концентрации осмотически действующих веществ — осмотического потенциала, который всегда отрицателен, и от потенциала давления в большинстве случаев положительного. Сказанное можно выразить следующим образом: Иначе говоря, водный потенциал показывает, насколько энергия воды в клетке меньше энергии чистой воды. В состоянии плазмолиза или завядания вода не давит на клеточную оболочку. Противодавление клеточной оболочки равно 0. Водный потенциал равен осмотическому потенциалу. По мере поступления воды в клетку появляется противодавление клеточной оболочки. В этом случае водный потенциал клетки будет равен разности между осмотическим потенциалом и противодавлением оболочки (потенциалом давления). Чем больше поступает воды в клетку, тем больше возрастает тургор и противодавление оболочки. Наконец наступает такой момент, при котором клеточная оболочка растягивается до предела, осмотический потенциал целиком уравновешивается противодавлением клеточной оболочки, а водный потенциал становится равным нулю. Из сказанного видно, что при переходе клетки из состояния плазмолиза к тургору водный потенциал меняется очень резко — от всей величины осмотического потенциала до нуля. Вместе с тем нельзя не отметить, что при наступлении полного тургора величина осмотического потенциала в результате поступления воды также несколько изменяется, он становится менее отрицательным. Однако это изменение составляет всего 15—20%. В обычных условиях осмотический потенциал клетки не уравновешен полностью противодавлением. Это показывает, что клеточная оболочка еще не полностью растянута и вода может поступать в клетку. Разница между осмотическим потенциалом клеточного сока и противодавлением клеточной оболочки определяет поступление воды в каждый данный момент. Вода всегда поступает в сторону более отрицательного водного потенциала: от той системы, где ее энергия больше, к той, где ее энергия меньше. Необходимо еще раз подчеркнуть, что именно водный потенциал определяет направление передвижения воды. Так, если рядом находятся две клетки А и Б, то вода будет поступать по градиенту не осмотического, а водного потенциала, в сторону более отрицательной величины последнего, т. е. из клетки А в клетку Б. Это будет происходить до того момента, пока водные потенциалы соседних клеток не выравняются. При завядании в клетках листа цитоплазма не отстает от клеточной стенки, как при плазмолизе, а сжимается и тянет ее за собой. При этом клеточная оболочка прогибается (циторриз). Развивается натяжение, или отрицательное давление, и потенциал давления приобретает отрицательное значение.
Таким образом, клетка проявляет себя как саморегулирующаяся система. Величина водного потенциала определяется степенью насыщенности клетки водой: чем меньше клетка насыщена водой, тем более отрицателен ее водный потенциал. Существует ряд методов, позволяющих определить. Наиболее простой метод заключается в том, что подбирается раствор, в котором размер клетки не меняется, а следовательно, вода не уходит из клетки и не поступает в нее. Зная молярную концентрацию раствора, можно рассчитать водный потенциал клетки. Говоря о поступлении воды в клетку, надо учитывать, что наряду с осмотическими силами в клетках существуют силы набухания. Набухание связано со способностью гидрофильных коллоидов притягивать к себе молекулы воды. Набухание может рассматриваться как особый вид диффузии, так как движение воды также идет по градиенту концентрации. Водный потенциал клеток становится более отрицательным благодаря присутствию органических веществ, связывающих воду. Силу набухания обозначают термином «матричный потенциал» ). Матричный потенциал определяется влиянием на поступление воды высокомолекулярных компонентов клетки: белков цитоплазмы, полисахаридов клеточной стенки, и особенно пектиновых веществ. Матричный потенциал всегда отрицателен. Хорошо известно, что если сухие семена положить в воду, то они будут увеличиваться в размере. Сила набухания у сухих семян достигает —1000 бар. Большое значение имеет не только для семян, но и для молодых меристематических клеток, в которых отсутствуют вакуоли и которые заполнены цитоплазмой. При поднятии воды на относительно большую высоту (например, у высоких деревьев) на величину давления оказывает влияние сила тяжести. В этом случае в уравнение водного потенциала вводят гравитационный потенциал Ψграв. Поскольку действие силы тяжести снижает активность воды, гравитационный потенциал всегда отрицателен. Возможным механизмом поступления воды является также электроосмос. Секреция воды является следствием разности электрических потенциалов, возникающих с наружной и внутренней стороны мембраны (тонопласта). При этом движение воды может быть вызвано накоплением катионов (К+, Na+), что в свою очередь происходит под влиянием разности электрических потенциалов. Может иметь значение также заглатывание воды клеткой в процессе пиноцитоза.
9. Галофильные растения.
Растения-галофилы, растущие на солончаках и солонцах, называются галофитами. К ним относятся солянки, анабазис,тамарикс, некоторые виды полыни, бессмертники, тамариск и др.). Распространены на морских побережьях (морские марши), а также в местностях с сухим климатом — пустынях, полупустынях и даже степях на особых типах почвы — солонцах исолончаках. Нередко имеют суккулентный облик — с толстыми стеблями и вздутыми листьями, что способствует сохранению труднодоступной влаги.
ГАЛОФИТЫ, растения, приспособленные к жизни на засолённых почвах. Широко распространены по берегам солёных озёр, Аральского и Каспийского морей, на солончаках в полосе полупустынь. В почвах этих территорий много хлористого и сернокислого натрия (глауберова соль), солей магния и т. д. Для большинства растений содержание в почве 2–3 % хлористого натрия уже губительно, в то время как галофиты переносят его в больших количествах. Галофиты интенсивно транспирируют, не способны к длительному завяданию; осмотическое давление в клетках высокое (до 150 атмосфер). Галофитов много среди растений сем. маревых, сложноцветных, что отражено и в их названиях – солянка, солерос и т. п.
10. Механизм поглощения солей растительной клеткой.
Поступление питательных солей в корневую систему носит частично активный характер, связанный с метаболизмом. Об этом свидетельствуют следующие особенности поступления: способность растений к избирательному концентрированию веществ; относительная независимость поступления воды и солей; зависимость от дыхания и фотосинтеза; ускорение процесса под влиянием температуры и света. Необходимо учитывать, что часто трудно провести границу между пассивным (не связанным с затратой энергии) и активным (связанным с затратой энергии) поступлением.
В корневой системе различают два объема — апопласт и симпласт. Тот факт, что оба эти объема участвуют в поглощении солей, был доказан в опытах с меченой серой (Э. Эпстайн). Отрезанные корневые системы ячменя погружали в раствор, содержащий сульфат (S042-), меченный по сере (35S). В одной пробе корней было определено количество серы, поглощенной в течение одного часа. Другую пробу после часового пребывания в растворе помещали в раствор CaS04, не содержащий меченой серы. Сначала 35S быстро обменивалась и выходила в окружающий раствор, затем обмен прекращался. В дальнейшем 35S в растворбольше не выходила. Та часть серы, которая быстро обменивалась, была легкодиффундирующая, поступившая пассивным путем. Оставшаяся часть 35S в растении, очевидно, проникла внутрь клетки через мембрану. Таким образом, эти исследования подтвердили наличие свободного пространства корня (апопласта), т.е. той части тканей, в которую вещества вместе с водой могут поступать путем свободной диффузии. Большинство исследователей считают, что объем свободного пространства составляет 5—10% от всего объема корневой системы. В свободное пространство корня входит поверхность клеточных стенок и система межклетников, сосуды ксилемы. Свободное пространство тканей является внешним по отношению к цитоплазме клеток и внутренним по отношению к органу в целом или к окружающей среде.
Корни поглощают вещества из почвенного раствора (водная фаза) и при контакте с частицами ППК — почвенного поглощающего комплекса (твердая фаза почвы). ППК — это мелкодисперсная коллоидная часть почвы, смесь минеральных (алюмосиликатных) и органических (гуминовых) соединений. Большая часть коллоидов почвы заряжена отрицательно, на их поверхности в адсорбированном (поглощенном) состоянии находятся катионы. Некоторая часть коллоидов почвы в определенных условиях может быть заряжена положительно, поэтому на них в поглощенном адсорбированном состоянии будут находиться анионы. Обменные катионы и анионы — один из важнейших источников питания для растений. Катионы и анионы, находящиеся в поглощенном состоянии на частицах почвенного поглощающего комплекса, могут обмениваться на ионы, адсорбированные на поверхности клеток корня. Так может осуществляться поступление катионов К+, Са2+, Na+ в обмен на протоны, а также анионов N03-, Р043- и других в обмен на НС03- или анионы органических кислот. Особенно эффективно идет поглощение при контактном обмене, при котором происходит обмен ионами без перехода их в раствор. Поглощенные ионы адсорбируются на поверхности клеточных оболочек ризодермы. Из адсорбированного состояния ионы могут по коре корня передвигаться двумя путями: по апопласту и симпласту. При поступлении в симпласт ионы проникают через мембрану и далее передвигаются по плазмодесмам к сосудам ксилемы. Однако такие большие молекулы как белки не могут преодолеть пространство в плазмодесмах, поэтому имеются специальные механизмы. Поступление ионов через мембрану происходит с помощью переносчиков как пассивно, по градиенту электрохимического потенциала, так и активно, с использованием метаболической энергии. Механизм этого процесса и роль транспортных белков подробно разбирались выше.
Ток воды с растворенными веществами, движущийся по свободному пространству (апопласту), как бы омывает все клетки коры. На всем этом пути могут наблюдаться адсорбция веществ клеточными стенками, поступление ионов в клетки через соответствующие мембраны и включение их в обмен веществ, т. е. метаболизация. Необходимо учесть, что на пути движения по апопласту имеется преграда в виде клеток эндодермы с поясками Каспари. Передвижение через клетки эндодермы возможно, по-видимому, только через цитоплазму. Даже если признать наличие в стенках клеток эндодермы промежутков для свободной диффузии, то они настолько малы, что вещества не могут через них проникнуть. В связи с этим перенос ионов через мембраны клеток эндодермы необходим и также осуществляется с помощью переносчиков. В целом между апопластом и симпластом в корневой системе происходит непрерывное взаимодействие и обмен питательными солями. По мнению некоторых исследователей, основным для транспорта ионов является симпластный путь, отличающийся от апопластного большей эффективностью и возможностью осуществлять метаболическую регуляцию. В осуществлении этого большая роль принадлежит осморегулирующей функции вакуолей. Вопрос, что является движущей силой, заставляющей клетки корня секретировать ионы в сосуды ксилемы, является спорным. Имеется мнение, что клетки, расположенные около сосудов ксилемы, обладают более низкой метаболической активностью по сравнению с более удаленными благодаря меньшему содержанию в них кислорода. В силу низкой интенсивности дыхания эти клетки не удерживают соли и отдают их в сосуды ксилемы. Затем соли вместе с водой благодаря градиенту водного потенциала поднимаются по сосудам вверх (массовый ток). Последние биохимические исследования показывают, что важную роль в переносе ионов в ксилему имеют паренхимные клетки ксилемы. Плазмалемма этих клеток содержит протонные помпы, водные каналы и различные ионные каналы, которые специализированы в поступлении и отдаче веществ. Так, в паренхиме идентифицированы два типа ионных каналов: К-специфичные и неспецифичные. Эти каналы регулируются благодаря мембранному потенциалу и концентрации калия. Из этих данных следует, что транспорт ионов из паренхимы в сосуды ксилемы находится под контролем обмена веществ путем регуляции Н+-АТФазы плазмалеммы и ионных каналов.
