
- •Часть 1
- •Лабораторная работа № 1 растворы. Расчеты и техника приготовления растворов различных концентраций. Определение концентрации раствора методом титрования
- •Лабораторная работа № 2 химическая кинетика и равновесие
- •Скорость химической реакции
- •Химическое равновесие
- •Лабораторная работа № 3 растворы электролитов
- •2.1 Сравнение относительной силы соляной и уксусной кислот
- •2.2 Сравнение относительной силы гидроксидов натрия и аммония
- •3.1 Образование малорастворимых веществ
- •3.2 Образование газообразных веществ
- •3.3 Образование слабых кислот и оснований
- •3.4 Реакции нейтрализации
- •5.1 Смещение равновесия в растворе гидроксида аммония
- •5.2 Смещение равновесия в растворе уксусной кислоты
- •Лабораторная работа № 4 буферные растворы
- •Лабораторная работа № 5 гидролиз солей
- •Гидролиз фосфата калия k3po4
- •Опыт 1. Различные случаи гидролиза солей
- •2.1 Влияние силы кислоты и основания, образующих соль, на степень ее гидролиза
- •2.2. Влияние концентрации раствора на степень гидролиза соли
- •2.3 Влияние температуры на степень гидролиза соли
- •Опыт 3. Смещение равновесия гидролиза
- •Лабораторная работа №6 окислительно-восстановительные реакции
- •Лабораторная работа № 7 получение и очистка золя гидроксида железа (III). Изучение его коагуляции и стабилизации
- •Приложение а
- •Приложение б
- •Приложение в
- •212027, Могилев, пр-т Шмидта, 3.
- •212027, Могилев, пр-т Шмидта, 3.
2.3 Влияние температуры на степень гидролиза соли
Налейте в пробирку до половины ее объема дистиллированной воды и внесите в нее 2 – 3 микрошпателя ацетата натрия CH3COONa. Напишите ионное уравнение гидролиза этой соли. Прибавьте 1 – 2 капли фенолфталеина. Какова окраска индикатора в растворе? Каково значение рН среды?
Половину полученного раствора отлейте в другую пробирку и оставьте для сравнения, а пробирку с оставшимся раствором нагрейте в горячей водяной бане. Как изменилась окраска раствора? Какой вывод об изменении концентрации ионов ОН-в растворе можно сделать на основании изменения окраски фенолфталеина?
Охладите пробирку с раствором под струей холодной воды. Что наблюдается? Сделайте вывод о влиянии температуры на степень гидролиза солей и дайте объяснение.
Опыт 3. Смещение равновесия гидролиза
Налейте в пробирку 2–3 капли концентрированного раствора хлорида железа (III) FeCl3(соль образована слабым основанием и слабой кислотой, ее гидролиз протекает в основном только по 1-й ступени), а затем добавьте по каплям концентрированный раствор карбоната натрия Na2CO3(соль образована, напротив, сильным основанием и слабой кислотой, ее гидролиз также протекает в основном только по 1-й ступени) до появления осадка и выделения газа. В результате сливания двух вышеуказанных растворов происходит образование соли, полученной из слабых оснований и кислоты. Эта соль подвергается полному гидролизу. Напишите молекулярные и ионные уравнения реакции.
Опыт 4. Определение константы и степени гидролиза солей измерением рН раствора
Определите рН 0,1 М раствора NH4Clпри помощи рН-метра.
Затем разбавлением исходного раствора приготовьте 0,001 М раствор NH4Cl. Для этого пипеткой на 1 мл отмерить 1 мл 0,1 М раствораNH4Cl, внесите в колбу на 100 мл. Довести объем раствора в колбе до метки дистиллированной водой, закройте колбу пробкой и тщательно перемешайте раствор, переворачивая колбу несколько раз. Определить рН полученного раствора хлорида аммония.
Вычислите константы гидролиза соли NH4Cl (Кгидр) по найденным значениям рН, исходя из следующих соображений.
В соответствии с уравнением гидролиза NH4Cl:
![]()
![]()
![]()
константа гидролиза этой соли равна:
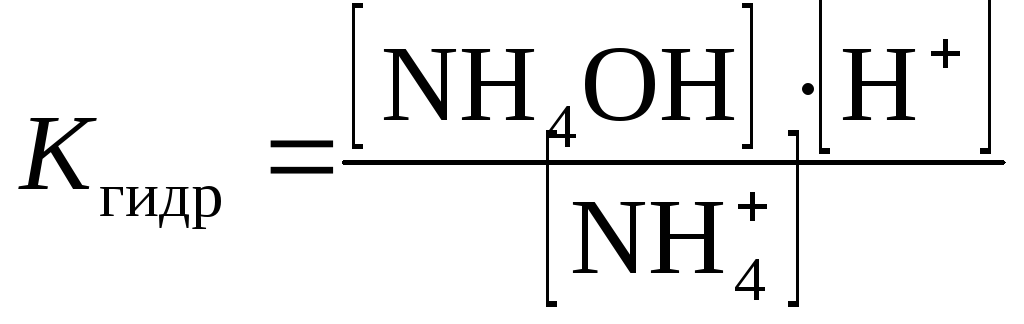
Из уравнения гидролиза видно, что [NH4OH] = [H+]. Вследствие практически полной диссоциации солей в растворе при небольших значениях степени гидролиза равновесная концентрацияNH4+-иона мало отличается от начальной, т.е. можно принять, что [NH4+]равн.=Ссоли.Тогда получаем расчетную формулу:
![]()
Ссолив растворах известна, а концентрацию Н+-ионов вычислите для каждого случая по найденным экспериментально значениям рН.
Вычислите степень гидролиза NH4Clво всех исследованных растворах.
Степень гидролиза hсвязана с константой гидролиза следующим уравнением:
![]() ,
,
откуда
![]()
Сравните экспериментальные значения Кгидриhв растворах хлорида аммония с вычисленными. Сделать вывод о влиянии концентрации соли на константу гидролиза и степень гидролиза при неизменной температуре.
Контрольные вопросы и задания
Что такое гидролиз солей? Дайте определение.
Какие соли подвергаются гидролизу? Приведите примеры.
Как рассчитать константу гидролиза?
Какие факторы влияют на гидролиз солей и почему?
Как влияет нагревание раствора на протекание гидролиза?
Как влияет разбавление на протекание гидролиза?
Составьте молекулярные и ионные уравнения гидролиза следующих солей: NaCN,ZnBr2,Fe2(SO4)3,KNO2,K2SO3, СH3COONa,Pb(NO3)2,NH4Cl,Na2S,K3PO4,NH4NO3,K2CO3,CuCl2,KCN,NiSO4, (NH4)2SO4,FeCl3,Ba(NO2)2,AlBr3,Cr(NO3)3,Ca(CH3COO)2,Na3PO4,Ba(CN)2,Na2SO3,KCNS,Na2CO3,CuSO4,NiCl2,NaNO2,Fe(NO3)3,ZnSO4,LiNO2,CdCl2,Ca(CN)2,FeBr3,Cu(NO3)2,Ba(CH3COO)2,CoSO4,CrCl3,Ca(NO2)2,NH4Br,Al2(SO4)3,CrCl3,CH3COOK,AlCl3,NH4I,Cr2(SO4)3. В какой цвет будет окрашен универсальный индикатор в растворах этих солей?
