
ФизХим_рабочая тетрадь
.pdfЛАБОРАТОРНАЯ РАБОТА № 3
Тема. Получение буферных растворов и изучение их свойств.
Основные понятия.
Раствор –
Электролит –
рН –
Буферный раствор –
Буферное действие –
Ход работы.
Опыт 1. Приготовление буферных систем.
Таблица 3 – Строение и свойства исследуемых буферных систем
Номера |
Объем |
Объем |
Объем буферного |
рН |
рН |
стаканчика |
CH3COOН, мл |
CH3COONa, мл |
р-ра, мл |
теорет. |
экспер. |
1 |
1,5 |
13,5 |
15 |
|
|
2 |
7,5 |
7,5 |
15 |
|
|
3 |
13,5 |
1,5 |
15 |
|
|
Теоретическое значение рН буферных систем рассчитать по формуле:
рН = – lgКдис(кисл) – lgVкисл + lgVсоли,
где: Кдис(кисл) – константа диссоциации слабой кислоты,
Vкисл и Vсоли – объемы растворов кислоты и соли.
Расчеты:
Совпали ли теоретически рассчитанные значения рН буферных растворов с экспериментально измеренными?
Опыт 2. Разбавление буферного раствора.
Таблица 4 – Влияние разбавления на буферную систему
Исходное рН |
рН после разбавления |
||
1:1 |
1:2 |
||
|
|||
|
|
|
|
Изменилось ли значение рН буферного раствора и почему?
11
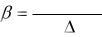
Опыт 3. Действие кислот и щелочей на буферные растворы. Таблица 5 – Сравнение свойств буферных растворов
Исследуемый |
Исходное |
рН после |
рН после |
раствор |
рН |
добавления НСl |
добавления NaOH |
Раствор 1 |
|
|
– |
Раствор 3 |
|
– |
|
Н2О |
|
|
|
Изменились ли значения рН буферных растворов после прибавления кислоты и щелочи? Сравнить эти изменения с чистой водой.
Опыт 4. Измерение буферной ѐмкости.
Таблица 6 – Определение буферной емкости буферных растворов
Растворы |
Исходное |
Объем прилитой |
рН после |
Буферная емкость |
|
рН |
NaOH, мл |
приливания NaOH |
(β), мэкв/л |
||
|
|||||
|
|
|
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
Величины буферной емкости определить исходя из уравнения:
CT  VT
VT
VБ  pH ,
pH ,
где СТ – нормальная концентрация добавленной щелочи;
VT – объем в мл добавленной сильной кислоты или щелочи; VБ – объем буферной системы в мл;
рН – величина изменения рН буферной системы при титровании.
Расчеты:
В каком растворе буферная емкость выше и почему?
Опыт 5. Измерение буферных свойств почвенной вытяжки. Таблица 7 – Буферная емкость почвенной вытяжки
Тип |
Исходное |
Объем прилитого |
рН после |
Буферная емкость |
почвы |
рН |
электролита, мл |
приливания |
(β), мэкв/л |
|
|
|
|
|
Высоко ли значение буферной емкости почвенной вытяжки по сравнению с растворами предыдущего опыта?
Вывод. Выводы делать после каждого опыта.
12

ЛАБОРАТОРНАЯ РАБОТА № 4
Тема. Электрохимические процессы. Кондуктометрическое изучение свойств раствора слабого электролита.
Основные понятия.
Диссоциация –
Степень диссоциации –
Константа диссоциации –
Молярная электропроводность –
Удельная электропроводность –
Ход работы.
1.Приготовить растворы электролитов.
2.Измерить величину удельной электропроводности растворов.
3.Сделать расчеты и построить графики.
Таблица 11 – Физико-химические свойства растворов электролитов, полученные на основе измерения электрической проводимости
Электролит |
H2O |
|
CH3COOH |
|
|
CM, моль/л |
дист. |
0,01 |
0,05 |
0,1 |
0,5 |
Удельная электрическая |
|
|
|
|
|
проводимость κ, мкСм/см |
|
|
|
|
|
Молярная электрическая |
– |
|
|
|
|
проводимость λ, См·см2/моль |
|
|
|
|
|
, См·см2/моль |
– |
|
|
|
|
|
|
|
|
|
|
Степень диссоциации α, % |
– |
|
|
|
|
|
|
|
|
|
|
Константа диссоциации |
– |
|
|
|
|
кислоты, Кдис (эксперим.) |
|
|
|
|
|
|
|
|
|
|
|
Кдис (эксперим.) средняя |
– |
|
|
|
|
|
|
|
|
|
|
Константа диссоциации |
– |
|
|
|
|
кислоты, Кдис |
|
|
|
|
|
|
|
|
|
|
|
Величину молярной электропроводности рассчитать из уравнения:
1000 
С
Предельное значение λ∞ рассчитать согласно выражению:
13

Степень диссоциации определить по уравнению Аррениуса:
Кдис
Константу диссоциации рассчитать по закону Оствальда:
График зависимости κ–CM
График зависимости λ–CM
14
.
2 С .
1

График зависимости α–CM
Расчеты:
Выводы.
Как изменяются удельная и молярная электрические проводимости растворов при разбавлении растворов электролитов?
Сравните экспериментальные и табличные значения молярной электрической проводимости при бесконечном разбавлении и константы диссоциации электролита. В чем причина их различий?
Как влияет разбавление электролита на степень его диссоциации?
15
ЛАБОРАТОРНАЯ РАБОТА № 5
Тема. Поверхностные явления. Исследование адсорбции поверхностноактивного вещества (ПАВ) из раствора на поверхности твердого тела
Основные понятия.
Сорбция –
Десорбция –
Сорбент –
Сорбат (сорбтив) –
Поверхностно-активное вещество –
Изотерма –
Ход работы.
1.Приготовить растворы.
2.Отобрать аликвоту и протитровать.
3.В остаток добавить адсорбент.
4.Профильтровать.
5.Отобрать аликвоту и протитровать.
6.Сделать расчеты и построить графики.
Таблица 13 |
– Приготовление растворов для опыта |
|
|
|
|||
|
Номера колб |
1 |
2 |
3 |
4 |
5 |
|
|
Количество кислоты, мл |
50 |
25 |
12,5 |
6 |
3 |
|
|
Количество воды, мл |
0 |
25 |
37,5 |
44 |
47 |
|
Таблица 14 |
– Результаты опыта |
|
|
|
|
|
|
Номер колбы
1
2
3
4
5
До После адсорбции адсорбции
(NaOH) |
ты, моль/л |
(NaOH) |
ты, моль/л |
0 |
- |
1 |
- |
V |
к |
V |
к |
|
0 |
|
1 |
|
С |
|
С |
|
|
|
|
Кол-во поглощенной кислоты, x = C0 – C1
x |
|
lgC1 |
lg |
x |
|
|
m |
1 |
|
1 |
||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
С1 |
|||
m |
m |
|
|
x |
|
Г |
|
|
||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
16

Концентрацию кислот рассчитывать по закону эквивалентов:
Сн(к-ты)·V(к-ты) = Cн(NaOH)·V(NaOH).
График зависимости сорбции x от концентрации С1 (изотерма адсорбции) m
График зависимости lg mx от lgC (для нахождения констант в уравнении Фрейндлиха)
17

График зависимости |
1 |
от |
1 |
(для нахождения констант в уравнении Ленгмюра) |
|
Г |
С |
||||
|
|
|
Расчеты.
Вывод.
|
x |
|
1 |
|
|
|
|
КС |
|
|
Привести уравнения Фрейндлиха |
KC n |
и Ленгмюра Г |
Гмакс |
|
|
с |
||||
m |
1 |
КС |
||||||||
|
|
|
|
|
|
|||||
найденными константами и сделать вывод о применимости этих уравнений к данному виду адсорбции.
18

ЛАБОРАТОРНАЯ РАБОТА № 6
Тема. Коллоидные растворы. Получение и свойства коллоидных растворов.
Основные понятия.
Дисперсность –
Коллоидное состояние –
Коагуляция –
Ход работы.
Таблица 15 – Получение и изучение свойств коллоидных растворов
Методика опыта |
Наблюдения |
Вывод (свойство коллоидного раствора). |
Опыт 1. Конденсационный метод получения золя гидроксида железа в реакции гидролиза.
а) |
Налить |
в |
колбу |
|
Формула мицеллы с указанием строения. |
||||
воды, |
нагреть |
до |
|
|
|
|
|
||
кипения, |
|
прилить |
|
|
|
|
|
||
FeCl3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
б) в колбу с холодной |
|
|
|
|
|
||||
водой прилить FeCl3 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|||
в) |
отфильтровать золь |
|
|
|
|
|
|||
гидроксида |
железа |
|
|
|
|
|
|||
(III). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
г) |
прилить |
раствор |
|
|
|
|
|
||
сульфата |
|
магния |
|
|
|
|
|
||
(MgSO4). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Опыт 2. Определение знака заряда коллоидной частицы. |
|
|
|
||||||
На |
фильтровальную |
|
Подклеить |
образец |
бумаги |
с |
|||
бумагу нанести каплю |
|
проведенным капиллярным анализом. |
|
||||||
золя |
гидроксида |
|
|
|
|
|
|||
железа (III). |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19 |
|
|
|
|
Методика опыта |
|
Наблюдения |
|
Вывод (свойство коллоидного раствора). |
||||
Опыт 3. Получение золя берлинской лазури. |
|
|
|
|||||
К |
раствору |
|
|
Формула мицеллы с указанием строения. |
||||
К4[Fe(CN)6] добавить |
|
|
|
|
|
|
||
воды, а затем добавить |
|
|
|
|
|
|
||
раствор FeCl3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
На фильтровальную |
|
|
Подклеить |
образец |
бумаги |
с |
||
бумагу нанести каплю |
|
|
проведенным капиллярным анализом. |
|
||||
золя |
берлинской |
|
|
|
|
|
|
|
лазури |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Опыт 4. Получение золя канифоли методом замены растворителя. |
|
|
||||||
Налить |
воды |
и |
|
|
|
|
|
|
добавить |
спиртовой |
|
|
|
|
|
|
|
раствор |
канифоли, |
|
|
|
|
|
|
|
взболтать. |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Опыт 5. Дисперсионный метод получения золя окиси алюминия. |
|
|
||||||
|
|
|
|
|||||
Оксид |
алюминия |
|
|
Формула мицеллы с указанием строения. |
||||
(А12О3) поместить в |
|
|
|
|
|
|
||
пробирки, |
заполнить |
|
|
|
|
|
|
|
их водой и в одну |
|
|
|
|
|
|
||
добавить |
раствор |
|
|
|
|
|
|
|
NaOH. Встряхнуть |
и |
|
|
|
|
|
|
|
отфильтровать. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Прилить |
MgSO4 |
и |
|
|
|
|
|
|
взболтать. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20 |
|
|
|
|
