
- •ВВЕДЕНИЕ
- •1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
- •1.1. Химическая реакция
- •1.2. Классификация веществ
- •1.3. Количественные расчеты в химии
- •2. СТРОЕНИЕ АТОМА
- •2.1. Развитие представлений о строении атома
- •2.1.1. Теория строения атома Бора
- •2.1.2. Особенности описания микрочастиц
- •2.2. Основные понятия волновой механики
- •2.2.1. Волновое уравнение
- •2.2.2. Решение уравнения Шрёдингера для простейших случаев
- •2.3.1. Основное состояние атома водорода
- •2.3.2. Радиальное распределение электронной плотности. Электронная орбиталь
- •2.3.3. Возбужденные состояния атома водорода
- •2.3.4. Многоэлектронные атомы
- •2.4. Периодический закон и таблица элементов
- •2.4.1. Электронные конфигурации многоэлектронных атомов
- •2.4.2. Связь периодического закона со строением атома
- •2.4.3. Физико-химические характеристики атома
- •Контрольные вопросы
- •3. ХИМИЧЕСКАЯ СВЯЗЬ
- •3.1. Основные характеристики и классификация моделей химической связи
- •3.1.1. Основные параметры химической связи
- •3.1.2. Типы химической связи
- •3.2. Ковалентная химическая связь
- •3.2.1. Метод валентных связей
- •3.2.3. Геометрия простейших молекул. Гибридизация АО
- •3.2.4. Донорно-акцепторный механизм образования ковалентной связи
- •3.2.5. Метод молекулярных орбиталей
- •3.2.6. Полярность связи и дипольный момент молекулы
- •Контрольные вопросы
- •4. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ
- •4.1. Межмолекулярные взаимодействия
- •4.1.2. Водородная связь
- •4.2. Химическая связь в твердом теле
- •4.2.1. Основные понятия о строении кристаллов
- •4.2.3. Ковалентные (атомные) кристаллы
- •4.2.4. Ионные кристаллы. Ионный тип химической связи
- •4.2.5. Химическая связь в металлах
- •4.2.6. Зонная модель кристаллического тела
- •4.2.7. Металлы, полупроводники и диэлектрики
- •4.2.8. Кристаллические материалы
- •4.2.9. Аморфные твердые тела
- •4.3. Химическая связь в жидкостях
- •Контрольные вопросы
- •5. ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •5.1. Основные понятия и определения
- •5.1.1. Термодинамическая система
- •5.1.2. Термодинамический процесс
- •5.2. Тепловые эффекты физико-химических процессов
- •5.2.1. Внутренняя энергия
- •5.2.2. Первое начало термодинамики
- •5.2.3. Тепловой эффект химической реакции
- •5.2.4. Термохимические расчеты
- •5.3. Направление и пределы протекания химического процесса
- •5.3.1. Второе начало термодинамики
- •5.3.2. Энтропия
- •5.3.3. Направление химического процесса
- •5.3.4. Химический потенциал
- •Контрольные вопросы
- •6. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
- •6.1. Механизм химической реакции
- •6.1.1. Частицы, участвующие в химической реакции
- •6.1.2. Классификация химических реакций
- •6.2. Элементарная химическая реакция
- •6.2.1. Скорость химической реакции
- •6.2.2. Зависимость скорости химической реакции от концентрации реагирующих веществ
- •6.2.3. Константа скорости химической реакции
- •6.3. Формальная кинетика гомогенных реакций
- •6.3.1. Кинетические уравнения реакций
- •6.3.2. Зависимость скорости реакции от температуры
- •6.3.3. Определение кинетических параметров реакции
- •6.4. Цепной механизм химической реакции
- •6.5. Индуцированные реакции
- •6.5.1. Фотохимические реакции
- •6.5.2. Радиационно–химические процессы
- •6.6. Макрокинетика
- •6.6.1. Гетерогенные реакции
- •6.6.2. Горение и взрыв
- •6.7. Катализ
- •6.7.1. Гомогенный катализ
- •6.7.2. Гетерогенный катализ
- •Контрольные вопросы
- •7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •7.1. Термодинамическое условие химического равновесия
- •7.2. Кинетическое условие химического равновесия
- •7.3. Расчет равновесного состава газовой смеси
- •7.4. Равновесия в растворах
- •7.4.1. Растворы
- •7.4.2. Электролитическая диссоциация
- •7.4.3. Ионное произведение воды. Водородный показатель
- •7.4.4. Растворы кислот и оснований
- •7.4.5. Буферные растворы
- •7.4.6. Гидролиз солей
- •7.4.7. Обменные реакции с образованием осадка
- •7.5. Фазовые равновесия
- •7.5.1. Диаграмма состояния однокомпонентной системы
- •7.5.2. Диаграмма состояния двухкомпонентной системы
- •7.5.3. Кипение и кристаллизация растворов
- •7.5.4. Электролиты
- •Контрольные вопросы
- •8. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •8.1. Основные понятия и определения
- •8.2. Электродные процессы
- •8.2.1. Скачок потенциала на границе «металл–электролит»
- •8.2.2. Уравнение Нернста
- •8.2.3. Электроды
- •8.3. Неравновесные электрохимические системы
- •8.3.1. Гальванический элемент
- •8.3.2. Окислительно-восстановительные реакции в водных растворах
- •8.3.3. Электролиз
- •8.4. Кинетика электрохимических процессов
- •8.4.1. Скорость электрохимических процессов
- •8.4.2. Поляризация электродов
- •8.5. Практическое использование электрохимических процессов
- •8.5.1. Химические источники тока
- •8.5.2. Применение электролиза
- •Контрольные вопросы
- •9. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- •9.1. Коррозионные процессы
- •9.2. Химическая коррозия
- •9.2.1. Высокотемпературная газовая коррозия
- •9.2.2. Кинетика роста оксидных пленок
- •9.2.3. Факторы, влияющие на скорость газовой коррозии
- •9.3. Электрохимическая коррозия
- •9.3.1. Анодные и катодные реакции
- •9.3.2. Термодинамические условия электрохимической коррозии металлов
- •9.3.3. Факторы, влияющие на скорость электрохимической коррозии
- •9.4. Коррозионные среды и влияние дополнительных факторов
- •9.4.1. Коррозионно-механическое разрушение металлов
- •9.4.2. Водородная коррозия
- •9.4.3. Радиационная коррозия
- •Контрольные вопросы
- •Библиографический список

в центре которого находится ион Cu+2, в вершинах квадрата – четыре иона Cl-.
z
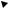 y
y
x
Рис. 3.14. Схема ориентации в пространстве четырех dsp2-гибридных орбиталей
5. d2sp3-гибридизация: одна s-, две d- и три p-орбитали образуют шесть d2sp3-гибридных орбиталей, направленных в вершины октаэдра (многогранника, образованного восьмью равносторонними
треугольниками) |
(рис. |
3.15) |
( Ψd 2sp3 =c1 Ψs +c2 Ψpx +c3 Ψpy + |
|||||
+c4 Ψpz +c5 Ψd |
x2 |
−y2 |
+c6 |
Ψd |
2 ). |
|
|
|
|
|
z |
|
|
|
z |
||
П р и м е р. Ион [PtCl6]-2 представляет |
|
|||||||
|
||||||||
собой плоский квадрат, в центре которого |
|
y |
||||||
находится ион Pt+4, в вершинах квадрата – |
|
|
||||||
|
|
|||||||
четыре иона Cl-, над и под плоскостью |
|
x |
||||||
квадрата располагаются еще два иона Cl- |
|
|
||||||
|
|
|||||||
(октаэдр, в вершинах которого располага- |
Рис. 3.15 Схема ориента- |
|||||||
ются ионы хлора, а в центре − ион плати- |
ции в пространстве шес- |
|||||||
ны). Расстояние между ионом платины и |
ти d 2sp3-гибридных ор- |
|||||||
всеми ионами хлора одинаково. |
Валент- |
биталей |
||||||
ные углы равны 90о.
3.2.4. Донорно-акцепторный механизм образования ковалентной связи
Единичная ковалентная связь между атомами может возникнуть не только в результате образования пары электронов из двух неспаренных электронов, принадлежащих обоим атомам. Обобществленная пара электронов может образовываться и в том случае, когда оба атома не имеют неспаренных электронов, но один из них имеет неподеленную пару электронов, а другой – свободную орбиталь. Первый атом предоставляет для образования связи свою неподеленную пару, он называется донором, а второй предоставляет свободную орбиталь, принимая (акцептируя) на нее эту неподе-
82
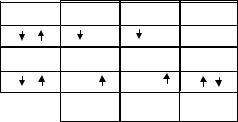
ленную пару, он называется акцептором. Причем образующаяся связь ничем не будет отличаться от других ковалентных связей. Часто говорят об образовании донорно-акцепторной (координационной) химической связи, но при этом надо помнить, что она не является особым типом химической связи, а название указывает только на механизм образования.
П р и м е р. Молекула оксида углерода (CO). По методу ВС между атомами углерода и кислорода может образовываться двойная связь, поскольку они имеют по два неспаренных электрона. Эксперимент показывает, что энергия связи в молекуле CO существенно больше и по величине соответствует тройной связи. Образование третьей связи может происходить по донорноакцепторному механизму. Перекрывание px-орбиталей атомов уг-
лерода и кислорода приводит к образованию σ-связи. Неспарен- |
||||
ные py-электроны углерода и кислорода образуют π-связь. Свобод- |
||||
ная pz-орбиталь углерода и неподеленная пара электронов |
||||
кислорода на pz-орбитали образуют вторую π-связь (рис. 3.16). |
||||
C |
2s2 |
2px1 |
2py1 |
2pz0 |
акцептор |
|
|
|
|
O |
2s2 |
2px1 |
2py1 |
2pz2 |
донор |
|
|
|
|
|
|
σ−связь |
π−связь |
π−связь |
Рис. 3.16. Схема образования ковалентной связи в молекуле СО |
||||
Донорно-акцепторный механизм объясняет образование ковалентной химической связи между молекулами и ионами, которые в обычном смысле не имеют валентных электронов и не могут образовывать химическую связь, например, в комплексных соединени-
ях. Комплексные (координационные) соединения – химические со-
единения, в молекулах которых можно выделить центральный атом (комплексообразователь) и непосредственно связанные с ним молекулы или ионы (лиганды). Центральный атом и лиганды образуют внутреннюю сферу. Внешнюю сферу составляют, как правило, ионы, компенсирующие заряд внутренней сферы. Например,
[H3O]Cl, [NH4]OH, K[BF4], [Cu(NH3)4]Cl и т.д. Центральный атом
83

связан с лигандами ковалентной связью, образованной по донор- но-акцепторному механизму. Причем центральный атом может быть как донором, так и акцептором.
Комплексный ион пишется в квадратных скобках, участвует в обменных химических реакциях как единая частица. Заряд комплексного иона определяется алгебраической суммой зарядов центрального атома и лигандов. Число лигандов – координационное число центрального атома.
П р и м е р 1. Ион аммония [NH4]+ NH3 + H+ → [NH4]+
Атом азота в молекуле аммиака имеет три неспаренных p- электрона и может образовать связи с тремя атомами водорода. На 2s-орбитали находится пара электронов. Ион водорода имеет свободную 1s-орбиталь. На ней может разместиться неподеленная па-
ра электронов азота (рис. 3.17). В результате образуется ион
[NH4]+.
N |
2s2 |
2px1 |
2py1 |
2pz1 |
|
донор |
|
|
|
|
|
H+ |
2s0 |
2s1 |
2s1 |
2s1 |
H |
акцептор |
|
|
|
|
|
|
σ-связь σ-связь |
σ-связь |
σ-связь |
|
|
Рис. 3.17. Схема образования ковалентной связи в ионе аммония |
|||||
Эксперимент показывает, что ион аммония имеет тетраэдрическую конфигурацию и все четыре связи N-H равноценны. Это свидетельствует о sp3-гибридизации валентных орбиталей атома азота.
П р и м е р 2. Ион [BF4]− BF3 +F− → [BF4] −
Атом бора в молекуле фторида бора имеет три электрона, занимающих sp2-гибридные орбитали, которые использует для образования ковалентной связи с атомами фтора, и одну 2pz-свободную орбиталь. Ион фтора имеет неподеленные пары электронов, одна из которых может расположиться на свободной орбитали бора. Это позволяет изменить гибридизацию атомных орбиталей бора на
84

sp3. Образовавшийся ион имеет тетраэдрическую конфигурацию и четыре равноценных иона фтора (рис. 3.18).
F- |
|
2s2 |
|
2px2 |
|
2py2 |
|
2pz2 |
|
|||||||
донор |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
B* |
|
2s1 |
|
2px1 |
|
2py1 |
|
2pz0 |
|
|
||||||
|
|
|
|
|
||||||||||||
акцептор |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F |
|
2s2 |
|
2px2 |
|
2py2 |
|
2pz1 |
|
|||||||
|
|
|
|
|||||||||||||
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 3.18. Схема образования ковалентной связи в ионе [BF4] −
3.2.5. Метод молекулярных орбиталей
Параллельно с методом ВС для описания ковалентной химической связи был разработан метод молекулярных орбиталей (МО), существенный вклад в создание которого внес Роберт Малликен.
Метод базируется на следующих положениях:
1.Каждый электрон в молекуле движется в результирующем поле всех ядер и остальных электронов. Молекула рассматривается как единая частица. (В методе валентных связей электрон находится в эффективном поле своего ядра, а молекула описывается как система взаимодействующих атомов.)
2.Состояние электрона в молекуле описывается волновыми функциями, которым соответствуют молекулярные орбитали, подобно атомным орбиталям. Молекулярные орбитали, в отличие от атомных, многоцентровые, поскольку в молекуле имеется не менее двух ядер. Волновая функция молекулярных орбиталей может быть получена сложением или вычитанием волновых функций атомных орбиталей (линейная комбинация АО).
3.Заполнение электронами молекулярных орбиталей осуществляется на основе тех же принципов, что и заполнение атомных орбиталей (принцип минимума энергии, принцип Паули, правило Хунда). Совокупность молекулярных орбиталей называется элек-
тронной конфигурацией молекулы.
Модельной системой при разработке принципов МО был молекулярный ион водорода H2+, который состоит из двух положительно заряженных ядер и одного электрона. Волновая функция, описывающая состояние электрона в этой системе, может быть
85

представлена как линейная комбинация волновых функций основного состояния атома водорода (1s), т. е. как результат сложения и вычитания волновых функций атомных орбиталей:
Ψ1 =c1 (ΨA +ΨB ), Ψ2 =с2 (ΨА −ΨВ), ci – нормирующие множители (функции нормируется согласно принципу нормировки).
При образовании молекулы из атомов происходит перекрывание атомных орбиталей. Метод МО следующим образом описывает этот процесс. При сложении атомных волновых функций вероятность нахождения электрона в межъядерной области увеличивается, а при вычитании уменьшается. Волновым функция
Ψ1 и Ψ2 соответствуют молекулярные орбитали, схема образования которых показана на рис. 3.19.
Атомные орбитали |
Молекулярные орбитали |
|
ΨА(1s) |
ΨВ(1s) |
Ψ2 |
|
|
|
Атом А |
Атом В |
Ψ1 |
|
||
Молекула
Рис. 3.19. Схема распределения электронной плотности связывающей (Ψ1) и разрыхляющей (Ψ2) орбиталей в молекулярном ионе водорода
Решение уравнения Шрёдингера с использованием этих волновых функций позволяет определить энергию электрона в молеку-
лярном ионе водорода Е(Ψ1) и Е(Ψ2), которая меньше или больше
на величину ∆Е энергии электрона в изолированных атомах водорода.
Молекулярная орбиталь, соответствующая волновой функции Ψ1, получила название связывающей орбитали, а соответствующая волновой функции Ψ2 – разрыхляющей. Поскольку s-орбитали могут перекрываться только по σ-типу, то их двух 1s-атомных орби-
талей образуется σ-связывающая (σсв) и σ-разрыхляющая (σр) молекулярные орбитали.
Изменение энергии системы в зависимости от расстояния между ядрами для электрона, находящегося на связывающей и разрыхляющей орбиталях, показано на рис 3.20. Нахождение элек-
86

трона на связывающей орбитали приводит к понижению энергии системы, зависимость имеет минимум, соответствующий энергии связи в молекулярном ионе водорода. Нахождение электрона на разрыхляющей молекулярной орбитали приводит к увеличению энергии системы, и молекулярный ион не образуется. Таким образом, условием образования устойчивой системы является превышение числа электронов на связывающих молекулярных орбиталях над числом электронов на разрыхляющих.
∆Ε(r) |
|
а) |
б) |
|
|
|
|||||||
|
|
∆Ε |
|
|
|
|
|
АО |
|||||
|
|
∆Ε2(r) – разрыхляющая |
|
|
АО |
|
|
МО |
|
|
|||
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
σр |
|
|
|
|
|
|
|
r |
|
|
1s |
|
|
|
|
|
1s |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
∆Ε2(r) – связывающая |
|
|
|
|
|
σсв |
|
|
|
||
|
rсв |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 3.20. Зависимость энергии системы (∆Ε(r)) от межъядерного расстояния (а), энергетическая диаграмма молекулярного иона водорода (б)
Для относительной характеристики прочности (энергии) связи вводится понятие кратности связи (формальный порядок связи). Кратность связи К определяется как разность между числом пар электронов на связывающих (nсв/2) и разрыхляющих (nр/2) орбита-
лях: K = (nсв −nр) . 2
Рассмотрение ковалентной связи между двумя атомами на качественном уровне сводится к составлению электронной конфигурации молекулы на основе известных схем энергетических диаграмм. При этом выполняются следующие правила:
1. Выбирают атомные орбитали, принимающие участие в образовании химической связи (валентные орбитали). Ими, как правило, являются орбитали электронов внешнего слоя, которые в значительной степени перекрываются и вносят основной вклад в энергию химической связи. АО внутренних слоев слабо перекрываются, их вклад в энергию связи незначителен, поэтому элек-
87

тронная конфигурация молекулы составляется на основе валентных атомных орбиталей. Для s- и p-элементов валентными орбиталями являются ns- и np-электроны (n – главное квантовое число, равное номеру периода).
2. Взаимодействующие АО должны иметь одинаковую симметрию относительно линии связи, при этом число образующихся МО равно числу исходных. Как было отмечено, ns-атомные орбитали
перекрываются только по σ-типу, образуя две σ-молекулярные оритали. Поскольку перекрывание np-орбиталей осуществляется
как по σ-, так и по π -типу, то образуются две σ- и четыре π- молекулярные орбитали.
3. Используют известные схемы энергетических диаграмм молекул определенного типа.
Для молекул, состоящих из атомов, имеющих ns-валентные атомные орбитали, энергетическая диаграмма была приведена на рис. 3.20. Для молекул, состоящих из атомов, имеющих ns- и np- валентные атомные орбитали, энергетическая диаграмма без учета взаимодействия электронов – на рис. 3.21.
∆E
АО
px py pz
s
МО
σр(px)
πр(py) πр(pz)
πсв(py) πсв(pz)
σсв(px)
σр(s)
σсв(s)
АО
pz py px
s
Рис. 3.21. Энергетическая диаграмма молекулярных орбиталей для ns- и np- АО в случае слабого взаимодействия s и p-электронов
Взаимодействие электронов на σ(s)- и σ(p)-молекулярных орбиталях приводит к изменению относительного положения энергетических уровней МО. На диаграмме σсв(px) и πсв(py), πсв(pz) меня-
88
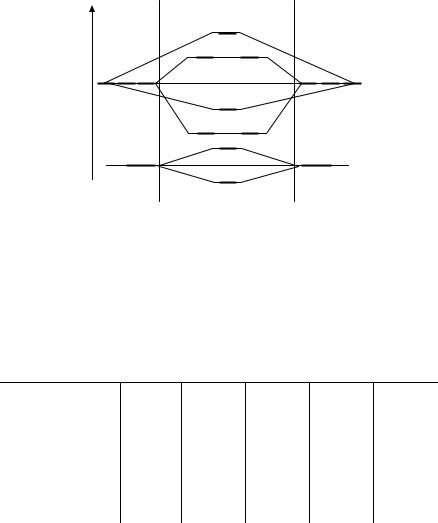
ются местами (рис. 3.22). Это взаимодействие учитывается при малом различии энергии ns- и np-атомных орбиталей, что имеет место для молекул, образованных из атомов второго периода с
Z≤ 7 (от лития до азота).
Пр и м е ч а н и е. Для расчетов величин энергий орбиталей конкретных молекул используют квантово-механические методы.
∆E
АО
px py pz
s
МО
σр(px)
πр(py) πр(pz)
σсв(px)
πсв(py)
σр(s)
σсв(s)
АО
pz py px
s
Рис. 3.22. Энергетическая диаграмма молекулярных орбиталей для ns- и np- АО
сучетом взаимодействия s- и p-электронов
4.Распределение валентных электронов по молекулярным орбиталям производят в соответствии с принципом минимума энергии, принципом Паули и правилом Хунда, как и при распределении электронов по атомным орбиталям.
Распределение валентных электронов по МО молекул и молекулярных ионов элементов первого периодаприведено в табл. 3.2.
Т а б л и ц а 3.2
Частица |
H2+ |
H20 |
|
H2- |
|
He2+ |
|
He20 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Энергетическая |
σр ̶ |
σр ̶̶ |
σр |
↑ |
|
σр ↑ |
|
σр |
↑ ↓ |
|
|
диаграмма |
σсв ↑ |
σсв ↑ ↓ |
σсв ↑ ↓ |
|
σсв ↑ ↓ |
|
σсв ↑ ↓ |
|
|||
Электронная |
σ 1 |
σ 2 |
σ |
2σ |
1 |
σ |
2σ |
1 |
σ |
2σ |
2 |
конфигурация |
св |
св |
св р |
св |
р |
св р |
|||||
Кратность связи |
1/2 |
1 |
|
1/2 |
|
1/2 |
|
|
0 |
|
|
Энергия связи, |
255 |
432 |
|
17 |
|
232 |
|
|
0 |
|
|
кДж/моль |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
Длина связи, Å |
1,06 |
0,74 |
|
- |
|
1,08 |
|
|
- |
|
|
Электронная конфигурация молекул (типа А2; АВ) элементов
89
