
Химия. Вопросы к коллоквиуму 3
.pdf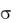
ВОПРОСЫ К КОЛЛОКВИУМУ №3
«Строение атома. Химическая связь. Комплексные соединения. Титриметрический анализ. ФХМА»
для 1 курса ВСиЭ
1.Строение атома. Атомное ядро. Изотопы. Рассчитайте количество протонов, нейтронов
иэлектронов в нуклидах .
2.Двойственная природа электрона. Уравнение Планка. Уравнение де Бройля. Принцип неопределенности Гейзенберга. Атомная орбиталь, виды атомных орбиталей.
3.Природа химической связи. Количественные характеристики химической связи: энергия
идлина связи, валентный угол
4.Ковалентная связь. Основные положения ме¬тода валентных связей (ВС). Механизмы образования ковалентной связи: обменный и донорно-акцепторный.
5.Ковалентная связь полярная и неполярная. Дипольный момент, диполь. Характеристики ковалентной связи: насыщаемость, направленность. - и π-связи.
6.Гибридизация атомных орбиталей. Типы гибридизации (sp, sp2, sp3) и пространственная форма молекул ВеCl2, ВCl3,СН4.
7.Ионная связь, ее характеристика. Свойства ионной связи. Примеры соединений с ионной связью.
8.Водородная связь, ее биологическая роль. Внутри- и межмолекулярная водородная связь.
9.Силы межмолекулярного взаимодействия (силы Ван-дер-Ваальса). Ориентационное, индукционное и дисперсионное взаимодействие.
10.Комплексные соединения, особенности их строения. Номенклатура комплексных соединений. Химическая связь в комплексных соединениях: метод валентных связей.
11.Диссоциация комплексных соединений. Константа нестойкости комплексного иона. Хелатные и внутрикомплексные соединения. Биологическая роль комплексных соединений.
12.Окислительно-восстановительные реакции, их классификация. Окислитель, восстановитель; процесс окисления, восстановления. Укажите важнейшие окислители и восстановители.
13.Электродный потенциал. Механизм его возникновения на примере цинкового электрода. Устройство водородного электрода и его назначение. Уравнение Нернста для электродного потенциала.
14.Окислительно-восстановительный потенциал. Уравнение Нернста для окислительновосстановительного потенциала. Расчет ЭДС реакции.
15.Титрометрический анализ. Титрование. Титранты (рабочие растворы). Точка эквивалентности и способы ее определения. Вычисления в титриметрическом анализе
16.Приготовление титрованных растворов. Стандартные и стандартизированные растворы.
17.Методы титриметрического анализа.
18.Метод кислотно-основного титрования (метод нейтрализации): сущность метода, титранты, индикаторы. Кривые титрования, подбор индикаторов. Определение карбонатной жесткости воды.

19.Метод комплексонометрии: сущность метода, индикаторы, вычисления. Определение общей жесткости воды.
20.Физико-химические методы анализа, их общая характеристика.
21.Оптические методы анализа. Фотоэлектроколориметрия. Закон Ламберта-Бугера-Бера. Оптическая плотность. Принцип работы ФЭКа. Установление концентрации раствора исходя из оптической плотности.
22.Потенциометрия: принцип метода.
23.Хроматография: принцип метода. Сорбция. Адсорбция. Абсорбция.
ЗАДАНИЯ К КОЛЛОКВИУМУ №3
1.Расставить коэффициенты в реакции и рассчитать молярные массы эквивалентов окислителя и восстановителя.
|
|
|
As + H2SO4 |
SO2 + H3AsO3 |
|
2. |
Расставить коэффициенты, указать окислитель и восстановитель в реакции: |
||||
|
|
NaCrO2 + Br2 + NaOH |
Na2CrO4 + NaBr + H2O |
||
|
Определить |
направление |
протекания |
реакции в |
стандартных условиях, если |
|
° CrO42 - / CrO2- = – 0,13В; |
° Br2/2Brˉ = 1,087В. |
|
||
3. |
Расставить коэффициенты в реакции: |
|
|
||
|
|
K2Cr2O7 + K2S + H2SO4 |
Cr2(SO4)3 + S + K2SO4 + H2O |
||
|
Рассчитать |
G реакции |
и константу |
равновесия, |
если ° Cr2O72 - /2Cr3+ = 1,33В; |
°S / S 2 = 1,087В.
= 1,087В.
4.Охарактеризовать строение следующих комплексных соединений и назвать их:
[Cu(H2O)4]SO4, K2[Au(CN)4], K2[Pt(OH)2Cl4], [Pt(NH3)2Cl4]. Написать уравнения их диссоциации в растворе и выражение общей константы нестойкости комплексных ионов.
5.Как приготовить 250 мл 0,3 н раствора трилона Б (Мэ = 186)? Где используется этот раствор?
6.Как приготовить 100 мл 0,05 н раствора буры (Na2B4O7 · 10Н2О)? Где используется этот раствор?
7.Как приготовить 100 мл 0,2 н раствора сульфата магния из МgSО4 · 7Н2О?
8.В колбе объемом 500 мл растворили 4,775 г буры. На титрование 20 мл приготовленного раствора было затрачено 16 мл раствора серной кислоты. Вычислить титр раствора кислоты и массу серной кислоты в 200 мл раствора. (Т = 0,003 г/мл; m H 2 SO4 = 0,6 г)
9.На титрование 16 мл раствора буры, титр которого равен 0,0229 г/мл, пошло 10 мл серной кислоты, а на титрование 12 мл раствора гидроксида калия пошло 15 мл установленного раствора кислоты. Определить молярную концентрацию эквивалента и титр раствора щелочи.(Сн = 0,24 моль/л; Т = 0,0134 г/мл)
10.На титрование 10 мл раствора соли магния было израсходовано 15 мл 0,07 н раствора
трилона Б. Вычислить молярную концентрацию эквивалента раствора соли и массу ионов Mg2+ в 250 мл раствора.(Сн = 0,105 моль/л; m(Mg2+) = 0,315г)
11.На титрование 200 мл воды было затрачено 18 мл 0,1 н раствора трилона Б. Определить общую жесткость воды. (Жводы = 9 ммоль/л)
