
- •Міністерство освіти і науки, молоді та спорту україни
- •Реферат
- •Реферат
- •Розділ 2. Методика та техніка експерименту………………………31
- •Розділ 1. Огляд робіт присвячених дослідженню імпульсного наносекундного розряду у воді
- •1.1. Імпульсний розряд у воді
- •1.2. Кінетика наносекундного розряду в дистильованій воді
- •1.3. Пролонгована мікробна стійкість води, обробленої імпульсними електричними розрядами.
- •1.4. Утворення наночастинок оксиду цинку при електричних розрядах у воді
- •1.5. Морфологія й структура часток оксиду цинку, одержаних електророзрядним способом
- •Розділ 2. Методика та техніка експерименту
- •2.1. Загальна характеристики схеми експерименту
- •2.2. Будова розрядної комірки
- •2.3. Контрольний експеримент
- •Розділ 3. Результати роботи та їх обговорення
- •3.1. Оптичні та елетричні характеристики
- •3.2. Ідентифікація спектрів випромінювання
- •Висновки
- •Література
1.4. Утворення наночастинок оксиду цинку при електричних розрядах у воді
З урахуванням перспективності застосування нанорозмірних структур оксиду цинку [6] становить інтерес розробка методів їхнього контрольованого синтезу для створення структур із заданими властивостями. На даний час найбільше поширенні методи, засновані на хімічному осадженні пари [7], молекулярної епітаксії [8], осадженні з газової фази при термічному [9], лазерному [10] або магнетронному [11] розпиленні металів. У роботі [6] запропоновано метод формування нанорозмірних часток ZnO у результаті розпилення матеріалу електродів при електричних розрядах у рідині.
Розпилення електродів з хімічно чистого цинку здійснювалося в дистильованій воді. Електроди встановлювалися на відстані приблизно 0.5 мм один відносно одного, іскра ініціювалася при подачі на них високовольтних імпульсів напруги. Джерело живлення забезпечувало необхідну вихідну напругу для підтримки розряду при частоті проходження імпульсів 300 Гц. У міру руйнування електродів відстань між ними коректувалося з урахуванням забезпечення стабільності струмових характеристик розряду. Для оптимізації процесу синтезу нанорозмірних часток можна було варіювати величину накопичувальної ємності, індуктивності й активного опору розрядного ланцюга. Напруга й струмові характеристики розряду контролювалися за допомогою імпульсного осициллографа.
В умовах описаного експерименту надходження кисню, необхідного для утворення окису, може бути обумовлено двома причинами: електролізом води і його присутністю в ній у розчиненому вигляді. Для з'ясування механізмів надходження кисню в зону хімічної реакції порівнювали результати формування оксиду цинку без наявності розчиненого газу і зі збагаченням води киснем. Для знегажування вихідної рідини резервуар з водою й установленими в ньому електродами поміщали у вакуумну камеру, що відкачували до припинення інтенсивного газовиділення з об'єму рідини. Після цього до електродів прикладалася напруга, і здійснювався напрацювання часток. Збагачення води киснем досягалося шляхом пропущення кисню через попередньо обезгаженну воду.
Наночастинки ZnO які отримані шляхом випаровування приготовлених колоїдних розчинів в електричній печі при температурі 90° С. Дослідження отриманих матеріалів виконано методами електронної мікроскопії, рентгеноструктурного й люмінесцентного аналізу. Фазова сполука й параметри кристалічної решітки формованих структур досліджувалися за допомогою рентгеноструктурного аналізу на дифрактометрі D8-Advance, результат досягнення кутових залежностей інтенсивностей дифракційних піків розсіяного випромінювання на лінії Cuα (λ = 0.15418 нм). Розмір і форма часток, що утворяться в розчині, установлювалися за світлинами, отриманими на мікроскопі LEO-906E із прискорювальною напругою до 120 кВ. Для одержання ПЕМ-зображень невелика порція колоїдного розчину наносилася на мідну сітку, покриту коллоїдною плівкою. Спектри люмінесценції осаджених з водяного розчину на кремнієву підкладку часток оксиду цинку збуджувалися випромінюванням на довжинах хвиль 270 і 330 нм і реєструвалися на спектрофлуориметері SFL-1211A фірми „SOLAR".
На рис. 1.7.а наведене зображення поверхні зразка ZnO, осадженого на підкладку з монокристалічного кремнію, отримане методом скануючої електронної мікроскопії. Зовнішній вигляд часток, відібраних з колоїдного розчину, за даними дослідження на електронному мікроскопі показаний на рис. 1.7.б. Відбір верхньої частини рідини для приготування даної проби проводилося через 15 хв після перемішування в ультразвуковій ванні.
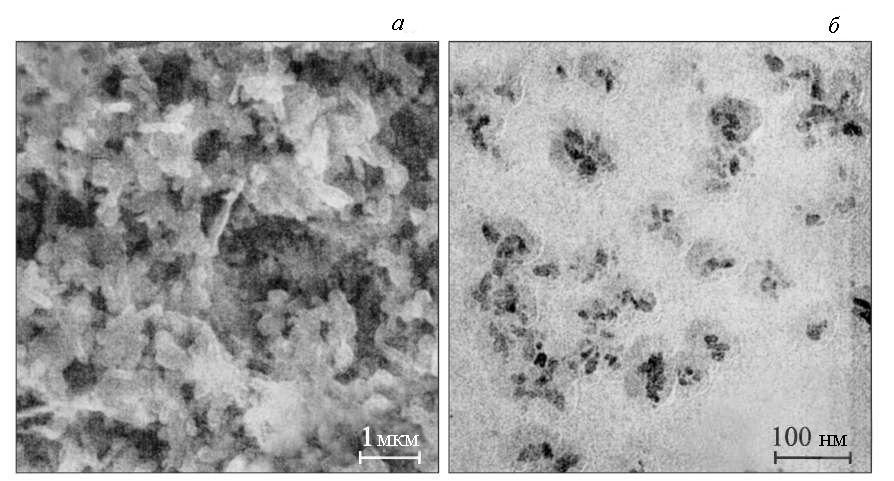
Рис. 1.7. Зображення частинок ZnO, отримане методами скануючої (а) і просвічувальної (б) електронної мікроскопії [12].
Як видно з рис. 1.7.а, при нанесенні на кремнієву підкладку формується плівка, що складається з випадково розподілених, упакованих стовпчикоподібних гранул з довжиною 500-800 нм і середнім діаметром близько 100 нм. З ПЕМ-зображення випливає, що розмір частинок у розчині менший. Зокрема, середній розмір часток, взятих з розчину після 18 годин з моменту перемішування, становив близько 20 нм. Великі розміри кристалів на підкладці, які спостерігалися на знімках, отриманих за допомогою скануючої електронної мікроскопії (рис. 1.7.а), швидше за все, вказують на агломерацію часток при їхньому видаленні з колоїдного розчину.
У міру збільшення часу горіння розряду мінялася прозорість розчину й характеристики плазми. Дослідження показали, що на вольт-амперну характеристику електричного розряду у воді крім міжелектродної відстані впливає ряд факторів, таких, наприклад, як температура рідини й щільність часток розпиленого матеріалу. Як показали результати аналізу порошків, вміст полікристалічного ZnO у них залежить від умов їхнього одержання, зокрема, від механізмів надходження кисню в зону хімічної реакції. Було встановлено, що у випадку додаткового насичення води киснем величина пробійної напруги вища, і відносний вміст ZnO у розчині в порівнянні з металевим цинком, що не прореагував, теж вищий. При кімнатній температурі, в міру збільшення концентрації часток у рідині, величина пробійної напруги, необхідної для підтримки стабільного горіння іскри, збільшувалася. Це обумовлено зменшенням провідності розчину. У випадку використання води збагаченої киснем, для підтримки розряду також необхідна більш висока напруга пробою. При цьому в утвореному розчині доля ZnO, у порівнянні з металевим цинком, більша. По мірі підвищення температури рідини величина пробійної напруги знижувалася, а стабільність горіння розряду збільшувалася. Як правило, забезпечення стабільності розрядних характеристик досягається шляхом зменшення міжелектродної відстані. У роботі випробуваний й інший спосіб підтримки стабільних характеристик розряду, який був заснований на додатковому утворенні газових пухирців у зоні розряду. Утворення пухирців знижувало величину пробійної напруги. Досягти формування пухирців можна було двома способами: впливом на рідину ультразвуком й підвищенням її температури до точки кипіння. Як здавалося, вплив ультразвуку на розчин у процесі розряду, так само як і процес його кипіння, впливали на розряд, але приводили до збільшення відносної долі часток металу в розчині в порівнянні з окисом цинку. При цьому загальний вихід часток на одиницю витраченої енергії збільшувався.
Синтезовані порошки досліджувалися методом рентгенівської дифракції. Типові XRD діаграми наведені на рис. 1.8. Потрібно відзначити, що наночастинки, отримані у всіх досліджуваних режимах розряду, були полікристалічними й містили дифракційні піки для кристалічних площин оксиду цинку гексагональної структури з періодами решітки a = 0.325 нм, c = 0.521 нм і слабкі лінії цинку гексагональної структури з періодами решітки а = 0.2665 нм і c = 0.4947 нм.
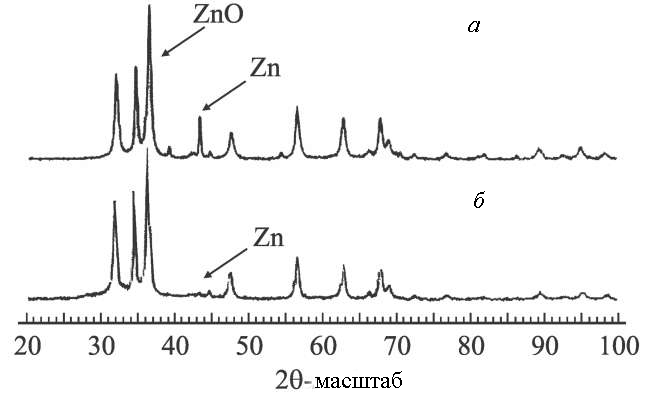
Рис. 1.8. Рентгеноструктурні діаграми наночастинок оксида цинка через 1 (а) та 60 годин (б) після отримання [12].
Як показали результати аналізу, вміст ZnO у пробі залежить від умов його одержання; зокрема, при розряді у воді, насиченої киснем, вміст оксиду збільшується приблизно до 80%. Частина, що залишилася, містить частки металевого цинку, що не прореагували. При цьому середній розмір кристалу оксиду цинку становить близько 20 нм, а металевого цинку — 500 нм. Рентгеноструктурна діаграма для даного зразка наведена на рис. 1.8.а.
З часом при контакті колоїдних розчинів, що містять металевий цинк та його оксид, з навколишньою атмосферою процес окислення продовжується і співвідношення ZnO/Zn в розчині збільшується. Це помітно по зміні колористичних характеристик розчину, а також це випливає з діаграми на рис. 1.8.б, де пік, який відповідає дифракції на кристалічній структурі цинку, стає малим через дві з половиною доби після отримання проби. Як показали експерименти, збагачення колоїдного розчину киснем, а також підвищення його температури тільки прискорюють процес доокислення Zn. Прожарювання проби оксиду цинку в камері, заповненій киснем при атмосферному тиску і температурі 380 ° С призводило до повного доокислення частинок металевого цинку протягом 3 годин.
Для осаджених на кремнієву підкладку зразків реєструвалися спектри люмінесценції при збуренні на довжинах хвиль у діапазоні 240-400 нм. Як виявилося, найбільш інтенсивне свічення наночастинок спостерігалося при впливі випромінювання на довжинах хвиль 270 і 330 нм. Спектри люмінесценції, зареєстровані при кімнатній температурі, для двох зразків, приготовлених в знегаженній воді (а) і у воді, збагаченої киснем (б), наведені на рис. 1.9.
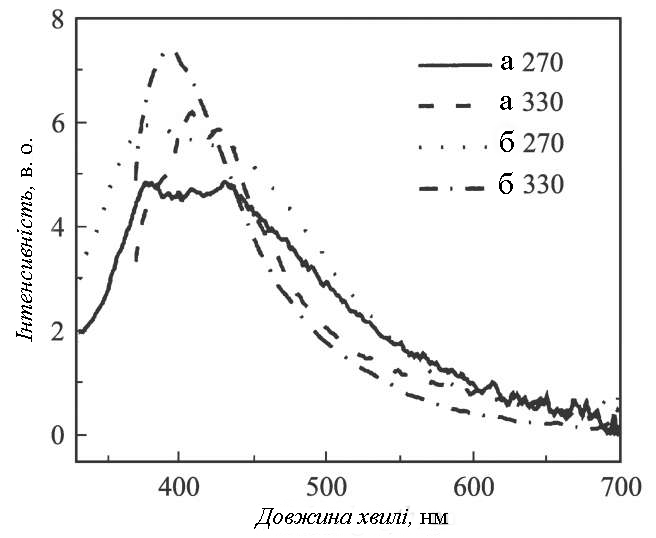
Рис. 1.9. Спектри люмінісценції проби оксиду цинку виготовленного в знегаженеій воді (а) і в воді, яка була насичена киснем (б), при збудженні випромінюванням з довжиною хвилі 270 и 330 нм [12].
З рисунка вуипливає, що наявність розчиненого у воді кисню в процесі приготування оксиду цинку приводить до збільшення інтенсивності і звуженню спектру люмінесценції. При збудженні люмінесценції наночастинок випромінюванням з довжиною хвилі 330 нм спостерігається зсув максимуму інтенсивності в ультрафіолетову область (395 нм порівнянно із двома максимумами на 408 і 430 нм). Максимуми в спектрах люмінесценції при збудженні на λ = 270 нм для двох випадків приготування порошків перебувають приблизно в одній і тій же спектральній області - 338 і 430 - 440 нм. За літературним даними [10,13], при збудженні наноструктур оксиду цинку короткохвильовим випромінюванням спостерігалися смуги люмінесценції в ультрафіолетовій і видимій областях спектру з максимумами поблизу ~ 385 і 450 - 550 нм, відповідно. Смугу люмінесценції в ультрафіолетовій області приписують екситонному випромінюванню, а смугу, розташовану в довгохвильовій області, - рекомбінаційному випромінюванню електронно-діркових пар. Відомо, що поява другої смуги обумовлена наявністю різних точкових дефектів структури оксиду цинку, викликаних внесенням домішок або внутрішніх дефектів кристалічної решітки, а також зовнішніми факторами впливу, у результаті яких формуються рекомбінаційні центри. Відпал порошків в атмосфері приводив до зниження інтенсивності другої смуги і збільшенню максимуму ультрафіолетового піку. У приготовлених методом електричного розряду в рідині наноструктурах ультрафіолетова й видима смуги люмінесценції перекриваються, що може свідчити про наявність дефектів структури, які викликають зсув смуги видимого діапазону в короткохвильову область спектра.
Слід зазначити, що при формуванні нанорозмірних часток методом електричного розряду в рідині поряд з ефективною системою їхнього збору є можливість сепарації часток за розмірами за допомогою відстоювання колоїдних розчинів. Просторовий поділ великих і дрібних часток за часом можна спостерігати навіть візуально — прозорість розчину стає неоднаковою за висотою стовпа рідини. В умовах наших експериментів після закінчення (15 хв після вимикання) розряду всі частки з розмірами, які були більшими за 100 нм опускалися на дно посудини. Як показали результати просвічувальної електронної мікроскопії, при ретельному відборі проби з посудини (що виключає перемішування шарів рідини за висотою) досяжне виділення часток певного розміру, зокрема великих часток цинку.
Відзначимо, що метод одержання оксиду цинку при електричному розряді у воді забезпечує ефективний синтез нанорозмірних структур і дозволяє виділити з колоїдного розчину частки з певними розмірами. Досліджено морфологію і люмінесцентні властивості порошку ZnO, осадженного з колоїдного розчину на поверхню монокристала кремнію. Показано, що в утвореному колоїдному розчині парціальна сполука оксиду й металевого цинку залежить від умов надходження кисню в зону хімічної реакції. Знайдено оптимальні умови для синтезу нанорозмірних сполук із практично стовідсотковим вмістом оксиду цинку.
