
- •Пәннің оқу-әдістемелік кешені
- •Мазмұны
- •1 Глоссарий
- •Мен табиғаты»
- •2. Коллоидты жүйелердің молекулалы-кинетикалық қасиеттері
- •4.Коллоидты ерітінділердің тұрақтылығы
- •Тақырыбы «Коллоидты жүйелердің электрлік қасиеттері» Жоспар
- •2 Микромодуль «Беттік құбылыстар. Дисперсті жүйелердің тұрақтылығы»
- •Және тазалау әдістері»
Мен табиғаты»
Мақсаты: Дисперсті жүйелердің классификациясы және табиғатымен танысу.
Жоспар
Дисперстік жүйелерді олардың құрамындағы дисперстік фаза мен дисперстік ортаның агрегаттық күйлеріне байланысты жіктелуі.
Дисперстік жүйелердің бөлшектерінің өлшеміне қарай жіктелуі.
Коллоидтық ерітінделерде коллоидтық бөлшектер өзара әрекеттесуі бойынша жіктелуі.
Жисперстік жүйелердің термодинамикалық тұрақтылығына қарай жіктелуі.
Тақырыптың қысқаша мазмұны:
Барлық ғылым не өңдіріс салалары сияқты коллоидты химия да өздерінде кездесетін өзіндік ерекшеліктері мен қасиеттерге, өлшемдер мен көрсеткіштерге орай жіктеле келіп, сұрыпталады. Ондағы қайсыбір қасиеттер біріне-бірі ұқсас болғандықтан, олар өзара бірігіп кетеді. Мұны кеңістікте орналасқан денемен де теңестіруге болады, өйткені осы дененің кеңістіктегі нақтылы орнын табу үшін үш өлшемді координатаны не олардың проекциясын пайдалану қажет. Демек, коллоидты жүйені сипаттау үшін оны әртүрлі қасиет, ерекшелік тұрғысынан жіктеу керек. Енді осындай жіктеудің бірнешеуін қарастырайық.
1. Дисперстік фаза және дисперстік ортаның агрегаттық күйіне байланысты жіктелуі. Во. Оствальд ұсынған классификация. Коллоидты химияда қарастырылатын жүйелер гетерогенді, сондықтан кем дегенде екі фазадан тұрады. 3 агрегаттық күйден, 9 типті дисперстік жүйе шығады (1-кесте). Мысалы, С/Г. С – дисперстік фазаның агрегаттық күйі, Г – дисперстік ортаның агрегаттық күйі.
№1– кесте. Үш агрегаттық күйге сәйкес дисперстік жүйенің түрлері
|
Реті |
Диспер фаза |
Диспер орта |
Жүйе белгісі |
Жүйе Түрі |
Мысал |
|
1. |
қатты |
сұйық |
қ/с |
зольдер, |
жүзгін, металл золі |
|
2. |
сұйық |
сұйық |
с/с |
жүзгіндер |
жүзгіндер |
|
3. |
газ |
сұйық |
г/с |
эмульсиялар |
сүт, мұнай, май |
|
4. |
қатты |
қатты |
қ /қ |
көбіктер, |
сабын көбігі |
|
5. |
сұйық |
қатты |
с/қ |
Эмульсия |
минералдар, |
|
6. |
газ |
қатты |
г/қ |
қатты коллоид |
қорытпа |
|
7. |
қатты |
газ |
қ/г |
Ерітіндісі |
топырақ, балшық |
|
8. |
сұйық |
газ |
с/г |
Қуыс дене, гель капилляр, ксерогелдер |
пемза, активті көмір |
|
9. |
газ |
газ |
г/г |
аэрозоль, шаң түтін, тұман, ауа |
атмосфера, ауа |
Зидентопф және Зигмонди бөлшектерді:
микрондар – кәдімгі микроскоптан көрінетін бөлшектер, яғни, өлшемі >0,2 мкм
ультрамикрондар – микроскоптан көрінбейтін коллоидты бөлшектер. Оларды әрі қарай
а) субмикрондар, яғни ультрамикроскоп көмегімен көрінетін өлшемі 5 нм-ден 200 нм-ге дейінгі бөлшектер;
б)амикрондар, яғни ультрамикроскоп көмегімен де көрінбейтін өлшемі <5 нм бөлшектер.
Г/Г типі коллоидтық жүйеге сәйкес келмейді, себебі кәдімгі жағдайларда газдар кез-келген концентрацияда шынайы ерітінділер береді (тек өте жоғары қысымда ғана кейбір газ жүйелері гетерогенді жүйе түзеді).
2. Дисперстік жүйелерді олардың құрамындағы дисперстік фаза бөлшектерінің өлшеміне байланысты жіктеуге болады. Сонда бөлшектерінің өлшеміне қарай барлық дисперстік жүйелерді мынандай топтарға бөлуге болады(2-кесте)
|
Жүйенің типі |
Бөлшектердің өлшемі |
Мысалдар |
|
1 |
2 |
3 |
|
Шын ерітінділер |
а<1
нм (< |
Кышқылдар,тұздар, сілтілер,сулы ерітінділер, қант ерітіндісі |
|
Ультромикрогетерогенді жүйелер(коллоидтық ерітінділер ) |
1 нм <а<100 нм
|
Биологиялық сұйықтар (қан, зәр, сілекей). Метал зольдері |
|
Микрогетерогенді жүйелер (суспензиялар, эмульсиялар, көбіктер) |
|
Күйе, кофе, шоколад, саз балшық, табиғи мұнай, т.б. Маргарин, майонез, парфюмериялық (жақпа майлар), сүт, жұмыртқа |
|
Дөрекі дисперсті жүйелер |
а> |
Жаңбар тамшысы, құм, қиыршық тастар, тары, бидай |
Түрлі типтегі дисперсті жүйелердің классификациясынан кейін, жалпы қасиеттерін былай тұжырымдауға болады(3-кесте)
|
Қасиеттері/жүйе |
Шын ерітінді |
Коллоидты жүйелер |
Дөрекі жүйелер |
|
Фазалар саны |
Гомогенді |
Ультрагетерогенді |
Гетерогенді |
|
Қағазды фильтр |
Бөлшектер өтеді |
Бөлшектер өтеді |
Бөлшектре өтпейді |
|
Жартылай өткізгіш мембрана |
Бөлшектер өтеді |
Бөлшектер өтпейді |
Бөлшектер өтпейді |
|
Кәдімгі микроскоп |
Бөлшектер көрінбейді |
Бөлшектер көрінбейді |
Бөлшектер көрінеді |
|
Ультромикроскоп |
Бөлшектер көрінбейді |
Бөлшектер көрінеді |
Бөлшектер көрінеді |
|
Тұрақтылығы |
Жүйе термодинамикалық тұрақты |
Термодинамикалық тұрғыдан салыстырмалы тұрақты |
Термодинамикалық тұрғыдан тұрақсыз |
|
Уақыт |
Уақыт өте келе ескірмейді |
Уақыт өте келе ескіреді |
Уақыт өткен сайын ескіре береді |
|
Жарық |
Оптикалық бос мөлдір, опалесценцияланбайды |
Мөлдір, түрлі түсті, жарықты шашыратады, опалесценцияланады |
Мөлдір емес, жарықты шығылыстырады |
3. Коллоидтық ерітінділерде коллоидтық бөлшектер өзара әрекеттесуі бойынша жіктеледі.
Дисперстік жүйелерді дисперстік фазаның кинетикалық қасиетіне қарай екі топқа бөлуге болады.
Байланысқан дисперстік жүйелер
Бос дисперстік жүйелер
Байланысқан дисперстік жүйелерде дисперстік фаза бөлшектері молекулааралық күштер әсерінен бір-бірімен байланысып, дисперстік ортада өзінше бір кеңістіктік тор немесе каркас түзеді. Ал құрылым түзетін бөлшектер, әдетте, өзара еркін қозғала алмайды, тек тербелістік қозғалыс жасай алады. Байланысқан дисперстік жүйелерге белгілі дәрежеде қатты денелердің қасиеттері тән болғанымен, оларды дисперсті ортасы қатты болатын жүйелермен шатастыруға болмайды. Дисперсиялық ортасы қатты жүйелер бөлшектері де өзара қозғала алмайды, бірақ оның себебі басқада – ол дисперсиялық ортаның жоғары тұтқырлығы.
М. М. Дубинин байланысқан дисперстік жүйелерді, нақтырақ айтсақ, кеуекті денелерді былай жіктеді;
микрокеуекті, кеуек өлшемі < 2 нм;
ауыспалыкеуекті, кеуек өлшемі 2 - 200 нм аралығында;
макро кеуекті, кеуек өлшемі >200 нм.
Мұндай жүйелерге, көбінесе, диафрагмалар немесе капиллярлы жүйелер деп аталатын капиллярлы – кеуекті денелер; мембраналар – жұқа қабықшалар, әдетте, полимерлі, сұйық және газ өткізгіштер; гельдер және ұйымалар (студни); концентрлі суспензиялар (пасталар) мен эмульсиялар, көбіктер.
Бос дисперстік жүйелерде дисперстік фаза бөлшектері бір-бірімен байланыспаған, сондықтан дисперстік ортада броундық қозғалыс немесе ауырлық күшінің әсерінен өзара тәуелсіз қозғала алады. Бос және байланысқан дисперстік жүйелер өз алдына дисперстілік дәрежесі бойынша жіктеледі. Олардың классификациясы бір-бірінен ерекшеленеді.
Бос дисперстік жүйелерді:
1) ультрамикрогетерогенді, бөлшектер өлшемі 10-7 - 10-5 см (1 - 100 нм аралығында); 2) микрогетерогенді, бөлшектер өлшемі 10-5 - 10-3 см (от 0,1 до 10 мкм) аралығында; 3) ірідисперсті, бөлшектер өлшемі >10-3 см, деп жіктейді.
Зигмонди коллоидтық ерітінділерді жәйлап буландырғанда түзілетін құрғақ қалдықтың таза дисперсиялық ортада еру қабілеті бойынша классификациялауды ұсынды. Осыған байланысты құрғақ қалдығы дисперсиялық ортада өздігінен дисперсиялануға қабілетсіз жүйелерді қайтымсыз дисперстік жүйелер деп атады. Оларға металл лиозольдері, күміс нитраты мен мышьяк сульфидінің гидрозольдері, және т.б. жатады. Қайтымсыз коллоидты жүйелерге коллоидты ерітінділер қасиеті тән: оларды жоғары концентрлі етіп алу қиын (дисперстік фазасының мөлшері жоғары етіп); электролиттер қосқанда олар жеңіл коагуляцияланып, дисперсиялық орта мөлшері аз және ықшам тұнбалар түзеді.
Ал құрғақ қалдығы ортамен жанасқанда алдымен ісініп, содан кейін өздігінен еріп, қайтадан коллоидты ерітінді түзетін жүйелерді қайтымды дисперстік жүйелер деп атады. Оларға желатиннің судағы, каучуктың бензолдағы ерітінділері жатады. Қайтымды коллиодты жүйелерді жоғары концентрлі етіп алу оңай; олар электролиттер әсеріне соншалықты сезімтал емес; тек зольге коагулятордың көп мөлшерін қосқанда ғана тұнбалар түзіледі және олар өте көлемді, тұтқыр, құрамындағы дисперсиялық орта мөлшері көп болыпкеледі.
4. Термодинамикалық тұрақтылығына қарай дисперстік жүйелерді үлкен 2 топқа бөледі: лиофильді және лиофобты жүйелер.
Лиофильді жүйелер (грек. лиос – сұйықтық; phileo – жақсы көремін; phobos –жеккөремін)-термодинамикалық тұрақты жүйелер. Олар өз еркімен түзіледі, түзілу барысында жүйенің еркін(Гиббс) энергиясы азаяды, яғни ∆G=∆+T∆S<0. Мұндай жүйелерге беттік-активті заттардың мицеллярлық ерітніділері, жоғары молекулалық қосылыстардың ерітінділері және бентонит сазбалшықтарының суспензиясы жатады. Оларға агрегаттық тұрақтылық тән.
Лиофобтық жүйелерге термодинамикалық тұрақсыз, ұзақ өмір сүре алмайтын дисперстік жүйелер жатады. Мұндай жүйелерге эмульсиялар, кейбір суспензиялар, көбіктер жатады. Лиофобтық жүйелерді тұрақтандыру үшін оларға тұрақтандырғыш заттар-беттік-активті заттар (БАЗ), полимерлер қосады. Бұл жағдайда коллоидты ертінділердің дисперстік фазаның дисперстік ортамен өзара әрекеттесуі байқалады.
Негізгі түсініктер: байланысқан дисперстік жүйелер, бос дисперсті жүйелер, қайтымсыз дисперстік жүйелер, қайтымды дисперстік жүйелер, лиофильді жүйелер, лиофобты жүйелер.
Өзін-өзі бақылау сұрақтары:
1. Дисперстік жүйелердің классификациясы.
2. Байланысқан жисперсті жүйелер.
3. Бос дисперсті жүйелер.
4. Лиофильдік және лиофобтық жүйелер.
Қолданылған әдебиеттер:
1. Дисперсті жүйелердің құрылым,түзілуі және реологиялық қасиеттері: оқу құралы. - Алматы: Қазақ университеті, 2009. - 68 б.
2. Жанабеков Х.Н. Физикалық және коллоидты химия есептері мен жаттығулар жинағы, 2003. - 74 б
3. Мұсабеков Қ.Б.,Әбдиев Қ.Ж. Коллоидтық химия: Оқулық.-Алматы: 2011.-7-10 б.
№ 3 дәріс Тақырыбы «Коллоидты жүйелердің молекулалы-кинетикалық және реологиялық қасиеттері»
Мақсаты: Коллоидты жүйелердің молекулалы-кинетикалық және реологиялық қасиеттерімен танысу.
Жоспар
1.Қос иондық қабат. Мицелла құрылысы.
2. Коллоидты жүйелердің молекулалы-кинетикалық қасиеттері.
2.1Броундық қозғалыс.
2.2Диффузия.
2.3Осмостық қысым.
2.4Седиментация.
3.Коллоидты жүйелердің реологиялық қасиеттері.
4.Коллоидты ерітінділердің тұрақтылығы.
Тақырыптың қысқаша мазмұны:
Қос электрлік қабаттың пайда болу механизмі
Фазааралық бөлу бетінде қос электрлік қабат (ҚЭҚ) әрекеттесуші фазалардың беттік еркін энергияларын азайтуға ұмтылысының нәтижесінде пайда болады. Жалпы ҚЭҚ үш түрлі жолмен түзілуі мүмкін.
1) Қос электрлік қабат иондардың немесе электрондардың бір фазадан екінші фазаға өтуінің нәтижесінде, яғни беттің иондануы нәтижесінде пайда болады. Мысалы, металл бетінен газды ортаға электрондардың өтуі нәтижесінде пластинка беті оң, ал газ теріс зарядталады. Металл пластинкасын суға батырғанда металл бетінен катиондар суға өтеді де, соның нәтижесінде металл беті теріс, ал су оң зарядталады. Демек жанасушы фазалар арасында потенциалдар айырымы пайда болады. Потенциалдар айырымы электрондардың (иондардың) беттен ары қарай бөлінуін тежейді де, жүйеде тепе-теңдік күй орнайды. Нәтижесінде, фазааралық шекарада қос электрлік қабат пайда болады.
Суда
нашар еритін күміс иодидін
 суға
салғанда жақсы гидратталатын күміс
иондары суға көшеді де,
суға
салғанда жақсы гидратталатын күміс
иондары суға көшеді де,
 беті терісзарядталады,
ал оған жанасушы су қабаты оң зарядталады.
беті терісзарядталады,
ал оған жанасушы су қабаты оң зарядталады.
Бетке заряд беретін иондарды потенциал анықтағыш иондар деп атайды. Дисперстік ортаға көшетін иондарды қарсы иондар деп атайды.
2) Қос
электрлік қабат бетке иондардың
адсорбциялануы нәтижесінде
де пайда болуы ықтимал. Көп жағдайда
ерітіндідегі электролиттің құрамындағы
ион бетке таңдамалы түрде адсорбциялануы
мүмкін. Бұл кезде адсорбция Панет-Фаянс
ережесіне
байланысты
жүреді.
Мысалы,
металл пластинкасын натрий хлориді ( )
ерітіндісіне батырғанда металл бетіне
хлорид аниондары адсорбцияланады да,
соның нәтижесінде бет теріс зарядталадыал
оған жанасушы суда натрий катиондары
қалып қояды да орта
оң зарядталады.
)
ерітіндісіне батырғанда металл бетіне
хлорид аниондары адсорбцияланады да,
соның нәтижесінде бет теріс зарядталадыал
оған жанасушы суда натрий катиондары
қалып қояды да орта
оң зарядталады.
Қос электрлік қабат, сонымен бірге қатты дене бетіне иондық беттік-активті заттардың адсорбциялануы нәтижесінде де пайда болады. Сонда полярлы жағымен суға қарап адсорбцияланган БАЗ молекулалары диссоциацияланады да, нәтижесінде бетте заряд пайда болады. Мысалы, судағы ерітіндісінен карбон қышқылының натрий тұзы молекулалары (R-СОО-Na) гидрофобты қатты дененің (көмірдің) бетіне адсорбцияланғанда дененің беті теріс, ал дисперстік орта оң зарядталады. Сонда БАЗ-тың R-СОО аниондары потенциал анықтағыш иондар болып, ал Na+ катиондары қарсы-иондар болып табылады.
3) Қос электрлік қабат неионогенді, полярлы молекулалардың дисперстік ортадан бетке адсорбциялануы нәтижесінде түзілуі мүмкін. Бұл кезде беттің заряд таңбасы Кен ережесі бойынша анықталады: жанасушы екі фазаның диэлектрлік өткізгіштігі жоғарысы оң зарядталады.
Мысалы, металл пластинканы полиэтиленгликольдің (ПЭГ) [-СH2-СН2-О-]n- судағы ерітіндісіне батырғанда ПЭГ молекулалары пластинка бетіне адсорбцияланып, бетте белгілі бір ретпен орналасуы нәтижесінде фазааралық бөлу бетінде ҚЭҚ пайда болады.
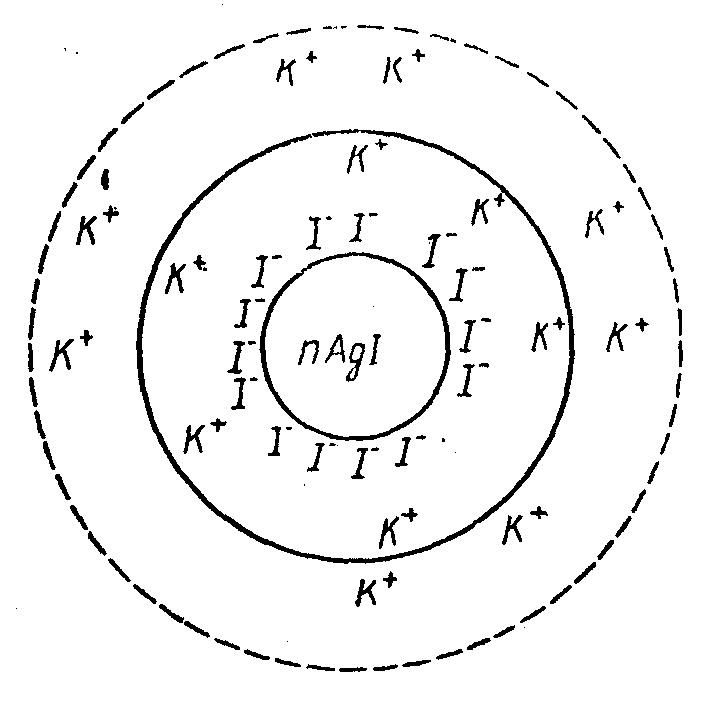
Аргентум иод золі мысалында коллоидты бөлшектің мицелласының құрылысын және екі еселенген электр қабатының пайда болуын қарастырамыз.
AgN +КІ→КN
+КІ→КN +АgІ↓
+АgІ↓
А)[
AgN ]>[КІ]
]>[КІ]
Мицелла
құрылысында ядро болады, ол мицелланың
нейтралды бөлігі. АgІ мицелланың ядросы.
Ядро өз бетінде потенциал анықтаушы n
саны бар иондарды сіңіреді. Панет-Фаянс
ережесіне сәйкес потенциал анықтаушы
ион екі келесі талапқа жауап береді:1)мөлшері
артық болу керек,2)ядро құрамына міндетті
түрде болуы керек. Ядро А иондарын сіңіріп «+» зарядталады. Осы
«+» заряды өзіне ортадан қарама-қарсы
зарядымен қоршаған еріт-н қарама-қарсы
зарядталған иондарды тартады, ол N
иондарын сіңіріп «+» зарядталады. Осы
«+» заряды өзіне ортадан қарама-қарсы
зарядымен қоршаған еріт-н қарама-қарсы
зарядталған иондарды тартады, ол N иондары, себебі барлық
иондары, себебі барлық иондары ядро түзілуіне жойылды. Бірақ,
N
иондары ядро түзілуіне жойылды. Бірақ,
N иондары мол-ң жылу қозғалысы әсерінен
n-х мөлшерде ғана сіңіріледі. х мөлшерде
ғана сіңіріледі. Х мөлшеріне төмен
бірінші адсорбциялық қабатпен
салыстырғанда. Сонымен қатты фаза «+»
зарядталған. Ядро мен адсорбциялық
қабат (N
иондары мол-ң жылу қозғалысы әсерінен
n-х мөлшерде ғана сіңіріледі. х мөлшерде
ғана сіңіріледі. Х мөлшеріне төмен
бірінші адсорбциялық қабатпен
салыстырғанда. Сонымен қатты фаза «+»
зарядталған. Ядро мен адсорбциялық
қабат (N ,
А
,
А )гранула
болып
табылады. Енді артық N
)гранула
болып
табылады. Енді артық N иондары дисперсиялвқ ортада біртексіз
таралады және диффузиялық қабатты
түзеді. Олардың концентрациясы ядродан
шетіне қарай төмендейді. Гранула мен
диффузиялық қабатмицелла
болып табылады. Толық мицелла
электронейтралды (заряды нөл). Мицелярлы
теория леофобты коллоидты бөлшектерге
орындалады.
иондары дисперсиялвқ ортада біртексіз
таралады және диффузиялық қабатты
түзеді. Олардың концентрациясы ядродан
шетіне қарай төмендейді. Гранула мен
диффузиялық қабатмицелла
болып табылады. Толық мицелла
электронейтралды (заряды нөл). Мицелярлы
теория леофобты коллоидты бөлшектерге
орындалады.
{[
АgІ n· А
n· А (n-х)
N
(n-х)
N х N
х N

Ә)
[ AgN ]<[КІ]
]<[КІ]
Ядро
құрамы АgІ. Адсорбциялық қабат
 ионы, екінші адсорбциялық қабат
ионы, екінші адсорбциялық қабат иондары
иондары
{[
АgІ n·
n· (n-х)
(n-х) х
х
«+» зарядталған гранула диффузиялық қабат ортасында екі еселенген электр қабаты потенциалдар айырмасы. Аталмыш электро-кинетикалық потенциал немесе ξ потенциал түзіледі. Ол термодинамикалық потенциалдыңі құрам бөлігі. ξ<ε, оны формула арқылы есептеуге болады:
ξ
=
мұндағы, К-константа( әр түрлі болады, бөлшек пішініне тәуелді, сфера тәрізді болса 6 – ға тең, ал цилиндр 4 болады)
η-ортының тұтқырлығы
D-ортаның диэлектрлі константасы
Е-электр өрісінің градиенті
u-электр тоғы әсерінен болатын бөлшектердің орташа жылдамдығы
Егер гранула заряды болмаса, онда ξ нөлге тең болады. Ондай жағдай изоэлектрикалық жағдай, ξ потенциал келесі жағдайларға тәуелді: екінші адсорбциялық қабат пен диффузиялық қабати арасында қарама-қарсы зарядталған иондардың таралуына неғұрлым адсорбциялық қабатта иондар саны төмен болса, соғұрлым ξ потенциал жоғары болады және термодинамикалық потенциалға жақын болады.

 м)
м) м<
а
м<
а
 м
м м
< а <
м
< а <
 м
м м
м