
- •Міністерство освіти і науки україни
- •Розподіл лабораторних занять з курсу „фізика” на іі семестр навчання
- •Модуль 1. Магнетизм. Коливання та хвилі Лабораторна робота № 1 визначення горизонтальної складової вектора магнітної індукції магнітного поля землі
- •Теоретичні відомості
- •Порядок виконання роботи
- •Результати вимірювань та вихідні дані для розрахунку похибок
- •Питання для самоперевірки
- •Лабораторна робота № 2 вивчення механічного осцилятора з одним ступенем вільності
- •Теоретичні відомості
- •Порядок виконання роботи
- •Результати вимірювань та вихідні дані для розрахунку похибок
- •Результати вимірювань та вихідні дані для розрахунку похибок
- •Питання для самоперевірки
- •Лабораторна робота № 3 вивчення електричного осцилятора з одним ступенем вільності
- •Теоретичні відомості
- •Опис установки
- •Послідовність виконання роботи
- •Питання для самоперевірки
- •Лабораторна робота № 4 визначення швидкості звуку фазовим методом
- •Теоретичні відомості
- •Порядок виконання роботи
- •Питання для самоперевірки
- •Модуль 2. Оптика Лабораторна робота № 5 визначення радіуса кривини лінзи та довжини світлової хвилі за допомогою кілець ньютона
- •Теоретичні відомості
- •Опис приладу
- •Порядок виконання роботи
- •Визначення довжини хвилі
- •Питання для самоперевірки
- •Лабораторна робота № 6 визначення довжини хвилі жовтої лінії спектра неону за допомогою дифракційної гратки
- •Теоретичні відомості
- •Порядок виконання роботи
- •Питання для самоперевірки
- •Лабораторна робота № 7 визначення концентрації цукру в розчині за допомогою поляриметра
- •Теоретичні відомості
- •Порядок виконання роботи
- •Питання для самоперевірки
- •Лабораторна робота № 8 вимірювання кута розбіжності і ступеня поляризації випромінювання He-Ne лазера
- •Теоретичні відомості
- •1. Вимір розбіжності газового пучка
- •Порядок виконання роботи
- •2. Вимірювання ступеня поляризації лазерного випромінювання
- •Порядок виконання роботи
- •Питання для самоперевірки
- •Модуль 3. Атомна фізика Лабораторна робота № 9 вивчення законів теплового випромінювання речовин та вимірювання температури нагрітих тіл за допомогою оптичного пірометра
- •Теоретичні відомості
- •Опис приладу
- •Питання для самоперевірки
- •Лабораторна робота № 10 вивчення зовнішнього фотоефекту
- •Теоретичні відомості
- •Порядок виконання роботи
- •Питання для самоперевірки
- •Лабораторна робота № 11 вивчення спектрів випромінювання і поглинання різних речовин
- •Теоретичні відомості
- •Опис спектральних приладів
- •Порядок виконання роботи.
- •Питання для самоперевірки
- •Список рекомендованої літератури Основна література
- •Додаткова література
- •Додатки
- •Основні одиниці sі
- •Похідні одиниці sі, що мають спеціальні назви
- •Коефіцієнти Стьюдента
- •Характеристики мір
- •Характеристики приладів
- •Властивості натуральних логарифмів
- •Грецький алфавіт
Питання для самоперевірки
Що називають зовнішнім фотоефектом і чим він відрізняється від внутрішнього ?
Як залежить максимальна швидкість фотоелектронів від інтенсивності монохроматичного світла, що освітлює фотокатод ?
Як змінюється гальмівна напруга, якщо фотоелемент замість жовтого світла освітлювати синім ?
Як залежить гальмівна напруга від інтенсивності монохроматичного світла, що падає на фотоелемент ?
За сталої інтенсивності довжину хвилі монохроматичного світла, що падає на фотоелемент, зменшили вдвічі. Як це позначиться на значенні:
а) максимальної швидкості фотоелектронів;
б) струму насичення ?
За сталої інтенсивності довжину хвилі монохроматичного світла, що падає на фотоелемент, збільшили вдвічі. Як це позначиться на значенні:
а) гальмівної напруги;
б) роботи виходу ?
Записати рівняння Ейнштейна та дати визначення «червоній межі фотоефекту».
Що називають роботою виходу і як вона залежить від довжини хвилі монохроматичного світла, що падає на фотоелемент ?
Що називають струмом насичення, як його величина залежить від інтенсивності монохроматичного світла, що падає на фотоелемент ?
Побудуйте і поясніть графік залежності фотоструму від напруги для двох різних за інтенсивністю монохроматичних потоків світла.
Лабораторна робота № 11 вивчення спектрів випромінювання і поглинання різних речовин
Мета роботи: ознайомитись з принципом дії спектральних приладів і навчитися працювати на простому спектрометрі; ознайомитися з лінійчатими, смугастими і неперервними спектрами і умовами їх отримання; вивчити спектри випромінювання і спектри поглинання деяких речовин.
Прилади та обладнання: монохроматор УМ-2, конденсорні лінзи, блок живлення, лампа розжарювання, неонова лампа, пробірки з розчином марганцево-кислого калію, порошок NaCl.
Теоретичні відомості
Видиме світло - це короткі електромагнітні хвилі, довжина яких знаходиться в інтервалі (0.46-0.76)10-6м. Поглинання і випромінювання світла відбувається внаслідок енергетичних переходів в атомах та молекулах і має квантовий характер.
Згідно з квантовою теорією внутрішня енергія атома і молекули не може мати довільного значення, а характеризується цілим рядом певних енергетичних рівнів. Випромінювання енергії пов’язане з переходом електронів з більш високого на більш низький рівень, поглинання енергії – з більш низького на вищий енергетичний рівень.
Величина
енергії кванта
![]() ,
яка випромінюється (або поглинається)
електромагнітною хвилею, визначається
різницею відповідних енергетичних
рівнів системиhν=E2
– E1
. Щоб атоми ( або молекули) випромінювали,
їх потрібно своєчасно якою-небудь
зовнішньою енергетичною дією (нагріванням,
дією електричних полів і т.п.) примусити
перейти з нормального (самого низького
енергетичного рівня ) на більш високий
енергетичний рівень.
,
яка випромінюється (або поглинається)
електромагнітною хвилею, визначається
різницею відповідних енергетичних
рівнів системиhν=E2
– E1
. Щоб атоми ( або молекули) випромінювали,
їх потрібно своєчасно якою-небудь
зовнішньою енергетичною дією (нагріванням,
дією електричних полів і т.п.) примусити
перейти з нормального (самого низького
енергетичного рівня ) на більш високий
енергетичний рівень.
У збудженому стані атом існує надзвичайно короткий час (10-8с) і при переході в нормальний стан він випромінює квант світла (фотон) певної частоти.
Набір частот (або довжин хвиль), який випромінюється даним тілом, називається спектром випромінювання. У вакуумі світло, незалежно від довжини хвилі, розповсюджується з постійною швидкістю с=3108м/с. Але в будь-якому прозорому середовищі з показником заломлення n швидкість V світла зменшується: V=с/n.
Так як n-функція довжини хвилі світла, причому для прозорого середовища із збільшенням довжини хвилі n монотонно спадає, то активніше швидкість світла зменшується для фіолетових променів, а менш активно - для червоних. Внаслідок цього швидше будуть заломлюватись середовищем фіолетові промені і менш активно – червоні. Так виникає спектр випромінювання (чи поглинання).
Вид спектра залежіть від природи джерела. Розжарені тверді і рідкі тіла, а також гази при великому тиску випромінюють світло, при розкладанні якого отримується неперервний спектр: в ньому спектральні кольори неперервне переходять з одного в інші. Ізольовані атоми нагрітих розжарених газів чи парів випромінюють світло, розкладання якого дає лінійчатий спектр, який складається з окремих кольорових ліній. Кожний хімічний елемент має характерний для нього лінійчатий спектр.
Лінії в спектрах розміщені за певними закономірностями: в спектрах спостерігається виникнення окремих ліній, характерних для даного елемента, які розміщуються в спектрі в певній послідовності – це так звані спектральні серії. Лінії серії поступово зближуються при переході до більш коротких довжин хвиль.
Якщо біле світло від джерела, що дає неперервний спектр, проходить через пар досліджуваної речовини і після чого за допомогою спектрометра розкладається в спектр, то на фоні неперервного спектра спостерігаються темні лінії поглинання в тих же самих місцях, де були б розташовані лінії спектра випромінювання парів досліджуваного елемента. Такі спектри називаються спектрами поглинання. Вони характерні для спектрів молекул.
Молекулярні спектри складаються з великої кількості окремих ліній, які створюють так звані смуги. Смуги збираються в групи. Спектр молекул – смугастий спектр.
Утворення
смугастих спектрів пояснюється таким
чином. Повна енергія молекули може бути
наведена у вигляді: Е=Еe+Еv+Еr,
де Еe-
енергія руху електронів у атомах молекули
(електронна енергія),
![]() -
енергія коливального руху ядер атомів,
що створюють молекулу, біля їх
врівноваженого положення (коливальна
енергія),
-
енергія коливального руху ядер атомів,
що створюють молекулу, біля їх
врівноваженого положення (коливальна
енергія),![]() -
енергія обертального руху молекули як
цілого (обертальна енергія).
-
енергія обертального руху молекули як
цілого (обертальна енергія).
Практика
і теорія показують, що відстань між
обертальними рівнями
![]() значно менша за відстань між коливальними
рівнями
значно менша за відстань між коливальними
рівнями
![]() Еr,
які в свою чергу значно менші, ніж
відстань між електронними рівняннями.
Схема енергетичних рівнів двохатомної
молекули виглядає так, як показано на
рис. 1 (приведені тільки два електронні
рівні). Вся сукупність рівнів показана
у правому стовпцю. Перші два стовпця
лише пояснюють виникнення енергетичних
рівнів.
Еr,
які в свою чергу значно менші, ніж
відстань між електронними рівняннями.
Схема енергетичних рівнів двохатомної
молекули виглядає так, як показано на
рис. 1 (приведені тільки два електронні
рівні). Вся сукупність рівнів показана
у правому стовпцю. Перші два стовпця
лише пояснюють виникнення енергетичних
рівнів.
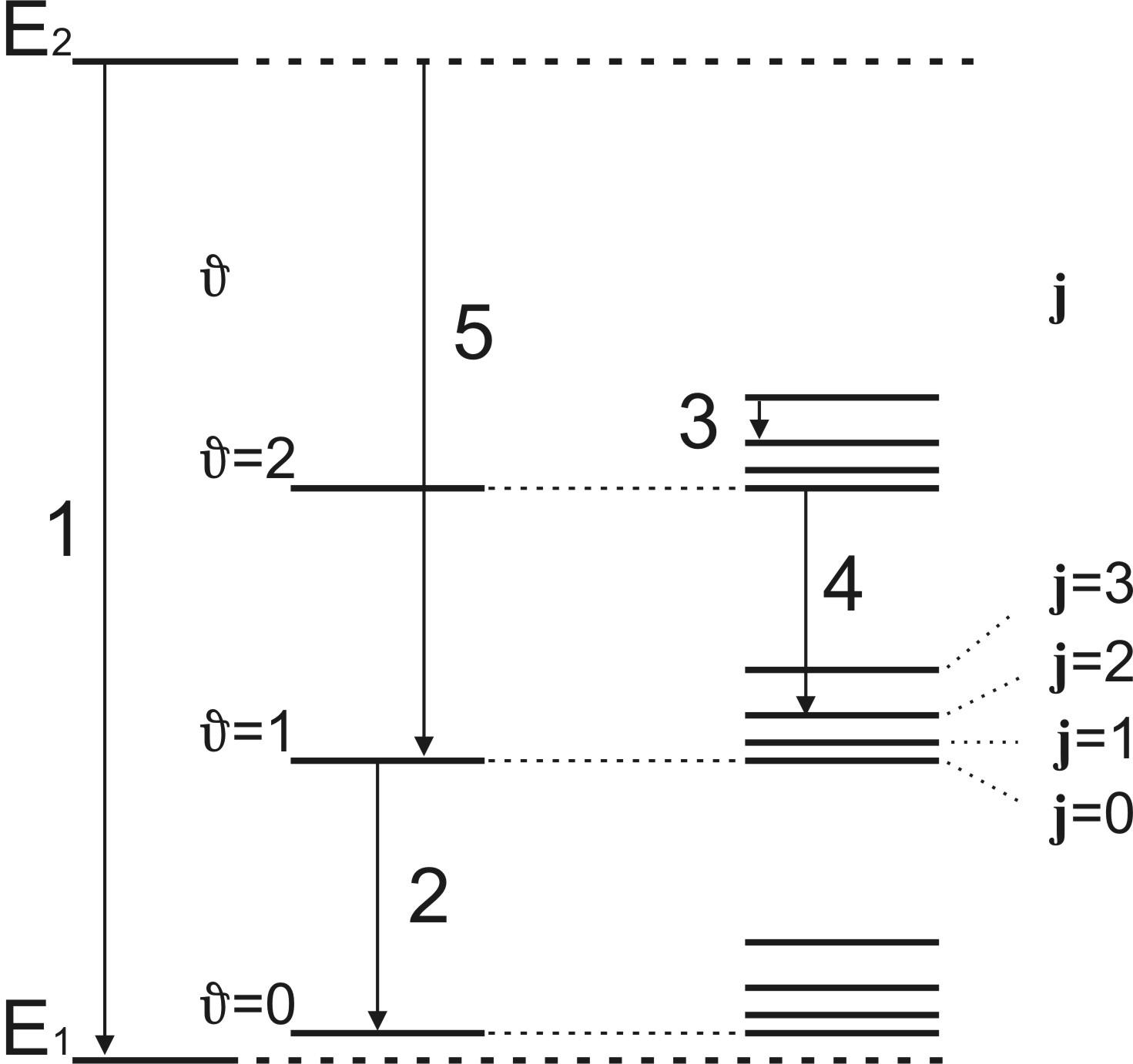
Рис. 1. Схема енергетичних рівнів молекули:
1
– чисто електронний перехід; 2 –
коливальний перехід; 3 – обертальний
перехід; 4 – коливально–обертальний
перехід; 5 – електронно – коливальний
перехід;
![]() - коливальне квантове число;j
- обертальне квантове число.
- коливальне квантове число;j
- обертальне квантове число.
Поглинання
і випромінювання пов'язане зі зміною
енергії обертання молекули, знаходиться
в далекій інфрачервоній області
спектра(![]() Е=h
Е=h![]()
- мало). Коливальний спектр молекул
розміщений в більш близькій інфра -
червоній області.
- мало). Коливальний спектр молекул
розміщений в більш близькій інфра -
червоній області.
У видимій та ультрафіолетовій області спектра енергії квантів достатньо для переходів молекули між різними електронними енергетичними рівнями. Кожному такому рівню відповідає певне просторове розміщення електронів, що належать атомам, які входять до складу молекули (електронна конфігурація).
Зміна електронної конфігурації зазвичай супроводжується і коливаннями ядер в молекулі – виникає електронно–коливальний спектр молекули з частотою, що характеризується ел-кол окремих ліній(рис. 1). Оскільки зміна коливального енергетичного стану супроводжується також і обертанням молекули, то кожному електронно – коливальному переходу в спектрі відповідає не окрема лінія, а смуга.
В нагрітому твердому тілі відбуваються інтенсивні коливання решітки і в спектрі розжарених твердих тіл окремі лінії зливаються – спектр стає неперервним.
Характер спектрів поглинання також визначається природою і будовою поглинаючої речовини, внаслідок цього дослідження спектрів поглинання на рівні зі спектрами випромінювання є надійним методом у вивченні будови і складу речовини.
