
n1
.pdfЗ аномальних типів гемоглобіну часто зустрічається серпоподіб- но-клітинний гемоглобін, що виявлений у хворих на серпоподібно- клітинну анемію.
Хімічний дефект при захворюванні на серпоподібно-клітинну анемію був розкритий В.Генгремом. Він полягає в заміні однієї єди- ної амінокислоти, а саме глутамінової, у 6 положенні з N-кінця, на валін у β-ланцюгах молекули гемоглобіну. Це результат мутації в молекулі ДНК, яка кодує синтез β-ланцюга гемоглобіну.
Інша важлива група порушень, пов'язаних з аномаліями гемо- глобіну – таласемії. Для них характерна знижена швидкість синтезу α-ланцюгів гемоглобіну (α-таласемії) або β-ланцюгів (β-таласемії). Це призводить до анемії, яка може набувати дуже важкої форми.
Ще один представник гемпротеїнів – міоглобін. Він має третин- ну структуру і складається з одного поліпептидного ланцюга, який містить 153 амінокислотні залишки, і однієї молекули гему. Молеку- лярна маса міоглобіну 17000.
Унаслідок аналізу просторового розподілу амінокислот чітко виявляється одна особливість: на поверхні молекули знаходяться полярні залишки, а всередині структури – неполярні.
Міоглобін міститься в м'язах і бере участь у процесі запасання кисню. Для міоглобіну ізотерма адсорбції кисню має форму гіпербо- ли. Кількість кисню, який зв'язується з міоглобіном («відсоток наси- чення»), залежить від концентрації кисню в середовищі, яке безпосе- редньо оточує молекулу білка (цю концентрацію виражають як РО2 –
парціальний тиск кисню).
В умовах кисневого голодування (наприклад, у разі великого фі- зичного навантаження) кисень звільняється з комплексу з міоглобі- ном і надходить до мітохондрій м'язових клітин, де здійснюється си- нтез АТФ (окислювальне фосфорилювання).
Цитохроми (ферменти) також належать до гемпротеїнів, оскільки як простетичну групу містять гем. Цитохроми поділяють на декілька типів: а, b, с, d. Відрізняються вони один від одного не тіль- ки за природою гему, а й за білковою частиною і способом приєд- нання гему до білка. Частина цитохромів міститься всередині мем- брани у складі інтегральних білків, а інші – на поверхні внутрішньої та зовнішньої мембрани мітохондрій.
Так, цитохром а містить гем А, який називається ще формілпор- фірином. Цитохром b містить гем В, у структурі якого немає формі- льної групи. Цитохром с містить простетичну групу гем С, що міцно з'єднана з білком через залишки цистеїну. Цитохром d, котрий міс- тить дегідропорфірин, містить ще й гем С. Цитохроми в дихальному ланцюзі є переносниками електронів від флавопротеїнів до цито- хромоксидази. Атом заліза в них переходить зі стану Fe2+ у Fe3+ і
61
зворотно в процесі окислення і відновлення. Цитохромоксидаза міс- тить два атоми міді й дві молекули гему типу А.
Цей фермент каталізує реакцію, внаслідок якої електрони, що звільняються з молекул субстрату під час їх окислення дегідрогена- зами, переносяться на кінцевий акцептор – кисень.
Каталаза і пероксидаза – ферменти класу оксидоредуктаз, які за хімічною природою є гемпротеїнами. Вони беруть участь у розкла- данні перекису водню і, таким чином, захищають організм від шкід- ливого впливу цієї сполуки.
Глікопротеїни
Глікопротеїни – це складні білки, до складу яких входить вугле- водний компонент. Білок у цих сполуках є своєрідною основою, до якої дуже міцно приєднуються вуглеводні (гліканові) ланцюги. Від- повідно до особливостей хімічної будови глікопротеїни можуть бути розподілені на істинні глікопротеїни і протеоглікани (глікозаміноп- ротеоглікани). Основна різниця між ними полягає в тому, що вугле- водні угрупування істинних глікопротеїнів мають, як правило, 15–20 моносахаридних компонентів, які не утворюють повторюваних олі- госахаридних фрагментів, на той час, як у протеогліканів ці угрупу- вання побудовані з дуже великої кількості одиниць, що повторюють- ся і в основному мають своєрідний дисахаридний характер. Найчас- тіше такий дисахарид містить глюкозамін або галактозамін у суль- фатованому чи несульфатованому вигляді й уронову кислоту (глю- куронову чи ідуронову).
Глікозамінопротеоглікани або глікозаміноглікани раніше нази- вали мукополісахаридами. Комплекс одного і більше глікозаміноглі- канів із білком називається протеогліканом.
Істинні глікопротеїни. Молекулярна маса істинних глікопро- теїнів коливається в широких межах, досягаючи інколи 1 млн та бі- льше. На частку вуглеводного компонента в глікопротеїнах припа- дає від 1–3% (овальбумін) до 80–90% (групові речовини крові) маси всієї молекули. У значних межах коливається і кількість вуглевод- них ланцюгів, які припадають на одну молекулу. Так, у трансфери- ні, рибонуклеазі їхня кількість не перевищує 1–4, а у групових речо- винах крові, муцинах слини досягає 300–800. Вуглеводні ланцюги, розгалужені або лінійні, завжди ковалентно зв'язані з білковою час- тиною молекули.
Олігосахаридні ланцюги в глікопротеїнах можуть виконувати такі функції: модулюють фізико-хімічні властивості, такі, як роз- чинність, в'язкість, заряд і денатурація; обумовлюють захист від протеолізу всередині клітини і в міжклітинному просторі; беруть участь у прояві біологічної активності, наприклад, хоріонічного го- надотропіну; впливають на проникнення до мембран, внутрішньо-
62
клітинну міграцію, розподіл і секрецію; впливають на ембріональ- ний розвиток і диференціювання клітин; можуть впливати на вибір місця метастазування ракових клітин.
Хоча в природі знайдено близько 200 моносахаридів, у складі олігосахаридних ланцюгів глікопротеїнів їх міститься менше, ніж 12. До них належать D-галактоза, D-маноза, D-глюкоза, N-ацетилглю- козамін, N-ацетилгалактозамін, дезоксисахари (L-фукоза, L-рамно- за), D-ксилоза, L-арабіноза. Типовим компонентом глікопротеїнів є також N-ацетилнейрамінова кислота, яка найчастіше з’єднується з претермінальним залишком галактози або N-ацетилгалактозаміну. Нейрамінова кислота частіше зустрічається у формі сіалових кислот.
Між сахарами може утворюватися велика кількість глікозид- них зв'язків. Наприклад, три різні гексози можуть з'єднуватися одна з одною з утворенням понад 1000 різних трисахаридів. Кон- формація сахарів в олігосахаридних ланцюгах коливається в зале- жності від їх зв'язку і близькості інших молекул, з якими олігоса- хариди можуть взаємодіяти.
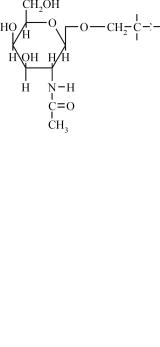
Ковалентний зв'язок між вуглеводною і білковою частинами глікопротеїнів можуть утворювати різні угрупування. Дуже розпо- всюдженим є глікозиламідний тип зв'язку між N-ацетилглюкозамі- ном і γ-амідним азотом аспарагіну (N-глікозидний зв'язок):
N-зв'язані глікопротеїни вивчені досить добре завдяки легкості їх виділення, – вони містятьсяяк у мембранах клітин, такі в плазмікрові.
Інший тип вуглеводпептидного зв'язку в глікопротеїнах – О-глі-
козидний.
63
В утворенні цього зв'язку найчастіше беруть участь ОН-групи залишків серину або треоніну і N-ацетилгалактозамін або галактоза.
Більшість глікопротеїнів з таким зв'язком присутні в муцинах, але О-глікозидні зв'язки виявляються також у деяких мембранних і циркулюючих у крові глікопротеїнах.
У колагені зустрічається галактозил-гідроксилізиновий О-гліко- зидний зв'язок, а у вуглеводовмісних білках вищих рослин – арабіно- зин-гідроксипроліновий. У глікопротеїнах сечі людини виявлено та- кож S-глікозидний зв'язок галактози з цистеїном і О-глікозидний зв'язок фукози з треоніном. Деякі глікопротеїни містять як N-, так і О-глікозидні зв'язки.
Розповсюдження і функції глікопротеїнів. Глікопротеїни наявні в більшості організмів – від бактерій до людини. Багато вірусів та- кож містять глікопротеїни. Особливо багато їх у крові, на клітинній мембрані та всередині клітин.
Глікопротеїни – це численна група складних білків із різнома- нітними функціями, головними з яких є:
1)функція вибіркової взаємодії, високоспецифічного впізнаван- ня, наприклад: клітина-клітина; вірус-клітина; бактерія-клітина; го- рмональні рецептори. До складу поверхневих мембран поряд з ін- шими компонентами входять глікопротеїни, які беруть участь у дуже тонких процесах біологічного впізнавання і міжклітинної взаємодії, виконуюючи роль рецепторних систем для певних сполук і клітин. Такого типу рецептор для інсуліну існує на поверхні клітин печінки, жирової тканини і лімфоцитів. Гормони з попередньо відщепленими кінцевими сіаловими кислотами під час введення до кровотоку не досягають клітин-мішеней. Епітеліальні клітини слизової оболонки кишечника містять рецептори, які специфічно зв'язують клітини ін- фікуючих організм бактерій та вірусів.
Безперечно важливою є також роль вуглеводного компонента глікопротеїнів у визначенні специфічності багатьох антигенів. Це стосується, перш за все, групових речовин крові і розчинних речовин біологічних рідин (слина, молоко, сім’яна рідина). Антигенність цих глікопротеїнів визначається будовою олігосахаридних ланцюгів. За- міна однієї моносахаридної ланки молекули суттєво впливає на спе- цифічність усього глікопротеїну, що визначає групу крові.
2)Транспортна функція. Чимало глікопротеїнів, які циркулю- ють у кров'яному руслі людини і тварин, є транспортними білками. Вони здійснюють транспорт гідрофобних речовин та іонів металів. Наприклад, функцію переносника заліза виконує трансферин, міді – церулоплазмін, стероїдних гормонів – транскортин і т.ін. Головний інтегральний білок еритроцитарної мембрани бере участь у транс- порті аніонів і, можливо, глюкози.
64
3)Каталітична функція. Вуглеводний компонент було знайдено
ускладі деяких ферментів, наприклад, ентерокінази, пероксидази, глікозидази, гідролази, холінестерази сироватки (яка розщеплює ацетилхолін і бере участь у передачі нервового збудження), РНКази В та ін.
4)Структурно-механічна функція. Цю функцію виконують у рі- зних видів живих організмів в основному протеоглікани. У хребет- них тварин вони входять до складу міжклітинної речовини сполуч- ної тканини, містяться в шкірі, хрящах, синовіальній рідині суглоб- них сумок, сухожиллях, клапанах серця, склоподібному тілі, рогівці ока та інших тканинах. Протеоглікани надають їм еластичності і стійкості відносно стискання. Функцію захисного мастила викону- ють глікопротеїни – основні складові речовини муцинів слини, шлункового і кишкового муцинів. Глікопротеїни – це широко роз- повсюджені структурні компоненти різних клітинних мембран.
5)гідроосмотична й іонрегулююча функція. Так, іонообмінна активність глікозаміногліканів як поліаніонів зумовлює активну роль в основному протеогліканів у розподілі ряду катіонів у сполу- чній тканині. Наприклад, накопичення кальцію в осередках осифі- кації пов'язане з одночасним накопиченням хондроїтин-сульфатів, що активно фіксують катіони кальцію. Такі функції протеогліканів, як функція зв'язування екстрацелюлярної води і регуляція процесів дифузії, також значною мірою залежать від їх властивостей.
Окрім перелічених, глікопротеїни виконують в організмі і низ- ку інших функцій. Наприклад, до глікопротеїнів належать фібрино- ген, протромбін та деякі інші фактори згортання крові. Глікопро- теїнами є імуноглобуліни, деякі гормони – гонадотропні, тиреот- ропін, кортикотропін, тиреоглобулін, інгібітор розмноження віру- сів – інтерферон.
У сироватці крові і м'язах антарктичних риб знайдено глікоп- ротеїни – антифризи, які захищають клітини від замерзання.
У мікроорганізмів, що живуть у водоймах гарячих джерел, клі- тинна мембрана містить глікопротеїни. У капсулах спороносних бактерій, стійких до зовнішньої хімічної і термічної дії, також є глі- копротеїни і гліколіпопротеїни.
До глікопротеїнів належить білок яєць авідин. Він взаємодіє з вітаміном Н (біотин), заважає його всмоктуванню із кишечника. Авідин використовується в дослідах in vitro як інгібітор біотинвмі- сних ферментів.
Вуглеводний компонент, навіть невеликий за масою, надає но- вих властивостей молекулі білка глікопротеїнів. Для них характер- ною є термостабільність, що відрізняє їх від протеїнів. Глікопро- теїни витримують високі і низькі температури, не змінюючи фізи-
65
ко-хімічних властивостей. На відміну від інших білків глікопротеїни важко перетравлюються протеолітичними ферментами шлунково- кишкового тракту (пепсином, трипсином та ін.). Вуглеводна части- на надає складному білку більшу специфічність. Це своєрідні век- торні групи протеїнів, які «впізнають» ділянки інших структур (ма- кромолекул, поверхні клітин). Глікопротеїни швидше виводяться із клітини і знаходяться, як правило, поза клітиною (у біологічних рі- динах, на зовнішній поверхні клітин).
Протеоглікани. Протеоглікани – це молекули, які складаються із невеликої білкової частини, до якої ковалентно приєднується значна кількість олігосахаридних (гетерополісахаридних) ланцюгів, які містять у своїх молекулах аміносахари й уронові кислоти. Моле- кулярна маса протеогліканів велика і досягає іноді декількох міль- йонів завдяки великій кількості дисахаридних ланок, що чергують- ся. Вони утворюють основну субстанцію міжклітинного матриксу сполучної тканини. На долю протеогліканів припадає до 30% сухої маси сполучної тканини.
Сполучатися з білковою частиною полісахариди можуть за до- помогою таких зв'язків: 1) О-глікозидний, утворений D-ксилозою і залишком амінокислоти серину; 2) О-глікозидний, утворений N-ацетилгалактозаміном і залишками амінокислот серину або тре- оніну; 3) N-глікозидний, утворений між N-ацетилгалактозаміном та амідним азотом аспарагіну. Ксилоза не входить до складу гліко- заміногліканів, а виконує роль вставного, сполучного компонента між полісахаридами і білками.
Вуглеводні компоненти протеогліканів називають глікозамі- ногліканами, і представлені вони такими полісахаридами: гіалуро- новою кислотою, хондроітинсульфатами, кератансульфатами I і ІІ, гепарином, гепарансульфатом і дерматансульфатом.
Усі глікозаміноглікани мають поліаніонні властивості, бо в них присутні карбоксильні групи уронових кислот і сульфатні групи аміно- сахарів. Розчини цих вуглеводовмісних білків мають високу в'язкість.
Глікозаміноглікани можуть взаємодіяти з позаклітинними мак- ромолекулами, білками плазми і компонентами клітинної поверхні.
Гіалуронова кислота. Уперше була знайдена в скловидному тілі ока. Із усіх глікозаміногліканів гіалуронова кислота має найбільшу молеку- лярну масу (105–107 Да). Частка зв'язаного з гіалуроновою кислотою бі- лка в молекулі протеоглікану становить не більше 1–2% від загальної маси. За хімічною природою гіалуронова кислота– це нерозгалужений ланцюг із повторюваних дисахаридних компонентів, які містять N- ацетил-β-D-глюкозамін та β-D-глюкуронову кислоту, які сполучаються між собою β (1→3)-глікозидним зв'язком (див. представлений фраг- ментмолекули гіалуронової кислоти):
66
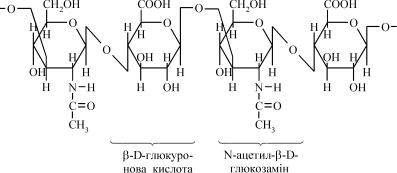
Дисахаридні одиниці сполучаються між собою β (1→4)-глікозид- ним зв'язком.
Міститься гіалуронова кислота в різних видах сполучної тка- нини. Найбільше її у пупковому канатику, склоподібному тілі ока, синовіальній (суглобній) рідині й шкірі. У тканинах і рідинах гіа- луронова кислота утворює комплекс з білками. Вона служить біо- логічним цементом, заповнюючи простір між клітинами. Вважа- ють, що головною функцією гіалуронової кислоти в сполучній тканині є зв'язування води. Унаслідок такого сполучення міжклі- тинна речовина має характер желеподібного матриксу, здатного «підтримувати» клітини. Важливу роль відіграє гіалуронова кис- лота в регуляції проникності тканин. Сітка гіалуронової кислоти у вигляді гелю є своєрідним фільтром, який затримує мікробні та інші великі молекули, що потрапляють до організму. Розрив глі- козидних зв'язків у ланцюгах гіалуронової кислоти викликає її де- полімеризацію. Внаслідок цього фільтруюча система порушуєть- ся, поміж клітинами потрапляють різні молекули, у тому числі й великі, накопичується міжклітинна вода, яка утримується незруй- нованим полімером (розвивається набряк). У клітинах організму є спеціальний фермент – гіалуронідаза, яка, виділяючись у між- клітинний простір, може підвищувати міжклітинну проникність. Тому гіалуронідазу називають фактором проникності.
Деякі бактерії містять фермент типу гіалуронідази, що дає їм можливість проникати з кров’яного русла в міжклітинний простір.
Хондроітинсульфати. Це протеоглікани, які є найважливішим компонентом хряща. Розрізняють хондроітин-4-сульфат і хондроітин- 6-сульфат. Відрізняються вони розташуванням сульфатної групи. Ди- сахаридний компонент у хондроітинсульфатів дуже схожий на такий же в гіалуроновій кислоті, за тим винятком, що гексозамін представ- лений N-ацетилгалактозаміном. N-ацетилгалактозамін хондроітинсу- льфатів містить сульфатний замінник у положенні 4 або 6.
67
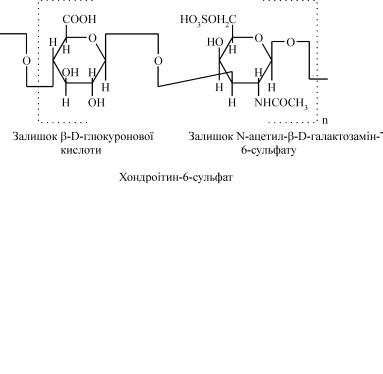
Як правило, і перший, і другий замісники знаходяться в одній і тій же молекулі, але в різних моносахаридних залишках. На дисаха- ридну одиницю припадає в середньому один сульфатний замісник. Кожний полісахаридний ланцюг містить приблизно 40 дисахаридних компонентів, що повторюються, і має молекулярну масу близько 20000. Унаслідок зв'язування більшості таких ланцюгів з однією біл- ковою молекулою утворюються високомолекулярні протеоглікани.
Незважаючи на мінімальну розбіжність в хімічній структурі, фі- зико-хімічні властивості хондроітин-4-сульфату і хондроітин-6-суль- фату суттєво відрізняються. Вони також розрізняються і розподілом серед різних видів сполучної тканини (табл.3).
Хондроітинсульфати можуть міцно зв'язуватися з гіалуроновою кислотою за допомогою двох з’єднуючих білків, утворюючи в сполу- чній тканині дуже великі агрегати. Ці агрегати можна спостерігати в електронний мікроскоп.
Кератансульфати. Уперше були виділені із рогівки ока бика, звідки й назва цього глікозаміноглікана. На відміну від усіх інших глікозаміногліканів кератансульфати не містять ні D-глюкуронову кислоту, ні L-ідуронову кислоту. Кератансульфати складаються із повторюваних дисахаридних компонентів N-ацетилгaлактозаміну і
68
N-ацетилглюкозаміну і містять сульфати в 6-му положенні залишків N-ацетилглюкозаміну, а іноді – галактози.
Встановлено, що полісахарид у кератансульфаті, виділеному із рогівки ока (кератансульфат І), приєднується до поліпептидного ла- нцюга N-глікозидним зв'язком, утвореним N-ацетилглюкозаміном та амідним азотом аспарагіну.
Таблиця 3
Переважна локалізація різних глікозаміногліканів у тканинах
|
Гіалуро- |
Хондро- |
Хондро- |
Дерма- |
Кератан- |
|
Тканина |
нова |
ітин-4- |
ітин-6- |
тан- |
сульфат |
Гепарин |
|
кислота |
сульфат |
сульфат |
сульфат |
|
|
|
|
|
|
|
|
|
Шкіра |
+ |
|
+ |
|
|
|
|
|
|
|
|
|
|
Хрящ |
+ |
+ |
|
+ |
+ |
|
|
|
|
|
|
|
|
Сухожилля |
|
|
+ |
+ |
|
|
|
|
|
|
|
|
|
Зв'язки |
|
|
+ |
|
|
|
|
|
|
|
|
|
|
Пупковий |
+ |
|
+ |
+ |
|
|
канатик |
|
|
|
|||
|
|
|
|
|
|
|
Склоподібне |
+ |
|
|
|
|
|
тіло |
|
|
|
|
|
|
|
|
|
|
|
|
|
Синовіальна |
+ |
|
|
|
|
|
рідина |
|
|
|
|
|
|
|
|
|
|
|
|
|
Серцеві кла- |
+ |
|
+ |
|
|
|
пани |
|
|
|
|
||
|
|
|
|
|
|
|
Спинальні |
|
|
|
+ |
+ |
|
диски |
|
|
|
|
||
|
|
|
|
|
|
|
Кістка |
+ |
+ |
|
|
+ |
|
|
|
|
|
|
|
|
Печінка |
|
|
|
|
|
+ |
|
|
|
|
|
|
|
Легені |
|
|
|
|
|
+ |
|
|
|
|
|
|
|
Судинна стін- |
|
|
|
|
|
+ |
ка |
|
|
|
|
|
|
|
|
|
|
|
|
|
Хрящ |
+ |
+ |
|
+ |
|
|
ембріона |
|
|
|
|||
|
|
|
|
|
|
|
Рогівка |
|
+ |
|
|
+ |
|
ока |
|
|
|
|
||
|
|
|
|
|
|
69

Кератансульфат II – протеоглікан скелета. Міститься в ньому разом із хондроітинсульфатом і зв'язаний із гіалуроновою кислотою рихлої сполучної тканини. Його полісахаридні ланцюги приєднують- ся до поліпептидного ланцюга за допомогою О-глікозидного зв'язку, утвореного N-ацетилгалактозаміном і залишками амінокислот – треоніну або серину.
Гепарин. Це класичний протеоглікан, у якому декілька полісаха- ридних ланцюгів зв'язані із загальним білковим ядром. Він знахо- диться в гранулах тучних клітин і, таким чином, локалізується всере- дині клітини. Гепарин має характерні структурні особливості. По- вторюваний дисахаридний компонент містить глюкозамін і уронову кислоту. Більшість аміногруп залишків глюкозаміну наявні в N- сульфатованій формі, але є невелика кількість ацетильованих аміно- груп. Глюкозамін містить також С6-сульфатний ефір.
Близько 90% уронової кислоти – це ідуронова кислота і лише 10% припадає на глюкуронову. Спочатку залишки уронової кислоти представлені у вигляді глюкуронової, але надалі після утворення по- лісахариду 5-епімераза перетворює майже 90% залишків глюкуроно- вої кислоти на залишки ідуронової. Останні часто зазнають сульфа- тування в 2 положенні.
Н
Структура гепарину
Білкова молекула протеоглікану гепарину унікальна в тому від- ношенні, що вона складається тільки із серинових і гліцинових зали- шків амінокислот. Близько 2/3 серинових залишків з'єднані з поліса-
70
