
Лекция №1_2 сем_ФЕРМЕНТЫ МИКРООРГАНИЗМОВ
.pdf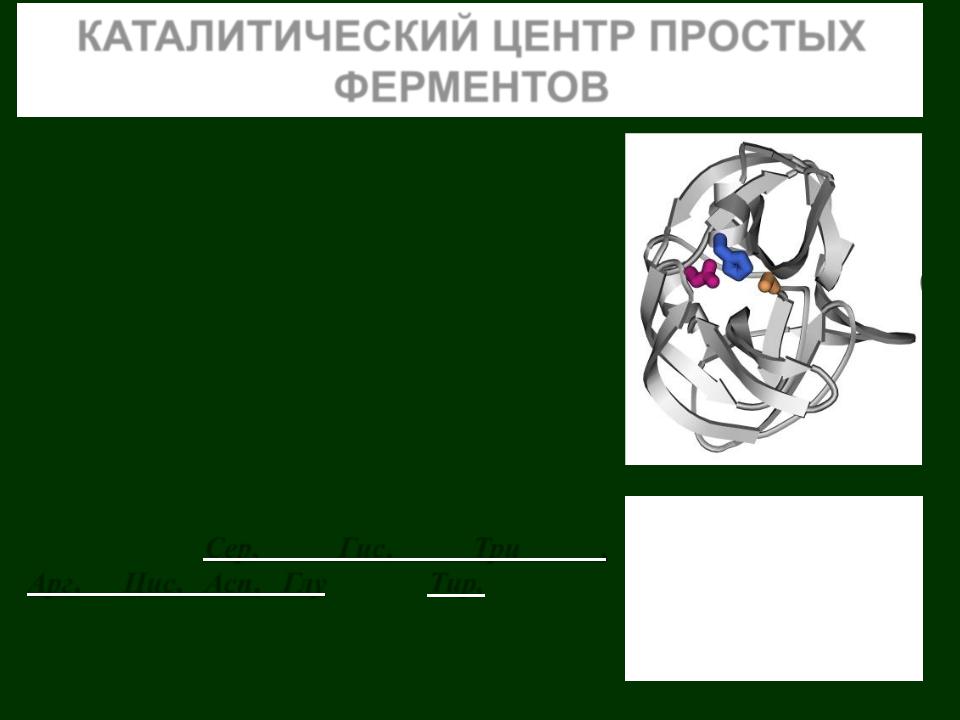
КАТАЛИТИЧЕСКИЙ ЦЕНТР ПРОСТЫХ ФЕРМЕНТОВ
Иначе обстоит дело у однокомпонентных ферментов, не имеющих агона, который мог бы входить в непосредственный контакт с субстратом. Предполагают, что каталитический центр однокомпонентного фермента представляет собой уникальное сочетание нескольких аминокислотных остатков, располагающихся в определенной части белковой молекулы. \
Чаще всего в каталитических центрах однокомпонентных ферментов встречаются
остатки |
Сер, |
Гис, |
Три |
, |
Арг, Цис, |
Асп, |
Глу и |
Тир, которые |
|
отвечают за связывание с субстратом. |
|
|||
Каталитический центр химотрипсина состоит из остатков: Ser195 (оранжевый), His57 (синий) и Asp102 (малиновый)
АКТИВНЫЙ ЦЕНТР ФЕРМЕНТОВ
Кроме каталитического центра, образованного сочетанием аминокислотных радикалов (у простых ферментов) или присоединением кофермента или простетической группы (у сложных ферментов), у ферментов в активном центре различают еще субстратный.
Под субстратным центром понимают участок молекулы фермента, ответственный за присоединение вещества (субстрата), подвергающегося ферментативному превращению. Часто этот участок называют 'якорной площадкой' фермента, где, как судно на якорь, становится субстрат. Во многих случаях прикрепление субстрата к ферменту идет за счет взаимодействия с ε-аминогруппой радикала лизина (Лиз),
расположенного в субстратном центре. Эту же роль может выполнять
СООН-группа глутаминовой кислоты (Глу), а также НS-группа цистеина (Цис).
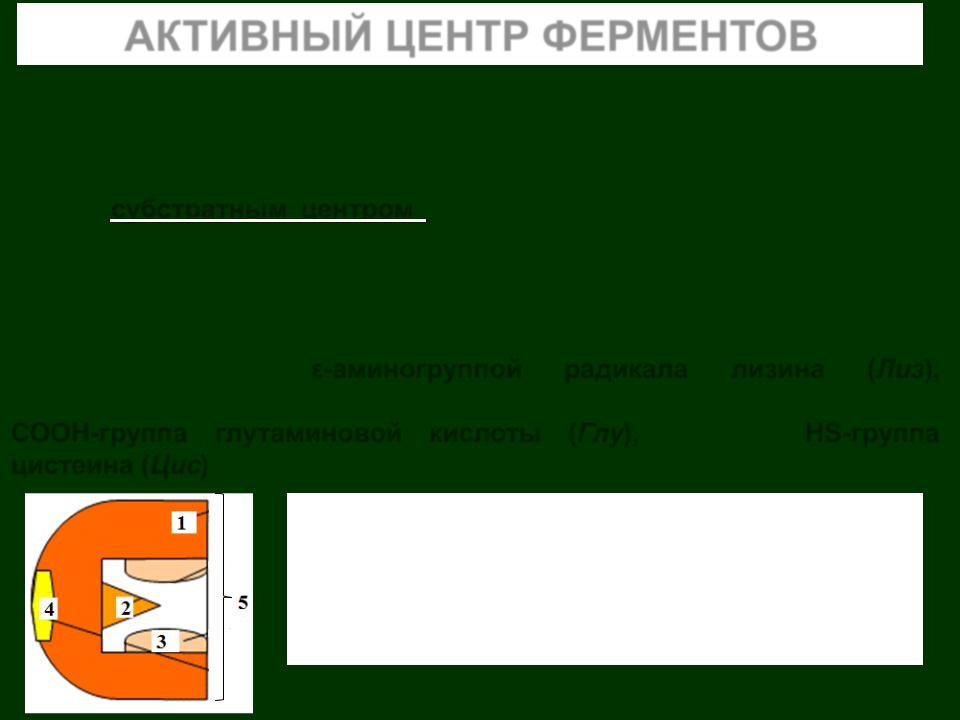
1– Апофермент (белковая часть)
2– Каталитический центр
3– Субстратный центр (контактные площадки)
4– Аллостерический центр
5– Активный центр фермента

АКТИВНЫЙ ЦЕНТР ФЕРМЕНТОВ
Однако работы последних лет показали, что гораздо большее значение здесь имеют силы гидрофобных взаимодействий и водородные связи, возникающие между радикалами аминокислотных остатков субстратного центра фермента и соответствующими группировками в молекуле субстрата.
Понятие о каталитическом и субстратном центре не следует абсолютизировать. В реальных ферментах субстратный центр может совпадать (или перекрываться) с каталитическим центром. Более того, каталитический центр может окончательно формироваться в момент присоединения субстрата. Поэтому часто говорят об активном центре фермента, представляющем сочетание первого и второго.
АЛЛОСТЕРИЧЕСКИЙ ЦЕНТР ФЕРМЕНТОВ
Аллостерический центр представляет собой участок молекулы фермента, в результате присоединения к которому определенного низкомолекулярного (а иногда - и высокомолекулярного) вещества изменяется третичная структура белковой молекулы. Вследствие этого изменяется конфигурация активного центра, сопровождающаяся либо увеличением, либо снижением каталитической активности фермента. Это явление лежит в
основе |
так |
называемой |
аллостерической |
регуляции каталитической активности ферментов.
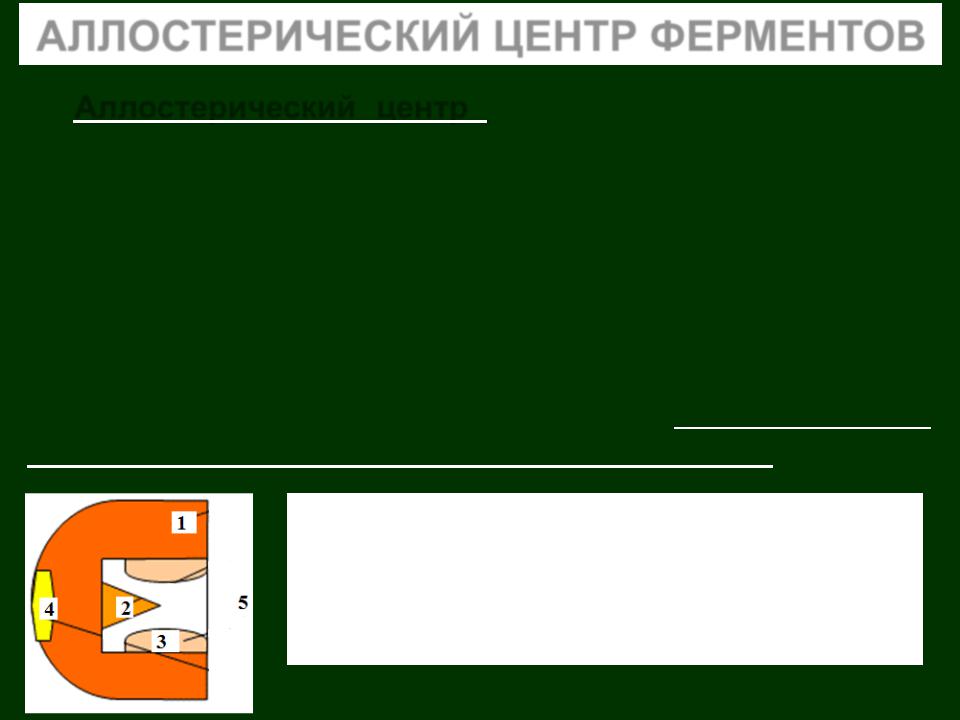
1– Апофермент (белковая часть)
2– Каталитический центр
3– Субстратный центр (контактные площадки)
4– Аллостерический центр
5– Активный центр фермента
РЕГУЛЯЦИЯ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ ФЕРМЕНТОВ
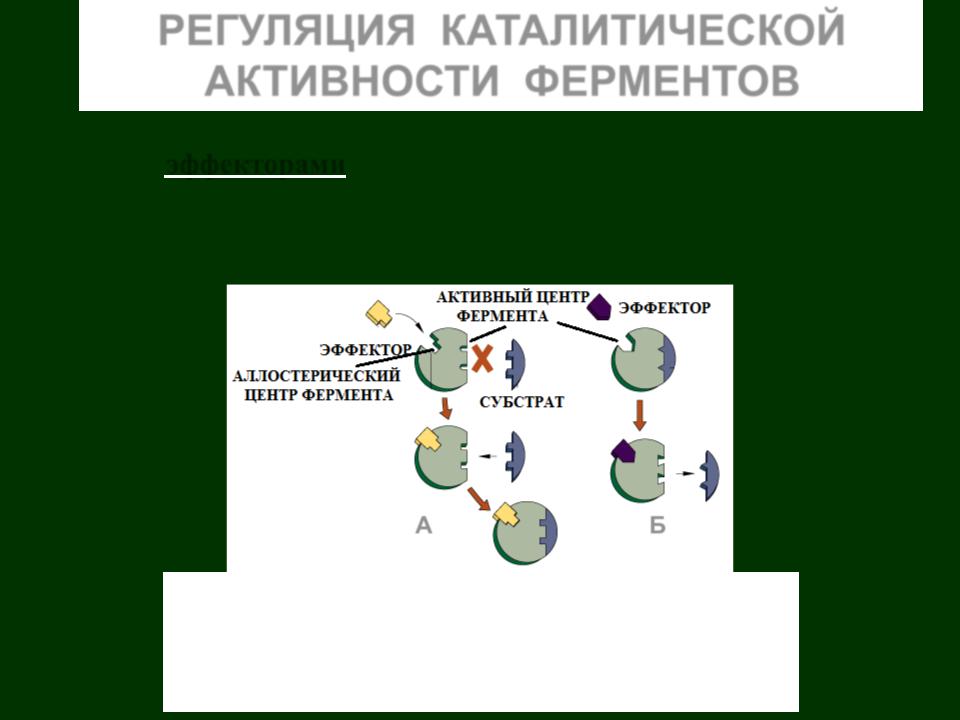
Соединения, изменяющие каталитическую активность фермента, называют эффекторами. Такими эффекторами могут быть конечные продукты данной ферментативной реакции – отрицательные эффекторы. Положительные эффекторы повышают активность фермента.
Эффекторы по своей структуре не сходны с субстратом.
А |
Б |
СХЕМА АЛЛОСТЕРИЧЕСКОЙ РЕГУЛЯЦИИ АКТИВНОСТИ ФЕРМЕНТОВ:
А– аллостерическим активатором;
Б– аллостерическим ингибитором
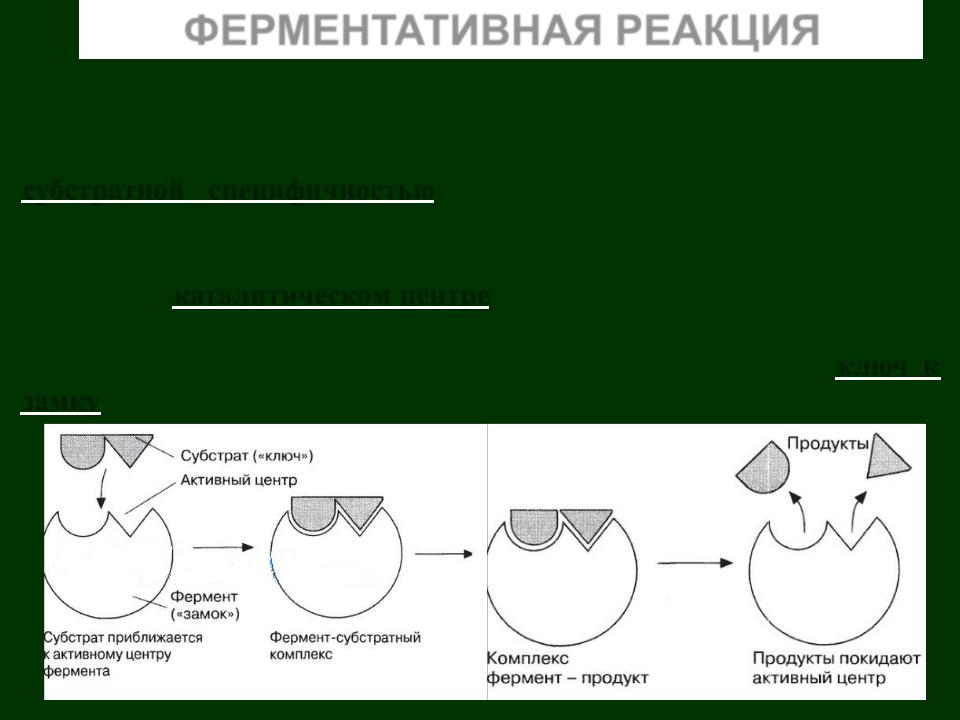
ФЕРМЕНТАТИВНАЯ РЕАКЦИЯ
Ферментативная реакция начинается со связывания определенного метаболита (субстрата) с ферментом. Каждый фермент взаимодействует лишь с одним субстратом, то есть характеризуется определенной субстратной специфичностью. Определение субстрата ферментом начинается во время связывания.
Субстрат присоединяется только в определенном участке молекулы фермента – каталитическом центре. Субстрат распознается ферментом благодаря стерическим свойствам субстрата и распределению заряда в его молекуле. Субстрат и фермент подходят друг другу, как ключ к замку.
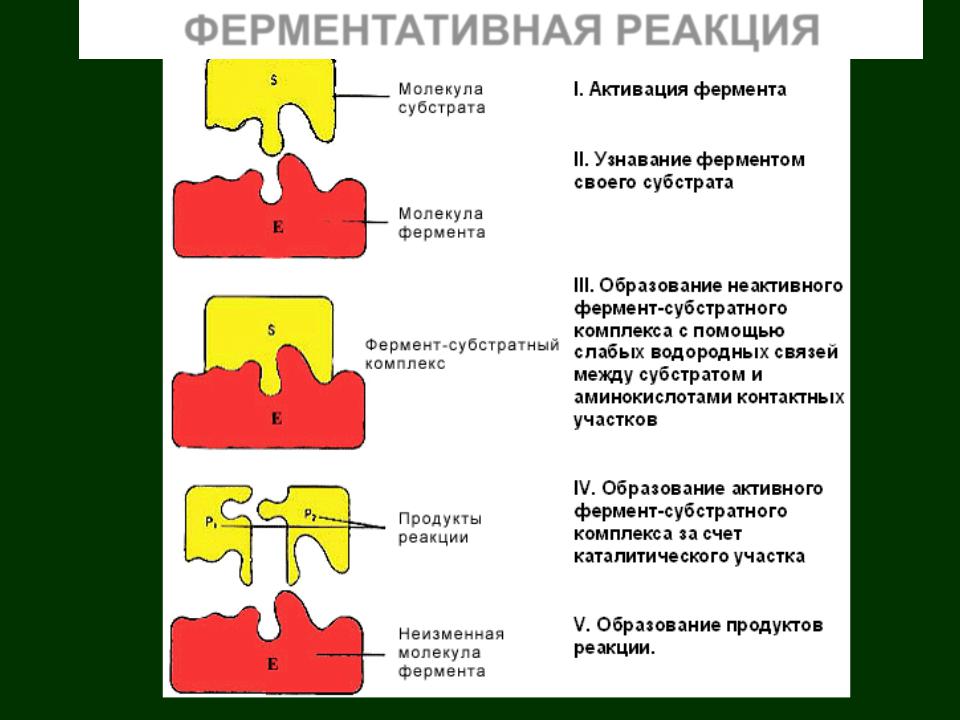
ФЕРМЕНТАТИВНАЯ РЕАКЦИЯ
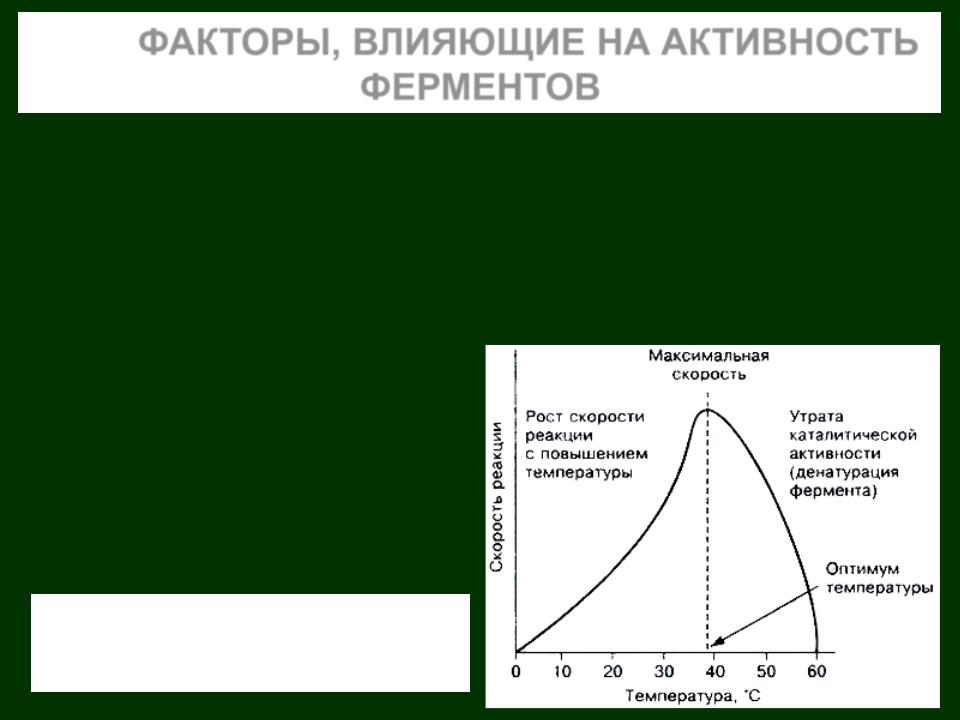
ФАКТОРЫ, ВЛИЯЮЩИЕ НА АКТИВНОСТЬ ФЕРМЕНТОВ
Активность ферментов зависит от ряда факторов, главные из которых рН и температура .
Так, возрастание температуры на 100 С усиливает активность биокатаизаторов почти в 2 раза. Однако при 100 0С каталитическое действие большинства ферментов необратимо прекращается.
ЗАВИСИМОСТЬ СКОРОСТИ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
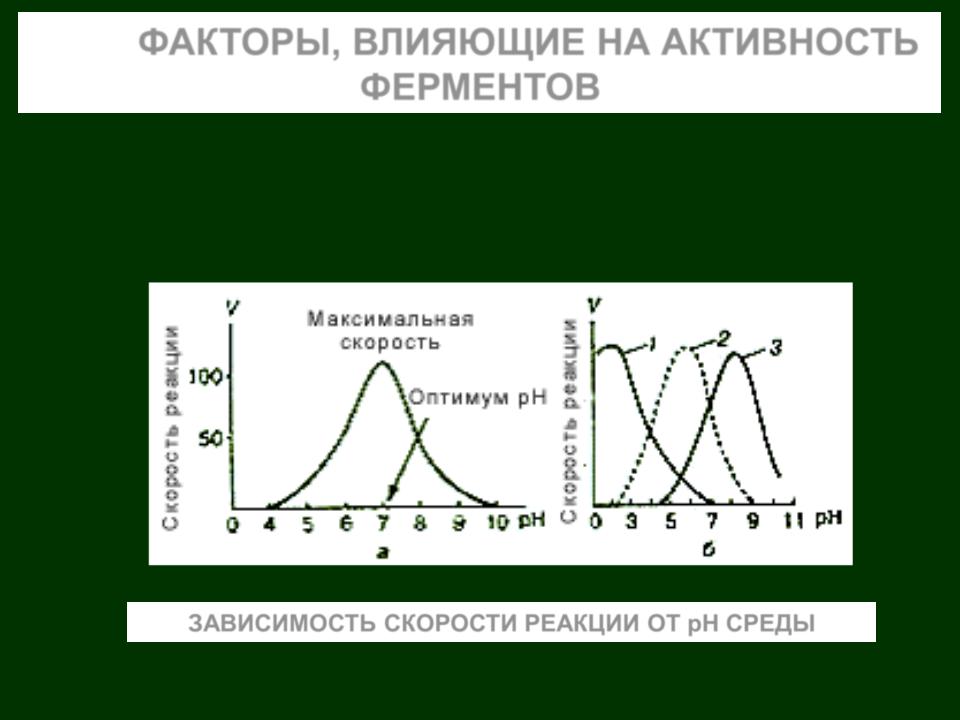
ФАКТОРЫ, ВЛИЯЮЩИЕ НА АКТИВНОСТЬ ФЕРМЕНТОВ
Для каждого фермента существует оптимум рН, изменение которого на 2 единицы в ту или иную сторону приводит почти к полной потере активности.
ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ рН СРЕДЫ

