
Таблицы
.pdfГОУ ВПО "Кемеровский государственный университет"
Химический факультет
Кафедра неорганической химии
С Б О Р Н И К
ОПОРНЫХ КОНСПЕКТОВ ПО КУРСУ НЕОРГАНИЧЕСКОЙ ХИМИИ
для студентов 1-го курса химического факультета
учебно-методическое пособие
Кемерово 2005
2
Составитель: д.х.н, доцент Т.А.Ларичев
Сборник опорных конспектов по курсу неорганической химии для студентов 1-го курса химического факультета. / Учебно-методическое пособие. / ГОУ ВПО "Кемеровский государственный университет"; Сост. Т.А.Ларичев. - Кемерово: Кузбассвузиздат, 2005. - 34 с.
Данный сборник предназначен для студентов первого курса химического факультета, обучающихся по специальности "Химия" 011000 и составлен в соответствии с рабочей программой "Неорганическая химия".
Утверждено на заседании кафедры |
Рекомендовано методической |
неорганической химии |
комиссией химического факультета |
"_____"________________2005 г. |
"_____"________________ 2005 г. |
Зав. кафедрой ____________________ |
Председатель _____________________ |
Э.П.Суровой |
Н.В.Серебренникова |
3
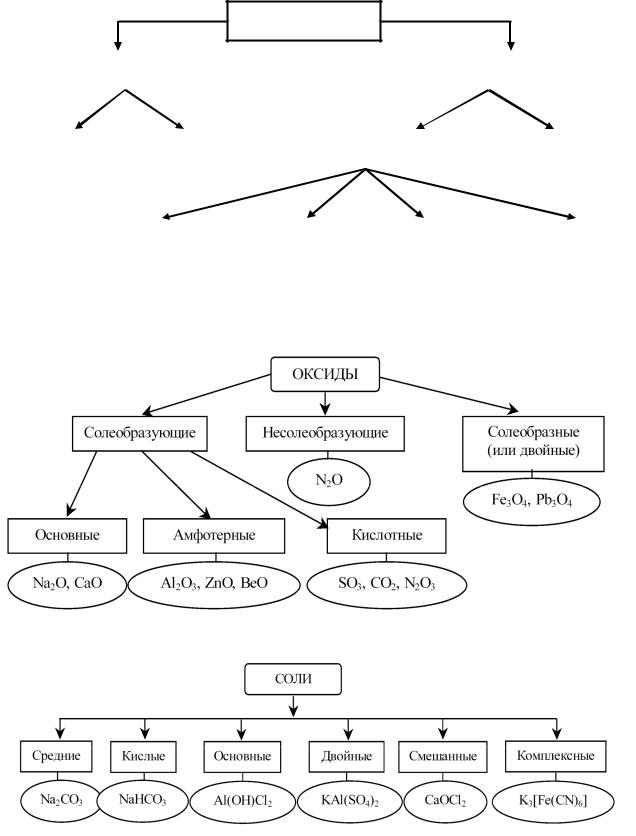
1. КЛАССИФИКАЦИЯ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
ВЕЩЕСТВА
ПРОСТЫЕ |
|
СЛОЖНЫЕ |
|
|
|
металлы |
|
неметаллы |
|
неорганические |
|
органические |
|
|
|
|
|
|
|
гидриды |
|
оксиды, |
|
гидроксиды |
|
соли |
|
|
пероксиды, |
|
|
|
|
|
|
|
|
|
||
|
|
надпероксиды, |
|
|
|
|
|
|
озониды |
|
|
|
|
|
|
|
|
|
|
|
Один из вариантов классификации оксидов
Один из возможных вариантов классификации солей
4
2. ХИМИЧЕСКАЯ НОМЕНКЛАТУРА
Номенклатура → использование языковых средств для выражения взаимосвязи между названием и формулой веществ.
Слова → состав слова:
приставка |
+ |
корень |
+ |
суффикс |
+ |
окончание |
Используется достаточно редко (только когда не хватает других средств)
количество H2O
-мета-
-мезо-
-орто-
количество атомов элемента
-би-
-ди-
дополнительное указание степени окисления
-гипо-
-пер-
|
|
Выражение рода |
Определяется |
|
|
|
(специфично для |
|
конкретным элементом, |
|
русского языка). |
образующим соединение. |
|
Поскольку термины |
Иногда отличается от |
|
заимствованы, то |
русского варианта |
|
не играет сущест- |
названия: |
|
венной роли |
Au, Ag, As, Fe, Hg, C, Sn, |
|
|
|
||
Pb, Si |
|
|
|
|
|
Главная нагрузка - |
|
|
связан со степенью окисления |
|
|
- |
-оватист- |
-ит- |
- |
-ист- |
-ат- |
--оват-
--н-

5
3. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
3.1. Закон эквивалентов
m1 = Э1 m2 Э2
3.2. Количество вещества = количество атомов или молекул
1 моль = 6,02×1023 штук
1 |
г = 1 а.е.м. × 6,02×1023 |
|
|
|
|
|
|
|
|
|
1 |
молекула O2 |
- |
масса m = 32 |
а.е.м. |
|
|
|
|||
1 |
моль O2 |
– |
масса m = 32 |
а.е.м. × 6,02×1023 = 32 г |
|
|||||
Количество вещества (моль) |
ν = |
m |
|
|
|
|
||||
M r |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|||
Сложные молекулы |
|
H2SO4 |
|
|
|
|
|
|
|
|
соотношение между атомами |
|
|
-2H |
: |
1S |
:4O |
||||
соотношение между молями атомов |
|
-2 моль H |
: |
1 моль S |
:4 моль O |
|||||
массовое соотношение |
|
|
|
2×Ar(H) |
: |
1×Ar(S) |
:4×Ar(O) |
|||
Поэтому, если известно массовое соотношение между элементами, то всегда можно перейти к количественному соотношению между атомами (стехиометрическому отношению):
массовое отношение |
- |
m(C) |
: |
m(O) |
: |
m(H) |
молярное отношение |
- |
m(C)/Ar(C) |
: |
m(O)/Ar(O) |
: |
m(H)/Ar(H) |
формула CxOyHz |
|
|
|
|
|
|
3.3. Закон Дюлонга-Пти |
|
|
|
|
|
|
Теплоемкость |
|
|
|
|
|
|
для нагревания 1 г Al (2,2×1022 атомов) на 1о |
|
требуется 0,901 Дж |
|
|||
для нагревания 1 г Pb (2,9×1021 атомов) на 1о |
разное количество |
|||||
требуется 0,128 Дж |
|
|||||
для нагревания 27 г Al (6,02×1023 атомов) на 1о |
требуется 24,35 Дж |
|
||||
|
|
|
примерно одинаковое количество |
|||
для нагревания 207 г Pb (6,02×1023 атомов) на 1о |
требуется 26,44 Дж |
|
||||
Мольная теплоемкость металлов не зависит от их природы и составляет порядка
25 Дж/моль×град.
6
3.4. Газовые законы
|
Закон Бойля-Мариотта |
Уравнение состояния |
|
|
||||||||
|
Закон Гей-Люссака |
идеального газа |
|
|
||||||||
|
Закон Шарля |
|
|
|
|
(уравнение Клапейрона) |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p1V1 |
= |
p0V0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Закон Авогадро |
|
||||
|
|
|
T1 |
|
|
T0 |
|
|
||||
|
|
|
|
|
|
|
|
|
1 моль газа = 22,4 л при н.у. |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Закон Дальтона |
||
|
|
|
|
|
|
|
|
|
|
Pобщ = P1 + P2 + P3 + … |
||
Для ν моль газа – уравнение Менделеева-Клапейрона |
|
|||||||||||
|
||||||||||||
Нормальные условия |
V0=ν×22,4 л=ν×0,0224 м3 |
|||||||||||
|
|
|
|
T0=273 K |
|
|
|
|
|
|||
|
|
|
|
p0=101300 Па = 760 мм рт. ст. = 1 атм. = … |
||||||||
p1V1/T1=p0V0/T0 p1V1 = 101300 Па × 0,0224 м3 /273 K×ν × T1
R=8,31 Дж/моль×К (в системе СИ)
pV=νRT
Свойства реальных газов отличается от свойств идеального газа в той или иной степени из-за наличия притяжения между молекулами, а также отталкивания между ними (последнее проявляется при высоких давлениях).
Пример подобных отклонений в графической форме представлен на рисунке:
p |
Идеальный |
|
газ |
||
|
N2 |
V
В математическом виде выражение, позволяющее описать поведение реального газа, было предложено Ван-дер-Ваальсом (1873 г.)
|
|
|
|
|
||
p + |
|
a |
( |
V |
− b)= RT |
|
|
|
2 |
||||
|
||||||
|
V |
|
||||
V - молярный объем газа (V/n)
a - учитывает притяжение молекул b - связано с размером молекул

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
3.5. Решение задач с использованием газовых законов |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
Схема анализа проблемы: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
Протекает химическая |
|
|
|
|
|
|
|
|
|
Реакция в |
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
нет |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
реакция? |
|
|
|
да |
|
|
|
газовой фазе? |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
да |
|
|
|
|
|
|
Смесь газов? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нет |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Отношения объемов вступающих в ре- |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
да |
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
нет |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
акцию газов и газообразных продуктов |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
реакции равны отношению |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
коэффициентов в уравнении реакции |
||||||||||||||||
|
|
|
Известна масса газа? |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
Нужно найти массу газа? |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
Давление любого компонента газовой |
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
смеси не зависит от наличия других |
||||||||||||||||
|
|
|
|
|
|
|
|
да |
|
|
|
нет |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
компонентов. Общее давление газовой |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
смеси равно сумме давлений компонентов |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(парциальных давлений) |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
1. Использовать уравнение Менделеева-Клапейрона |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pV = |
|
|
m |
RT |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M r |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
Значение R меняется в зависимости от используемых |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
размерностей: |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
p |
|
|
|
V |
|
|
|
R |
|
|
|
|
|
|
размерн. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
Па |
|
|
|
м3 |
|
|
8,31 |
|
|
|
|
|
|
Дж |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
моль* К |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
кПа |
|
|
|
л |
|
|
8,31 |
|
|
|
|
|
|
Дж |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
моль* К |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
атм. |
|
|
|
л |
|
|
0,082 |
|
|
|
|
|
|
атм* л |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
моль* К |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
мм рт. |
|
|
|
л |
|
|
62,36 |
|
|
|
|
мм_ рт.ст.* л |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
ст. |
|
|
|
|
|
|
|
|
|
моль* К |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
R рассчитывается для 1 моля газа и нормальных условий: |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
R = |
p0V0 |
, (T0=273 K всегда) |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. Привести условия к нормальным; |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 моль газа (Mr) занимает при н.у. объем 22,4 л |
|||||||||||||||||||||
|
|
|
|
|
|
или |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
либо использовать универсальное уравнение |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
p0V0 = p1V1 T0 T1

8
4. РАСЧЕТЫ, СВЯЗАННЫЕ С ИСПОЛЬЗОВАНИЕМ КОНЦЕНТРАЦИИ РАСТВОРОВ
На практике используется ограниченное число способов выражения концентрации.
Все они выражают соотношение между компонентами раствора:
Вид |
|
Раствор |
Растворенное |
Растворитель |
концентрации |
|
|
вещество |
|
|
|
|
|
|
Процентная |
100 единиц массы (г, кг, |
Х |
100-Х |
|
(массовая) |
т, пуды, фунты и т.д.) |
единиц массы |
единиц массы |
|
|
|
|
|
|
Молярная |
1 |
литр = 1000 мл |
N моль |
|
|
|
|
|
|
Нормальная |
1 |
литр = 1000 мл |
N г-эквивалентов |
|
|
|
|
|
|
Мольная доля |
(N+n) моль |
N моль |
n моль |
|
|
|
|
|
|
Моляльность |
|
|
N моль |
1000 г |
|
|
|
|
|
Титр |
1 |
мл |
N г |
|
|
|
|
|
|
Для расчета конкретной разновидности концентрации необходимо иметь информацию о количестве не менее чем двух компонентов раствора (в соответствии с таблицей).
Для перехода от одной разновидности концентрации к другой необходима дополнительная информация согласно схеме (в некоторых случаях прямые переходы невозможны):
|
|
|
МОЛЯРНАЯ |
|
Мольная доля |
Mr, Mr р-ля |
Mr, ρ |
Mr |
|
|
|
|||
|
|
|
|
|
|
|
|
ν |
|
Mr р-ля |
|
Процентная |
ρ |
Титр |
|
(массовая) |
|
|
|
|
Mr |
Э, ρ |
|
Э |
|
|
|
||
Моляльность |
|
|
НОРМАЛЬНАЯ |
|
|
|
|
|

9
5. СТРОЕНИЕ АТОМА
5.1. Этапы создания современной модели строения атома
"Ультрафиолетовая катастрофа"
1900 г. - Макс Планк Энергия излучается отдельными порциями – квантами Энергия кванта E=hν
"Красная граница" фотоэффекта
1905 г. – Альберт Эйнштейн Свет может быть описан как поток квантов (фотонов)
Модель атома Резерфорда
Атомарный спектр водорода
1913 г. – Нильс Бор Основанная на постулатах теория строения атома водорода
1924 г. – Де Бройль Гипотеза о волновых свойствах материальных объектов
λ = h mv
1926 г. – Эрвин Шрёдингер Волновое уравнение движения электрона вокруг ядра в атоме водорода
Ψнабор квантовых чисел n, m, l
Ψраспределение электронной плотности (форма орбиталей)
Ψэнергия электрона в атоме

10
5.2. Электронная конфигурация
Правила определения электронной структуры атомов
1.Заполнение начинается с орбиталей, имеющих минимальную энергию, затем последовательно заполняются орбитали, имеющие большую энергию. Порядок заполнения определяется правилом Клечковского ((n+l)min).
2.На каждой орбитали может находиться не более двух электронов (принцип Паули).
3.При заполнении подуровня электроны размещают так, чтобы получилась конфигурация с максимальным спином (правило Хунда).
5.3. Изучение электронного строения атома с привлечением данных спектроскопии
|
Л а й м а н |
7 |
|
6 |
Б а л ь м е р |
|
|
5 |
|
4 |
|
3 |
|
2 |
П а ш е н |
n = 1 |
+ |
|
Б р э к е т т |
П ф у н д
Электронные переходы в атоме водорода, соответствующие разным сериям.
