
- •Методичні вказівки і контрольні завдання
- •1. Методичні вказівки
- •2. Приклади вирішення задач Загальні вказівки
- •А. Рівняння стану ідеального газу
- •Б. Теплоємність газів
- •В. Газові суміші
- •Г. Термодинамічні процеси ідеального газу
- •Д. Термодинамічні процеси зміни стану водяної пари
- •Е. Паливо. Матеріальний і тепловий баланси процесу горіння
- •Контрольні завдання з курсу «енерготехнологія хіміко-технологічних процесів» Домашнє завдання № 1
- •Література
- •Домашнє завдання № 2
- •Література
В. Газові суміші
Газова суміш - це механічна суміш газів, не вступаючих між собою в хімічні реакції. Вона може бути задана масовими, об'ємними або молярними частками.
Масовою
часткою називають відношення маси Мi
кожного газу, що входить в суміш, до
загальної маси М суміші:
![]()
Об'ємною
часткою називають відношення приведеного
об'єму Vi
газу до загального об'єму суміші Vсм
газів:
![]()
де Vi
- приведений об'єм, тобто об'єм, який
займав би компонент газу при певній
температурі і тиску суміші
![]()
Молярною часткою називається відношення числа молей Kiкожного газу до числа молейК- Кi /Ксуміші.Молярна частка чисельно рівна об'ємній частці:
![]()
Газова постійна суміші газів залежно від способу завдання суміші
![]() або
або
![]() .
.
Середня (уявна) молярна маса суміші
![]() або
або 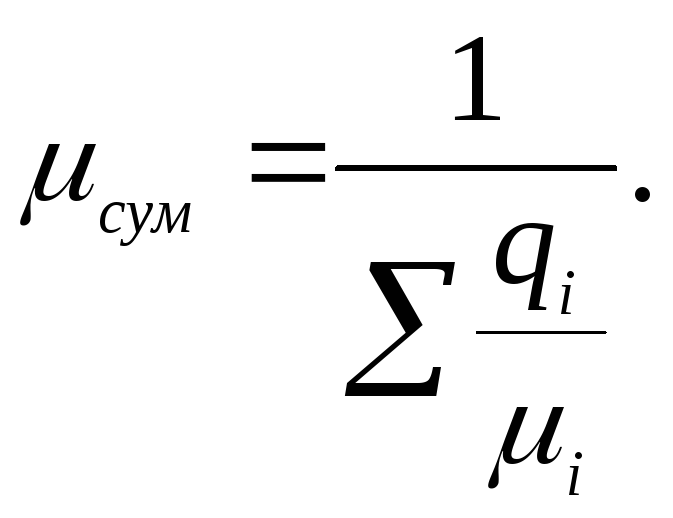
Парціальний
тиск кожного газу дорівнює добутку
загального тиску суміші на його об'ємну
частку: ![]()
Параметри газової суміші можуть бути обчислені з рівняння Клапейрона PV=MRT, де всі величини, що входять в рівняння, відносяться до суміші газів.
Приклад
4.
Об'ємний склад сухих продуктів згоряння
палива наступний, %:
![]() Знайти уявну молярну масу, газову
постійну, густину і питомий об'єм
продуктів згоряння при В=750
мм рт.ст., t=800°С.
Знайти уявну молярну масу, газову
постійну, густину і питомий об'єм
продуктів згоряння при В=750
мм рт.ст., t=800°С.
Рішення
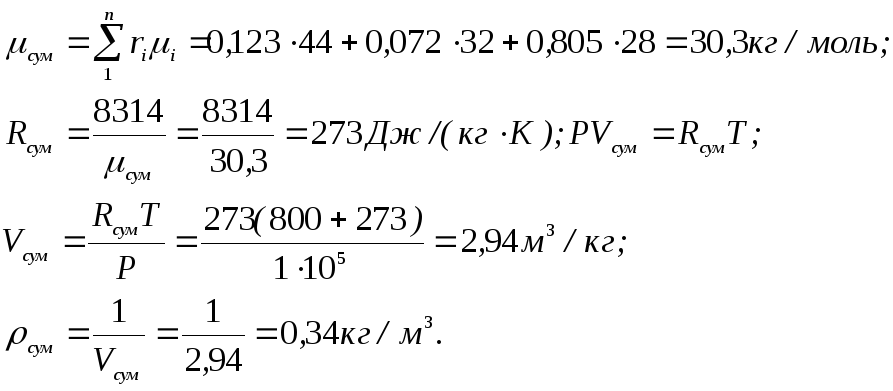
Г. Термодинамічні процеси ідеального газу
Термодинамічним процесом називають зміну параметрів стану робочого тіла. Існує нескінченна кількість термодинамічних процесів, їх називають політропними, і зміна параметрів в них підкоряється рівнянню: PVn = const, де n - показник політропи.
Окремими процесами є ізохорний (V=const), ізобарний (P=const), ізотермічний (T=const) і адіабатний (dq=const), який протікає без відведення і підведення теплоти. Для будь-якого процесу зміна внутрішньої енергії 1 кг газу обчислюється за виразом:
![]() при
Сv
= const
DU
= Cv
(t2
– t1).
при
Сv
= const
DU
= Cv
(t2
– t1).
зміна ентальпії ![]() при
Сv
= const
Dt
= Cp
(t2
– t1).
при
Сv
= const
Dt
= Cp
(t2
– t1).
зміна ентропії :

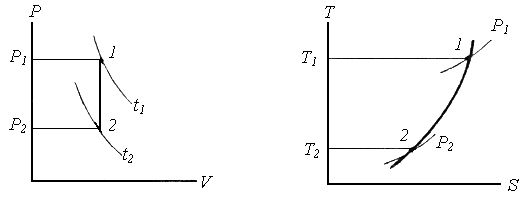
Приклад 5.В закритій посудині знаходиться повітряпритискуР1=5бар і температурі t1=270С.Визначте тиск повітря після охолодження до 0°С.Зобразите процес в P-V і Т-S - координатах.
Рішення.
Залежність між початковими і кінцевими
параметрами в ізохорному процесі
![]() .
Тоді
.
Тоді
![]()
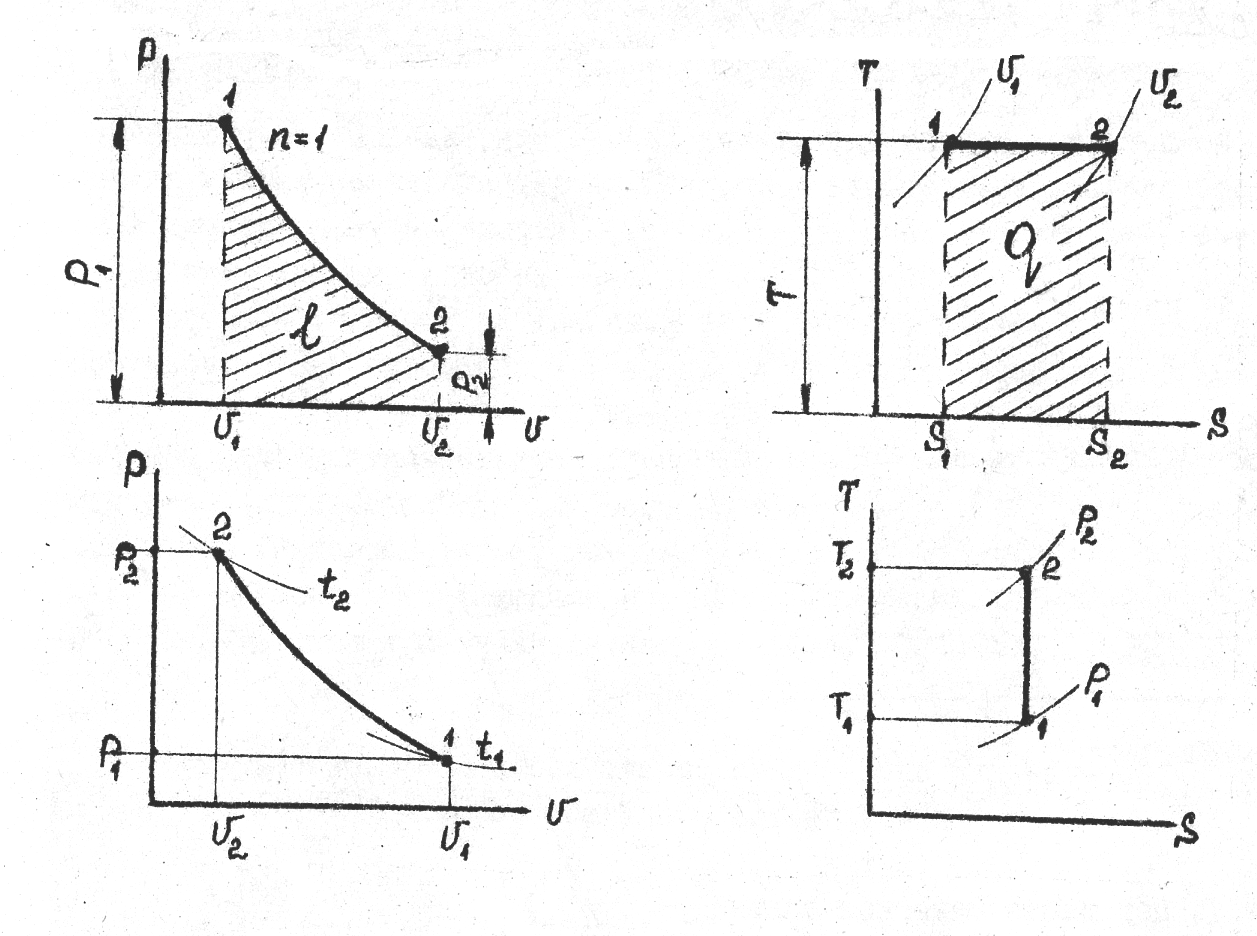
Приклад 6. Визначте роботу ізобарного розширення азоту масою 7 кг при нагріванні в інтервалі температур від t1= 2000С доt2= 6000С. Покажіть процес в P-V-і Т-S - діаграмах.
Рішення.
Робота розширення
![]()
![]()
де М - маса газу, R - газова постійна, Дж/ (кг0С); t1, t2-відповідно початкова і кінцева температура азоту, 0С.
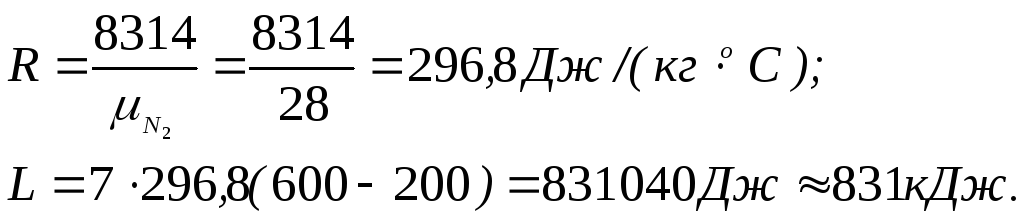
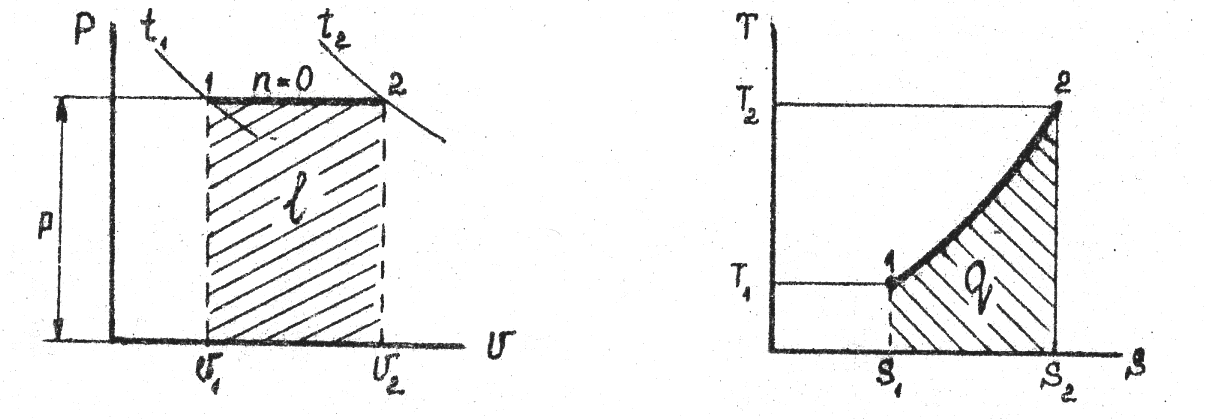
Приклад 7. 0,2 кг кисню при температурі t1=250С розширюється ізотермічно до триразового збільшення об'єму. Визначте кількість теплоти, що надається тілу.
Рішення.
Оскільки в ізотермічному процесі вся
підведена теплота йде на здійснення
роботи, то
![]()
де Q-підведена теплота, Дж;М -маса газу, кг;R- газова постійна, Дж/(кг·К );
Т–температура газу, К;V1 і V2 - відповідно початковий і кінцевий об'єм, м³.
![]()
Приклад 8.Газ СОпри тиску Р1=0,9бар і початковій температурі t1=120Садіабатно стискається до тискуР2=3,6 бара.Визначте температуру в кінці стиснення.
Рішення. Кінцеву температуру визначають із співвідношення параметрів Р і Т в адіабатному процесі:

де k–показник адіабати. Для двоатомного газу k=1,4. Тоді
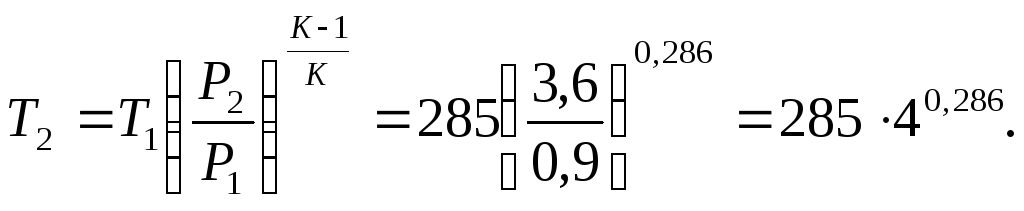
Позначимо![]() черезN. lg
N =
0,286ln4
= 0,286·0,602 =
0,172.
черезN. lg
N =
0,286ln4
= 0,286·0,602 =
0,172.
ЗвідсиN=1,49.ОтжеT2=285·1,49=425K.
