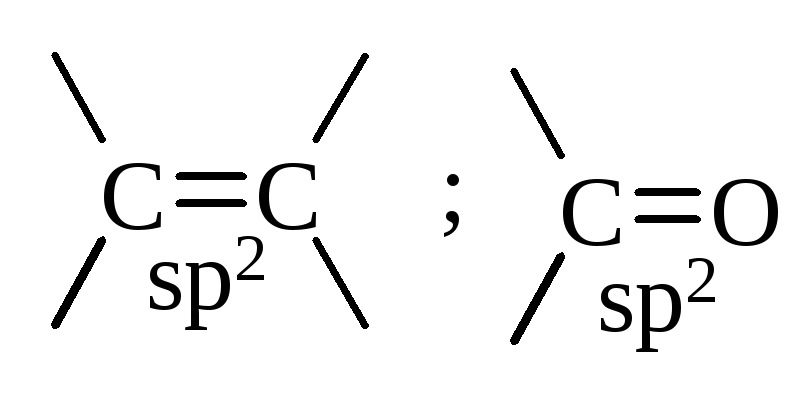3. Гібридизація атомних орбіталей.
Розглянемо будову атому карбону в основному та збудженому станах:

Рис. 2.4. Заповнення електронних оболонок атома карбону в основному та збудженому стані.
При збудженні основного стану атома карбону відбувається перехід одного електрона з 2s-підрівня на 2р-підрівень(2pz) з утворенням збудженого карбону з чотирма неспареними електронами.
Відомо, що в більшості органічних сполук атом карбону чотирьохвалентний і що в симетричній молекулі метану (СН4) всі чотири зв’язки рівноцінні. Для пояснення цього факту в органічній хімії було введено поняття про гібридизацію атомних орбіталей (Л. Полінг, Д. Слейтер, 1927-1934 рр.).
Гібридизація – це перекривання (перемішування) різних за природою атомних орбіталей (s, p) з утворенням гібридних атомних орбіталей.
Основні наслідки положення гібридизації атомних орбіталей:
в гібридизації беруть участь атомні орбіталі, близькі за енергією та симетрією;
гібридизовані атомні орбіталі беруть участь в утворенні лише σ-зв’язків, які завдяки ефективному перекриванню з іншими атомними орбіталями, утворюють міцні ковалентні зв’язки.
Атом карбону в органічних сполуках може існувати в трьох валентних станах:
перший валентний стан (sp3-гібридизація) характерний для алканів (насичених вуглеводнів);
другий валентний стан (sp2-гібридизація) характерний для алкенів (ненасичених вуглеводнів);
третій валентний стан (sp-гібридизація) характерний для алкінів (ненасичених вуглеводнів);
3.1. sp3-Гібридизація.
|
|
Внаслідок взаємодії (перекривання) однієї s- та трьох р-орбіталей утворюються sp3-гібридні атомні орбіталі; характерні для насичених сполук (алканів). |
|
Графічно це можна показати так:

Атом карбону в sp3-стані знаходиться в центрі правильного тетраедра з валентним кутом 109° 28.
3.2. sp2-Гібридизація.
|
|
Внаслідок взаємодії (перекривання) однієї s- та двох р-орбіталей утворюються гібридизовані sp2-атомні орбіталі. Негібридизована 2pz-атомна орбіталь приймає участь в утворенні -зв’язку, наприклад, в алкенах. |
|
Графічно утворення sp2-атомних гібридних орбіталей можна показати наступним чином:
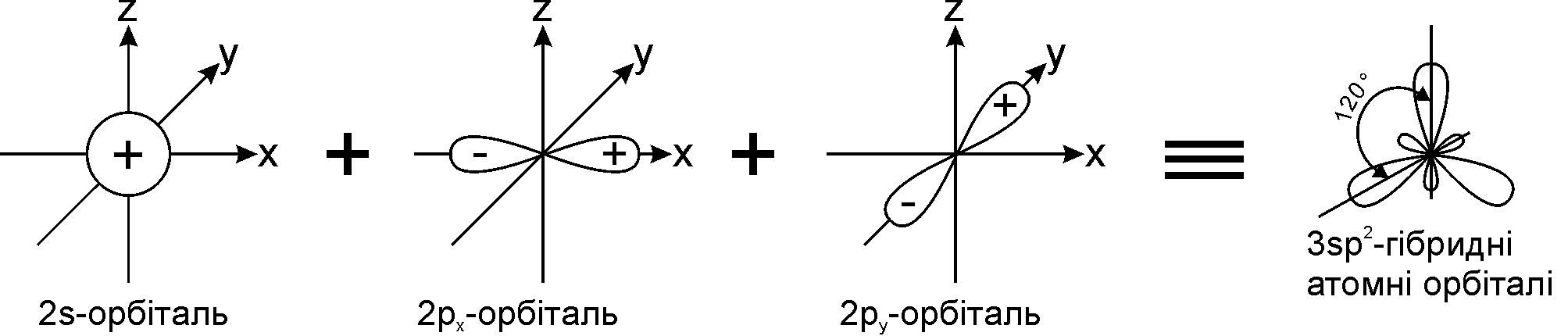
утворені sp2- гібридні атомні орбіталі є тригональними (площинний трикутник) з валентним кутом 120°.
3.3. sp-Гібридизація.
|
|
Внаслідок взаємодії (перекривання) однієї s- та однієї р-орбіталі утворюються гібридизовані sp-атомні орбіталі. Негібридизована 2pу та 2pz-атомні орбіталі приймають участь в утворенні -зв’язків, наприклад, в алкінах. |
|
Графічно утворення sp-атомних гібридних орбіталей можна показати наступним чином:
|
|
sp-гібридні атомні орбіталі є лінійними, які розташовані в просторі під кутом 180°. |
Аналізуючи валентні стани атома карбону в різних вуглеводнях, можна констатувати, що при переході в ряду: sp3-sp2-sp гібридних орбіталей атома карбону доля s-орбіталі (її внесок в загальну гібридну орбіталь) та електронегативність атома карбону закономірно зростають, що суттєво впливає на хімічні властивості цих сполук в ряду: алкани – алкени – алкіни, табл. 2.2.
Таблиця 2.2.
Доля s-орбіталі та зміна електронегативності атома карбону в різних гібридних (валентних) станах.
|
Гібридний стан |
sp3 |
sp2 |
sp |
|
Внесок s-орбіталі в гібридні орбіталі, % |
25 |
33 |
50 |
|
Електронегативність атома карбону в наведених групах атомів, В |
|
|
|
|
2,3-2,5 |
2,9 |
3,1-3,3 |