
Лекция№1 Термодинамика и кинетика
.docДәріс №2
Химиялық термодинамика және кинетика
Химиялық термодинамика – термодинамиканың заңдарын химиялық процестерге қолданады, химиялық реакциялар кезінде байқалатын энергияның бір түрден басқа түрге айналуын, реакциялардың бағытын және реакциялардың өздігінен жүру мүмкіндігін анықтайды.
Химиялық термодинамиканың зерттеу объектісі термодинамикалық жүйе болып табылады. Термодинамикалық жүйе деп айналадағы ортадан ойша бөлінген дене немесе өзара әсерлескен денелердің жиынтығын айтады. Жүйе айналадағы ортадан белгілі бір нақты беткі бөлігімен бөлінеді және жүйедегі молекулалар саны көп болады, себебі термодинамика молекулалар саны аз жүйелерді зерттемейді.
Жүйе айналадағы ортамен әрекеттесуіне байланысты үш түрге бөлінеді: қоршаған ортамен затпен де, энергиямен де алмасатын жүйе – ашық, зат алмасудан басқа байланыста болатын жүйе – тұйық (жабық), ортамен затпен де, энергиямен де алмаспайтын жүйе – оқшауланған (изоляцияланған) деп аталады.
Агрегаттық күйі бойынша жүйелер гомогенді және гетерогенді болып бөлінеді. Гомогенді жүйе тек бір фазадан тұрады, ал гетерогенді жүйе екі немесе одан да көп фазалардан тұрады. Фаза деп бөлу беті арқылы жүйенің басқа бөліктерден бөлінген жүйенің біртекті бөлімін айтады. Фазаның кез келген нүктесінде физикалық және химиялық қасиеттері бірдей болады. Қатты күйдегі жеке зат өзіндік фазаны түзеді. Ал сұйық және газ фазалар конденсацияланған деп аталады.
Жүйені сипаттайтын барлық физикалық және химиялық күйлердің жиынтығы (көлем, масса, қысым, температура, химиялық құрам және т.б.) жүйенің күйі деп аталады. Кейбір жүйенің күйлері тәуелсіз айнымалылар ретінде алынса, оларды жүйе күйінің параметрлері деп атайды (мысалы: қысым, көлем, температура). Жүйе күйінің параметрлерін экстенсивті және интенсивті деп екі топқа бөледі. Экстенсивті параметрлер (көлем, масса) жүйедегі заттың мөлшеріне пропорционал, ал интенсивті параметрлер (температура, қысым, тұтқырлық) жүйедегі заттардың мөлшеріне байланысты емес болады.
Жүйе күйінің қандай болса да параметрлерінің өзгеруін процесс деп атайды. Бұдан басқа термодинамикалық процестер қайтымды және қайтымсыз болады. Қайтымды процесте жүйе энергия жұмсамай-ақ өзінің алғашқы күйіне келе алады, мұндай процестер өте баяу жүреді.
Күй параметрлерге тәуелді және тура өлшене алмайтын айнымалы шамалар – термодинамикалық функциялар деп аталады:
Тепе-теңдік күйі деп жүйе күйінің уақытқа байланысты өзгермейтін күйі деп аталады. Мұнда зат та, энергия да жүйеге енбейді.
Термодинамиканың 0-ші заңы температураны термометр көмегімен өлшеуге негізділген. 1931 ж Р.Фаулер жылулық тепе-теңдігің өтпелілігі туралы заң ашты: егер А және В жүйелерінің әрқайсысы С жүйесімен жыжулық тепе-теңдікте болатын болса, онда А мен В жүйелері де өзара жылулық тепе-теңдікте болады.
Термодинамиканың
бірініші заңы.
Бұл оқшауланған жүйенің энергиясын
сақтайтын заң: энергияның
әр түрлі формалары бір-біріне тек
эквивалентті мөлшерде ауысады. Жүйеге
берілген жылу (Q)
сол жүйенің ішкі энергиясын (U)
ұлғайтуға және сыртқы күштерге әсер
ету үшін жұмысқа (A) жұмсалады:
![]()
Ішкі
энергияға жүйені құрайтын бөлшектердің
(атом, электрон, ядро, молекулалар)
қозғалысы мен өзара әрекеттесу
энергияларының барлық түрі енеді де,
жүйенің кинетикалық энергиясы мен
сыртқы күштердің потенциалдық энергиясы
кірмейді. Ішкі энергияның абсолюттік
мәні анықталынбайды, бірақ оның өзерісін
табу болады:
![]()
Процестің
жұмысы (A) – бұл
өзара әрекеттесу нәтижесінде бір денеден
екінші денеге берілетін энергия. Химиялық
термодинамикада газдың ұлғаю жұмысы
қарастырылады:
![]() сонда
сонда
![]()
Изохоралық
процестер үшін : V=const,
ондай жүйеде ешқандай жұмыс (A=0)
жасалмайды, себебі
![]() бұл кезде жүйеге берілген жылу сол
жүйенің ішкі энергиясын арттыруға
жұмсалады:
бұл кезде жүйеге берілген жылу сол
жүйенің ішкі энергиясын арттыруға
жұмсалады:![]()
Изотермиялық
процестер үшін: Т=const
және
U=const, dU=0 сонда:
![]()
Адиабаттық
(сыртқы ортамен жылу арқылы алмасуы
жоқ) процестер үшін Q=0
сонда:
![]()
Изобаралық процестер үшін: р=const, dp=0, бұл жағдайда H – энтальпия деп аталатын күй функциясы қолданылады, энтальпия деп тұрақты қысымдағы жүйенің энергиясын айтамыз, ол сандық түрде ішкі мен потенциалдық энергиялардың қосындысына тең: H=U+A=U+pV
Энтальпия
– термодинамикалық функция, ол Т, Р, V,
U шамалары сияқты жүйенің қандай да бір
қасиетін сипаттайды. Берілген жүйе үшін
оның абсолюттік мәнін анықтау мүмкін
емес; термодинамикалық есептеулерде
жүйе бір күйден екіншісіне өткен кездегі
энтальпия өзгерісін
![]() ғана табуға болады.
ғана табуға болады.
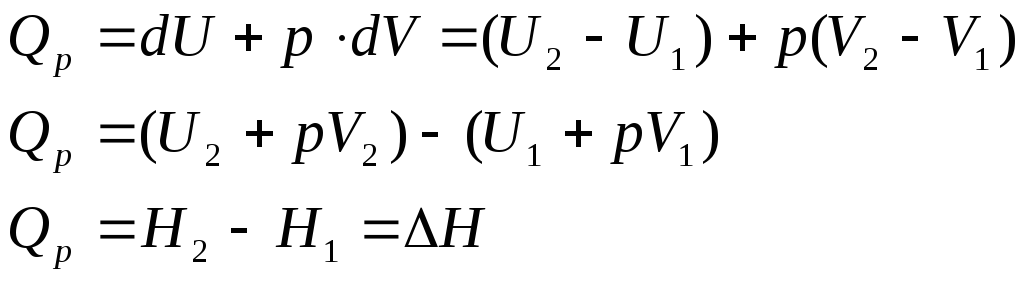
Бұл өзгеріс жүйе бастапқы күйден соңғысына қандай жолмен, қандай аралық физика-химиялық өзгерістерден өткеніне тәуелді емес. Сонымен, изобаралық процесс кезінде жүйеге берілген жылу сол жүйенің энтальпиясын өзгертуге жұмсалады деп есептеуге болады. Энтальпияның (Н, кДж/моль-1) өзгеруі теріс таңбамен алғанда химиялық реакцияның жылу эффектісіне тең болады: Нх.р. = Q
Реакциялардың
жылу эффектілерін (Q) зерттейтін химияның
саласы термохимия деп аталады. Химиялық
реакцияларда жылу бөлінуі немесе
сіңірілуі мүмкін. Жылу бөліне жүретін
реакциялар экзотермиялық
(Q>0,
![]() <0),
ал жылу сіңіре жүретін реакциялар
эндотермиялық
(Q<0,
<0),
ал жылу сіңіре жүретін реакциялар
эндотермиялық
(Q<0,
![]() >0)
деп аталады. Реакция теңдуінде бөлінген
немесе сіңірілген жылу эффектісі
көрсетілген теңдеулерді термохимиялық
деп
аталады. Термохимияның негізгі заңы –
Гесс заңының (1840 ж.) салдары бойынша
стандартты жағдайда химиялық реакцияның
жылу эффектісін Q анықтауға болады.
Реакцияның жылу эффектісі өнімдердің
түзілу жылуларының қосындысы мен
бастапқы заттардың түзілу жылуларының
қосындысының айырмасына тең болады:
>0)
деп аталады. Реакция теңдуінде бөлінген
немесе сіңірілген жылу эффектісі
көрсетілген теңдеулерді термохимиялық
деп
аталады. Термохимияның негізгі заңы –
Гесс заңының (1840 ж.) салдары бойынша
стандартты жағдайда химиялық реакцияның
жылу эффектісін Q анықтауға болады.
Реакцияның жылу эффектісі өнімдердің
түзілу жылуларының қосындысы мен
бастапқы заттардың түзілу жылуларының
қосындысының айырмасына тең болады:
![]()
мұндағы
![]() –
сол заттың стандарттық түзілу жылуы,
яғни 298К температурада, 1 атм қысымда
түзілген қосылыстың 1 моліне жұмсалған
жылудың мөлшері, n – реакция теңдеуінің
стехиометриялық коэффициенттері.
–
сол заттың стандарттық түзілу жылуы,
яғни 298К температурада, 1 атм қысымда
түзілген қосылыстың 1 моліне жұмсалған
жылудың мөлшері, n – реакция теңдеуінің
стехиометриялық коэффициенттері.
Изобаралық
процестің жылу эффектісі
![]() тұрақты қысымдағы заттың жылу сыйымдылығы
(Ср) және температура өзгерістерімен
анықталады:
тұрақты қысымдағы заттың жылу сыйымдылығы
(Ср) және температура өзгерістерімен
анықталады:
![]() одан
одан
![]()
Термодинамиканың екінші заңы. Термодинамиканың 1-ші заңы табиғатта өздігінен жүретін процестердің бағытын анықтай алмайды. Ол тек оқшауланған жүйенің энергиясы тұрақты екенін, энергия түрлерінің өзара өзгерістернінің эквивалентті екенін көрсете алады. Термодинамиканың 2 заңы бойынша процестің бағытын, шегін және өту не өтпеу мүмкіндігін анықтауға болады.
Термодинамиканың 2 заңының бірнеше ережесі бар:
1. Клаузиус постулаты: жылу өздігінен салқын денеден ыстық денеге өте алмайды, яғни температурасы төмен денеден температурасы жоғары денеге жылудың алмасу процесі жүзеге аспайды.
2. Топсон постулаты: процеске қатысатын денелердің ең салқыны жұмыс көзі бола алмайды.
Белгілі процестер оң, теріс және тепе-теңдік болып үшке бөлінеді. Өздігінен жүретін процестер оң деп аталады. Табиғатты өздігінен өтетін процестер тек бір бағытта жүреді, олардың бірі – қайтымсыз процестер.Олардың жүруі үшін энергия не жұмыс жұмсалмайды, тіпті мұндай процестердің көмегімен жұмыс пен энергия алуға болады. Оң процестерге қарсы теріс процестер, олардың жүруіне энергия жұмсалады. Бұл процестердің негізінде жүйе тепе-теңдік күйден алшақтайды.
Осы екі постулатты біріктіріп, келесі қорытынды жасайды: цикл нәтижесінде ғана теріс процесс болуы мүмкін емес, теріс процеспен қатар оны жүргізуге себепші энергия көзі болып табылатын он процесс те жүруі керек. Бұдан сыртқы ортаның жылуын оны тек қана салқындату арқылы жұмыстың эквиваленттік мөлшеріне айналдыратын периодық түрде жұмыс істейтін машина болуы мүмкін емес. Жылу өзгерісін былай көрсетуге аламыз:
![]()
мұндағы S – жүйенің күй функциясы, оны 1850 ж Клаузиус енгізген болатын және оны энтропия деп атайды, ол жүйенің ретсіздік дәрежесін сипаттайды. Мысалы, егер көлемі 1 л ыдыс қысымы 1 атм тең идеал газбен толтырылған, оны екінші дәл сондай бірақ вакуумделген ыдыспен кран арқылы жалғаған. Кран ашылысымен екі ыдыста қысым теңескенше газ бір ыдыстан екніші ыдысқа ауысады, яғни бір мезгілде екі ыдыстың ішіндегі қысым 0,5 атм тең болады. Бақылап отырған газдың ұлғаю процесінде, көлем үлкейгенде, идеал газ жылу сіңірмейді және шығармайды. Сонда да берілген процесс, өздігінен жүретін процесс болып табылады. Екі ыдысқа біркелкі таралған газ, кенеттен ыдыстардың біреуіне кетіп, екіншісішінің босап қалуы болатын кері процесс жүруі мүмкін емес.
Қарастырылған процестің өздігінен жүріу жүйедегі ретсіздктің ұлғаюына байланысты. Ретсіздік дәрежесі энтропиямен сипатталанады. Энтропия, энергия сияқты өзара ірекеттесуші бөлшектердің өте үлкен сандарынан тұратын, кез-келген жүйенің шынайы қасиеті болып табылады. толық дифференциал болғандықтан оның кез-келген процесте өзгерісі процестің жүрі жолына тәуелді емес, ол тек жүйенің бастапқы және соңғы күйлеріне байланысты болады:
![]()
Осыдан
энтропия өзгерісі жүйе күйіне, процестің
қандай температурада орындалғандығына
тәуелділігін міндетті түрде ескеру
қажет. Энтропия – бөлектің
қозғалысынсипаттайтын заттың қасиеті
– ол берілген жүйенің ықтималдық
сипаттамасы болуы мүмкін. Л.Больцман
жүйенің әрбір күйінің сипаттамасы
ретінде «термодинамикалық
ықтималдық»
(W)
ұғымын енгізді. Термодинамикалық
ықтималдық неғұрлым көп болса, соғұрлым
жүйе күйінің ретсіздігі жоғары болады.
Энтропияның ықтималдық логарифміне
тура пропорционал екендігін Больцман
көрсетті. Бұл дәлелдеуді М.Планк келесі
теңдеумен өрнектеді:
![]()
мұндағы k – Больцман тұрақтысы.
Осы көзқарас арқылы термодинамиканың 2 заңын былайша айтуға болады: оқшауланған жүйенің энтропиясы максимумға ұмтылады. Жүйенің температурасы өскен заттар қатты күйден сұйыққа (еру, балқу), сосын буға не газға (қыздыру, булану, сублимация) айналған сайын ондағы бөлшектердің ретсіз қозғалысы артады және энтропия өседі.
Қысым артқан сайын заттардың энтропиясы төмендейді, себебі заттар газ (бу) күйден сұйыққа (конденсация), одан кейін қатты күйге (қату) ауысады, молекулалардың тәртіпті қозғалысы артады. Энтропия заттардың агрегаттық күйіне тәуелді:
Стандартты
жағдайда анықталған заттың энтропиясы
стандартты деп аталады, оны
![]() (Дж/моль*К).
(Дж/моль*К).
Энтропияның таңбасының мәні бойынша химиялық реакциялардың бағытын анықтауға болады:
-
Оқшауланған жүйеде өтетін изотермиялық және толық қайтымды процестер кезінде энтропия өзгермейді, тұрақты болады, яғни dS=0
-
Тұйық жүйеде T=const, V=const жағдайында қайтымсыз процестер өтеді және сол жүйелердің энтропиясы артады, яғни S>0.
Сонымен, оқшауланған жүйеде тек энтропияның өсуімен сипатталанатын процестер өздігінен жүруі мүмкін.
Өздігінен жүретін (P=const, T=const) реакцияның жүру шегін және бағытын анықтайтын функция – изобара-изотермалық потенциал немесе Гиббстің бос энергиясы (G, кДж/моль) деп аталады. Гиббс энергиясы энтальпия мен энтропиямен келесі қатынаста болады:
Мұндай жүйеде өздігінен және тура бағытта келесі процесс жүреді, егер G < 0, және кері бағытта – егер G > 0 болса, және жүйе тепе-теңдік күйде болады егер G = 0.
Стандартты жағдайда (қысым және концентрация 1-ге тең болғанда) жүретін реакция үшін Гиббс энергиясының өзгеруі келесі формуламен есептелінеді: Gх.р.(станд) = Gөнім – Gбаст.зат
Химиялық кинетика
Химиялық процестердің жүру мүмкіндігі жүйенің Гиббс энергиясының өзгеруінің таңбасы мен шамасы арқылы анықталатыны айтылған. Бірақ, бұл шама реакцияның осы жағдайда жүру не жүрмеуін, оның жылдамдығы қандай болатынын және процестің механизмін түсіндіре алмайды. Химиялық реакциялардың жылдамдықтарын және олардың жүру механизмін зерттейтін физикалық химияның бөлімін химиялық кинетика деп атайды. Химиялық кинетиканың негізгі шамаларының бірі – реакция жылдамдығы.
Химиялық реакцияның жылдамдығы деп көлем өзгермеген жағдайда реакцияға қатысатын заттардың біреуінің концентрациясының (C) белгілі бір уақыт бірлігінде (t) өзгеруін айтады:
![]()
Реакция жылдамдығы мен концентрацияның арасындағы сандық байланыс химиялық кинетиканың негізгі постулатымен анықталады: гомогендің реакцияның жылдамдығы белгілі бір температурада реакцияға қатысатын заттардың концентрацияларының көбейтіндісіне тура пропорционал болады. Әр заттың концентрациясының дәрежесі стехиометрлік коэффициентке, яғни реакция теңдеуіндегі берілген заттың формуласының алдында тұрған коэффициентке тең. Бұл ережені басқа түрде алғаш рет Н.Н.Бекетов (1865ж.), кейін К.Гульдберг пен П.Вааге (1967ж.) тұжырымдаған. Оны басқаша әрекеттесуші массалар заңы деп те атайды.
![]()
Реакция жылдамдығына әсер ететін негізгі факторлар: концентрация, қысым, температура және катализаторлар.
Кез келген реакцияның жылдамдығы әрекеттесетін молекулардың соқтығысу санына тәуелді болады, себебі соқтығысу саны әрекеттесетін заттардың концентрациясына пропорционал. Бірақ молекулалардың соқтығысуларының барлығы емес химиялық әрекеттесуге әкеледі. Сонда реакция жылдамдығы соқтығысу санымен қатар сол молекулардың соқтығысуына әсер ететі белгілі қасиетіне тәуелді болады. Аррениустың активтендіру теориясы бойынша реакциияға тек бойында артық мөлшерде энергия қоры бар молекулалар ғана қатыса алады, мұндай молекулалар активті деп аталады. Орташа энергия қоры бар молекуланы реакцияға қатыса алатындай және оны активті күйге келтіру үшін жұмсалатын энергияны активтендіру энергиясы (Еакт) деп аталады.
Сонымен химиялық реакция жылдамдығы активтендіру энергияның шамасына тәуелді болады: активтендіру энергиясы неғұрлым көп болса, реакция соғұрлым баяу жүреді, ал активтендіру энергиясы аз болған сайын реакция жылдам жүреді де, молекулардың бірімен-бірінің соқтығысуына көбірек мүмкіндік береді. Сонда химиялық реакция жылдамдығы активті молекулалар санының активті емес молекулалар санының қатынасына тәуелді болады:
![]()
Немесе
бұл теңдеуді келесі түрде жазуға болады:
![]()
ал
оны логарифмдегенде:
![]() (3)
(3)
мұнда k – қалыпты жағдайдағы реакция жылдамдығының константасы, k0 – барлық соқтығысулар реакцияға әкеледі деген жағдайда жылдамдық константасы.
Егер Т1 және Т2 температураларда жылдамдық константалары k1 және k2 белгілі болса, онда 3-ші теңдеу арқылы реакцияның активтендіру энергиясын анықтауға болады:


Қорыта келгенде температураның өсуімен реакция жылдамдығының артуы температура жоғарлаған кезде молекулалардың орташа кинетикалық энергияның өсуімен қатар, 2-ші теңдеуден көре алатындай реакцияға мүмкіндігі бар, артық мөлшерде энергияға ие болатын активті молекулалар санын артуымен түсіндіріледі.
Химиялық реакциялар қайтымды және қайтымсыз болып бөлінеді. Қайтымды реакция деп, бір-біріне қарама-қарсы екі бағытта жүретін реакцияны айтады. Бір бағытта жүретін реакцияны қайтымсыз деп атайды. Тура бағыттағы реакция жылдамдығы кері бағыттағы реакция жылдамдығына теңесу жағдайы химиялық тепе-теңдік деп аталады.
Тепе-теңдік реакцияларының маңызды сипаттамасы – тепе-теңдік тұрақтысы. Қайтымды реакция үшін тепе-теңдік тұрақтысының (Кт-т) математикалық өрнегі массалар әрекеттесу заңының негізінде өрнектеледі:
![]()
Жүйенің сыртқы жағдайы өзгермесе, оның тепе-теңдік күйі де өзгермейді, ал оның өзгеруі – тепе-теңдіктің ығысуына әкеледі. Химиялық тепе-теңдіктің ығысуына температура, қысым және концентрация әсер ету мүмкін. Тепе-теңдіктің ығысуы Ле-Шателье принципімен (1884ж.) анықтайды: тепе-теңдік күйде тұрған жүйенің сыртқы жағдайларының бірі өзгерсе, тепе-теңдік сол өзгеріске қарсы әсер ететін процестің бағытына қарай ығысады.
Катализатор әсерінен жылдамдығы өзгеретін процестерді каталитикалық процесс деп атайды. Егер катализатор реакцияның жылдамдығын арттырса, катализ оң, ал реакция жылдамдығын төмендетсе, теріс деп аталады. Кейде реакциялық қоспаға ешбір катализатор қоспаса да, осы реакция өнімі катализатор болып, реакция жылдамдығын өзгертеді. Мұндай реакцияларды автокаталиттік, ал құбылысты автокатализ деп атайды. Өзін-өзі тездететін реакциялардың жылдамдығы әуелі өте төмен болады, реакция нәтижесінде алынған жаңа зат өзге молекулаларының пайда болуын тездететіндіктен, реакция жылдамдығы жоғарылайды, ал реакция соңында жылдамдық күрт төмендейді.
Катализаторды қолдану негізгі мақсаты – сол реакцияның активтендіру энергия шамасын төмендету, сонымен бірге ол активтендірудің энтропиясын арттырады, яғни химиялық әрекеттесуге ыңғайлы, кеңістіктегі молекулалардың бағытталуын реттейді.
Кейбір заттар катализатордың әсер етуіне кедергі жасайды, ондай заттарды ингибиторлар немесе катализатор улары, ал кейбір заттардың катализаторлық қасиеті жоқ, ал оларды басқа катализаторға қосса, онда мұндай қоспаның катализаторлық қабілеті артады. Мұндай заттарды промоторлар немесе активтендірушілер деп атайды.
Қазір каталиттік процестер өнеркәсіпте кеңінен қолданылады. Катализатор қолданылмайтын химия саласын табудың өзі қиын. Катализатор көмегімен спирттер, альдегидтер, аммиак, күкірт және азот қышқылдары, жағар, жанар майлар, пластикалық массалар, резина, бояу, маргарин және басқа да көптеген заттар алынады.
Каталиттік реакциялар гомогенді және гетерогенді болып бөлінеді. Әрекеттесетін заттар мен ондағы катализатор біртекті жүйеден тұрса, яғни олардың бәрі де бір фазада болса, онда мұны гомогенді катализ дейді.
Гетерогенді катализ деп әрекеттесетің реагентпен ондағы ка-тализатор әр түрлі фазада болатын реакцияларды айтады. Гетерогенді катализде катализатор қатты зат, ал реагенттер не сұйық, не газды күйде болады. Мұндай реакциялар екі фаза аралығында, яғни фазалық бетте, катализатордың бетінде жүреді.
