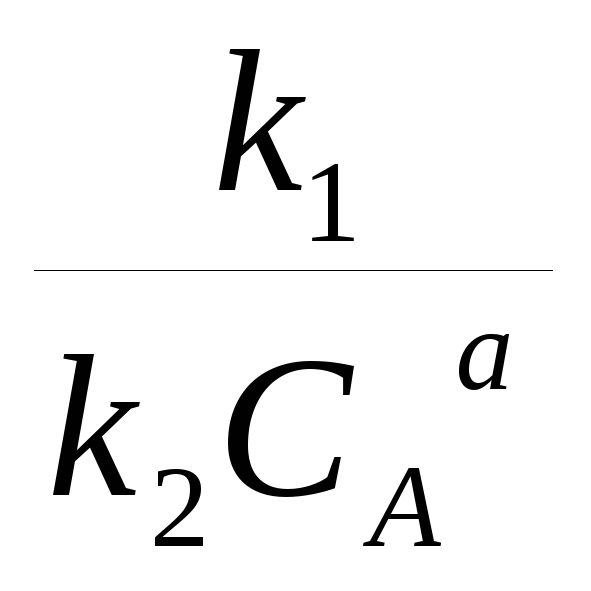- •Министерство образования и науки украины
- •Химические реакторы
- •Классификация реакторов
- •Структура математической модели химического реактора
- •Реакторы непрерывного действия
- •Каскад реакторов идеального смешения
- •Графический метод расчета к – рис
- •Параллельные и последовательные реакции
- •Селективность, выход, степень превращения
- •Селективность различных реакций
- •Последовательные реакции
- •Зависимость селективности от степени превращения
- •Модели ректоров с неидеальной структурой потока
- •Каталитические процессы
- •Сущность и виды катализа
- •Гомогенный и гетерогенный катализ
- •Гетерогенный катализ
- •Свойства твердых катализаторов и их изготовление
- •Зависимость степени превращения от температуры
- •Однако все контактные аппараты с фильтрующим слоем катализатора обладает следующими недостатками, присущие фильтрующему слою и затрудняющие дальнейшую интенсификацию. Недостатки фильтрующего слоя
- •Использование нестационарных режимов для проведения каталитических реакций в оптимальных температурных условиях
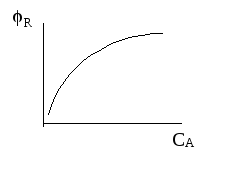
Селективность различных реакций
|
n1 и n2 |
WR/WS |
φR = f(CA) |
φR = f(XA) |
рекомендуемый тип реактора |
|
n1 > n2 n1 - n2 = a |
|
|
|
РИВ |
|
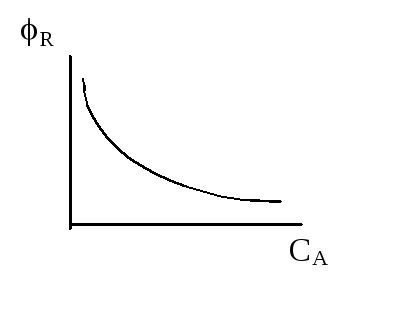
n1 < n2 n1 - n2 = - a |
|
|
|
РИС - Н |
|
n1 = n2 n1 - n2 = 0 |
|
Не зависит от СА и ХА |
Любой | |
Последовательные реакции
![]()
Ограничимся случаем реакций первого порядка, протекающих без изменения объема. Кинетические уравнения будут
1)
![]()
2)
![]()
3)
![]()
Первое уравнение описывает скорость расходования вещества А. Второе - результирующую скорость накопления продукта R. Если целевой продукт – R, то соотношение скоростей образования R и S будет
![]()
Уравнение показывает, что селективность будет тем больше, чем выше концентрация исходного реагента и соотношение k1/k2 .
Зависимость селективности от степени превращения
Для элементарного объема РИВ для реакции
![]() ,
,
протекающей без изменения объема cмеси и при равенстве a = r = s селективность будет
![]()
![]()
Выход продукта Ф или Χ

В РИС - Н эта зависимость
![]()
Зависимость селективности от степени превращения позволяет выбрать оптимальную модель реактора для максимального выхода целевого продукта.
Следовательно, при проведении последовательных реакций более высокая селективность достигается в РИВ и РИС – П.
Селективность также зависит от соотношения k1 / k2 .
Если константа скорости второй реакции k2 значительно больше первой k1 (k2 >> k1), высокая селективность достигается только при малых степенях превращения и резко падает при высоких степенях превращения. Для получения высокой селективности такие процессы следует осуществлять по циклической схеме при малой степени превращения исходного сырья за один проход через реактор. Целевой продукт извлекается из реакционной смеси с последующей рециркуляцией непрореагировавшего сырья.
Если k2 << k1, можно одновременно достичь высокой селективности и степени использования сырья без введения рецикла.

Селективность
процесса по промежуточному продукту
при последовательной реакц ии
ии![]()

Зависимость селективности от степени превращения для необратимой реакции
Выход целевого продукта, селективность и степень превращения зависят от модели реактора. Если селективность с увеличением степени превращения уменьшается (а, б), выход будет уменьшаться. В этом случае площадь под кривой больше площади прямоугольника, поэтому предпочтительнее РИВ и РИС – П. К – РИС занимает промежуточное положение.
Если с увеличением степени превращения селективность возрастает, то лучше использовать РИС – Н. В этом случае применение каскада не рекомендуется, т. к. выход в нем будет ниже, чем в единичном реакторе.
Химические реакторы с неидеальной структурой потока
Рассмотрим одну из важнейших особенностей, присущий большинству химико-технологических процессов и очень что редко встречаются в «чистой» химии, а именно поток. Он характерный для подавляющего большинства технологических аппаратов: вносит в них исходные вещества, переносит реакционную смесь от входа до выхода, выносит продукты из аппарата. Поток сыграет важнейшую роль в процессах переноса тепла и вещества. Эти процессы также чрезвычайно специфические для химической технологии и в то же время их довольно редко приходится учитывать в лабораторных химических экспериментах.
Итак, поток. Течь может газ (например, смесь азота с водородом при синтезе аммиака), жидкость (течение мономеров при полимеризации в потоке), движение шихты в доменной печи тоже можно рассматривать как поток. Могут быть и значительно больше сложные случаи, когда «течет», двигается многофазная смесь типа суспензии или эмульсии или когда в аппарате организуют два потока навстречу друг другу (например, газ поднимается вверх, а навстречу стекает жидкость) и т.д. Будем рассматривать в основному движение одного потока; при этом для простоты все, что течет, будем называть жидкостью - будь то жидкость, газ или, например, суспензия. Лишь в отдельных случаях будут даваться уточнение, о котором именно потоке речь идет.
Главная роль потока в химическом процессе — это перенос: перенос реагирующей массы вдоль аппарата, перенос тепла, которое выделяется в процессе, из глубины аппарата к охлаждающим стенкам и т.д. При этом наиболее важные два аспекта: перенос в продольном направлении (в том направления, куда двигается поток, а также в противоположном — навстречу потоке) и перенос в поперечном направлении. Эти случаи часто сыграют разную роль, и о них следует поговорить отдельно.
Прежде чем говорить о переносе в потоке отметим что, большинство процессов, которые протекают в реальных условиях, носит сложный характер: каждый процесс состоит из ряда стадий, которые происходят в нем или последовательно, или параллельно. Чаще всего оказывается, что одна из стадий лимитирует процесс. Это значит, что характер протекания процесса в целом определяется данной стадией. Отсюда следует, что интенсификация других (нелимитирующих) стадий слабо влияет на общий ход процесса. Если мы хотим ускорить процесс, необходимо влиять именно на стадию, которая лимитирует. Если стадии процесса последовательные, то лимитировать будет, как правило, самая медленная, самая продолжительная, наименее интенсивная стадия. Если стадии параллельные, то лимитирует быстрейшая, интенсивная, самая мощная стадия.
Рассмотрим пример потока, относящийся к иному типу процессов. Завод получает рудный концентрат с обогатительной фабрики рудника. Основной способ доставки — железная дорога. Перевозка складывается из следующих последовательных стадий: 1) погрузка концентрата в вагоны (около 3 часов); 2) следование состава от рудника до завода (около 2 суток); 3) разгрузка (около 4 часов). Вторая стадия — самая длительная и потому лимитирующая. Так, если ускорить в 1,5 раза первую стадию, то время перевозки в целом сократится на 1,8 %; если третью — перевозка ускорится на 2,4 %. Если же удастся ускорить в 1,5 раза вторую стадию, то время всей перевозки сократится на 29 %.
С другой стороны, небольшая часть концентрата доставляется не по железной дороге, а автотранспортом. В таком случае оба способа доставки являются параллельными стадиями. Если, например, автомобильные перевозки в общей сумме составляют 1,5 %, то лимитирующей оказывается более производительная стадия — доставка по железной дороге. Вряд ли стоит вкладывать крупные средства, чтобы вдвое увеличить автоперевозку, поскольку в итоге это даст лишь незначительный эффект.
В дальнейшем нам неоднократно придется выделять лимитирующие стадии и в последовательных, и в параллельных вариантах.
МЕХАНИЗМЫ ПЕРЕНОСА
Структура потока тесно связана с механизмами переноса. В потоке происходит перенос многих субстанций, но для химической технологии наиболее важны три из них: перенос импульса (количества движения), перенос тепла и перенос вещества. Эти процессы происходят во многом аналогично, и каждый из них может осуществляться тремя различными механизмами, которые регламентируются уровнем (масштабом) элементарного акта.
Нижний уровень переноса — квантовый. Перенос осуществляется путем излучения и поглощения элементарных частиц. Обычно этот механизм так и называют излучением (лучистым переносом). Так может переноситься импульс (вспомните давление света); именно таким образом тепло Солнца передается нам на Землю; так переносится и вещество (в космических лучах, в потоках элементарных частиц, летящих из выходных устройств ускорителей, и т. д.). Мы почти не будем касаться лучистого переноса, поскольку в «обычной» химической технологии его роль не очень значительна, и только лишь в области высоких температур излучение тепла начинает определять особенности процесса. Следующий уровень — молекулярный: перенос происходит в результате теплового движения молекул. Процессы молекулярного переноса называются по-разному. Перенос импульса на молекулярном уровне называют вязкостью (вязким трением). Мы все в общем представляем себе, что такое вязкость, но почему вязкость — это перенос импульса, понять не столь легко.
Представим себе две параллельные линии рельсов (рис. 1, а). На одной стоит неподвижная платформа Б, по другой движется платформа А. На обеих платформах стоят люди. В момент, когда обе платформы поравнялись, люди с платформы А перепрыгивают на платформу Б, а с Б на А. Что произойдет? Человек, перепрыгивающий с движущейся платформы на неподвижную, участвует в двух движениях: поперечном — с платформы на платформу, и продольном — вместе с платформой, от которой он отталкивается. После «приземления» он передаст неподвижной платформе продольный компонент импульса: она получит толчок вперед. Наоборот, человек, прыгающий с неподвижной платформы на движущуюся, подтормаживает ее. После перепрыгивания людей платформа А будет двигаться медленнее, чем до этого, а платформа Б придет в движение (рис. 1, б). Перепрыгивающие люди перенесли импульс.

Рис. 1.
Обратимся теперь к другой (тоже упрощенной) схеме. Представим себе две массы газа, разделенные плоскостью, сквозь которую молекулы газа могут свободно пролетать. В начальный момент одна масса неподвижна, другая движется вдоль плоскости раздела. Вследствие теплового движения молекулы будут перелетать из движущейся части в неподвижную, перенося свою порцию продольной составляющей импульса, и из неподвижной части в движущуюся, подтормаживая ее. Таков механизм вязкого трения в газах, заключающийся в переносе импульса в направлении, перпендикулярном направлению движения. (В жидкостях механизм переноса импульса несколько сложнее, так как он связан не только с перелетом молекул. В этом случае молекулы взаимодействуют значительно сильнее, чем в газе, и заметная доля импульса передается от молекулы к молекуле; но смысл вязкого трения как поперечной передачи импульса сохраняется и здесь.) Заметим, что, описывая движения газа, мы на самом деле говорили о двух очень разных движениях. Первое — это тепловое движение молекул. Второе — это движение газа как такового; часто его называют массовым движением или течением. В текущем газе молекулы перемещаются в самых разных направлениях, и лишь в среднем число молекул, имеющих скорость в направлении течения, превышает число молекул, движущихся в иные стороны.
Теперь рассмотрим молекулярные механизмы переноса тепла и вещества. Перенос тепла на молекулярном уровне называется теплопроводностью, а перенос вещества — диффузией.
Перенос тепла может осуществляться двояко: либо молекулы, обладающие более высокой энергией (которая соответствует более высокой температуре), перемещаются с места на место, перенося таким образом тепловую энергию, либо эти молекулы (назовем их «горячими»), сталкиваясь с другими, «холодными» молекулами, передают им свою энергию — в этом случае тепло передается как бы эстафетой. Перенос вещества диффузией обязательно связан с непосредственным перемещением молекул. Здесь эстафетный механизм, разумеется, невозможен — чтобы данное вещество переместилось, должны переместиться именно его молекулы. Мы уже говорили об аналогии между процессами переноса. На молекулярном уровне эта аналогия имеет четкое количественное выражение. Если в направлении х происходит перенос импульса, тепла или вещества, то поток q данной субстанции (количество импульса тепла, вещества, переносимое в единиц) времени через единицу площади поперечного сечения) определяется следующим} выражениями:
для
импульса
![]()
![]() (1)
(1)
для
тепла Q
![]() (2)
(2)
для
массы вещества m
![]() (3)
(3)
В
этих уравнениях символом
![]() —обозначены
производные соответствующих функций
по координате х;
—обозначены
производные соответствующих функций
по координате х;
![]() —
компонента
скорости, перпендикулярная оси х
(вспомним,
что перенос импульса происходит
в направлении, перпендикулярном
направлению движения); Тис
—
температура
и концентрация вещества;
и
μ, λ и D
—
коэффициенты, характеризующие
интенсивность процессов молекулярного
переноса, которые называют соответственно
коэффициентами динамической
вязкости, теплопроводности и диффузии.
—
компонента
скорости, перпендикулярная оси х
(вспомним,
что перенос импульса происходит
в направлении, перпендикулярном
направлению движения); Тис
—
температура
и концентрация вещества;
и
μ, λ и D
—
коэффициенты, характеризующие
интенсивность процессов молекулярного
переноса, которые называют соответственно
коэффициентами динамической
вязкости, теплопроводности и диффузии.
Уравнения(1) — (3) совершенно одинаковые, только буквенные обозначения различаются. Здесь хотелось бы отметить одну исключительно важную особенность математики, о которой прекрасно сказал великий французский математик А. Пуанкаре: «Математика — это искусство называть разные вещи одинаковыми именами». Что же дает это искусство в данном случае?
Если коэффициенты в уравнениях численно равны, то и решения окажутся одинаковыми. В ряде случаев картины распределения в пространстве скорости, температуры и концентрации оказываются идентичными. По полю температуры можно судить о поле концентраций; воздействуя на распределение скорости, мы одновременно воздействуем на распределение температур.
Глубина и точность аналогии между процессами переноса импульса, тепла и вещества определяются соответствием между коэффициентами.
Не вдаваясь в подробности теории вопроса, но тем не менее отметим, что сравнивать в действительности приходится не коэффициенты μ, λ и D, а величины ν= μ/Q, а= λ /(χ •ρ) и D (здесь ρ — плотность вещества, а χ — его теплоемкость).
В газах интенсивность всех трех типов молекулярного переноса почти одинакова. Поэтому та аналогия, о которой мы говорим, в газах проявляется наиболее полно, и коэффициенты ν , а и D редко различаются больше чем в 1,5 раза. При этом указанные соотношения выполняются тем лучше, чем меньше газ отличается от идеального.
В жидкостях различие уже намного заметнее, здесь обычно ν >а>>D. Это связано с тем, что перенос импульса и тепла в значительной мере происходит по «эстафетному» механизму, а перенос вещества — нет. Наконец, в твердом веществе коэффициент ν очень велик, коэффициент а значительно меньше, но тоже велик, а коэффициент D близок к нулю. Поэтому, например, внутри пористого тела перенос тепла и вещества, будут происходить существенно по разному: вещество будет диффундировать по порам, а тепло в основном передаваться по твердому материалу, образующему стенки пор.
Теперь перейдем к высшему уровню переноса — этот уровень определяется массовым движением (потоком) жидкостей, газов, твердых тел. Двигаясь, поток переносит с собой и импульс, и тепло, и вещество. Такой перенос называется конвективным (конвекцией).
Главная отличительная черта конвекции — большая мощность. Перемещение даже очень малых количеств жидкости или газа переносит много больше импульса, тепла и вещества, чем перемещение молекул под действием теплового движения. Это связано с тем, что молекулы очень малы. Перемещение даже малых масс жидкостей переносит огромное их количество, что и обусловливает большую мощность конвективного переноса.
Вспомним, что мы говорили о лимитирующих стадиях. Практически всюду, где параллельно перенос может осуществляться и конвекцией, и молекулярными механизмами, лимитирует конвективный перенос.
Для того чтобы рассчитать количество тепла, передаваемого в нашу квартиру, мы определим, сколько его несет поток горячей воды из бойлерной. При этом никому не придет в голову учитывать еще то тепло, которое будет в то же самое время передаваться по воде и по стенкам труб теплопроводностью: его количество ничтожно мало. Но обратим внимание вот на что. Тепло это было бы для нас абсолютно бесполезным, если бы в радиаторах оно не выходило из текущей воды наружу, в комнаты. Вот здесь есть важная тонкость. По трубам тепло движется в направлении потока (мы назвали это направление продольным), а переход из радиатора в комнату осуществляется поперек потока. Для дальнейшего важно разобраться в картине поперечного переноса, с которым связан не только выход тепла или вещества из потока наружу, но и характер самого потока.
СТРУКТУРА ПОТОКА И ПОПЕРЕЧНЫЙ ПЕРЕНОС
Начнем с упрощенной схемы. Представим себе дорогу, идущую под уклон. При этом вся дорога состоит из серии параллельных неглубоких желобков. По желобкам катятся шарики. По бокам дороги — крутые стенки, так что шарики вылететь с нее не могут. Пока уклон невелик, невелика и скорость, и каждый шарик катится по «своему» желобку. Все они движутся параллельно друг другу. Эта картина соответствует течению жидкости при малых скоростях: каждая частица жидкости движется параллельно другим. При этом обнаруживается одна особенность, которую не может передать наша модель «шарики в желобках». Непосредственно у стенки скорость жидкости равна нулю. Жидкость как бы «прилипает» к стенке. Этот факт — нулевая скорость у стенки — подтверждается бесчисленными измерениями, причем, как ни удивительно, падение скорости до нуля происходит независимо от материала стенки и от того, какая жидкость (или газ) течет.
Но раз это так, то в поперечном направлении существует градиент скорости, и в соответствии с уравнением (1) импульс будет переноситься от оси потока к стенке. Количественное рассмотрение этого переноса приводит к такому выводу.
В простейшем случае (поток в круглой трубе) скорость максимальна на оси трубы; здесь она в 2 раза больше, чем средняя скорость потока. Далее к стенкам скорость падает до нуля, и характер ее изменения описывается
параболой. При этом во всех точках, равноудаленных от оси, скорость одинакова. Частицы, находящиеся на равном расстоянии от оси, образуют цилиндрический слой, движущийся с постоянной скоростью. Слои, более близкие к стенкам, движутся медленнее, а более близкие к оси — быстрее. Такое течение называют ламинарным (от латинского lатiпа — пластина, слой).
В конце концов, импульс, переносимый от оси к стенке, передается этой стенке. При этом происходит рассеяние энергии. Таким образом, описываемая передача импульса может рассматриваться как трение, на преодоление которого нужно затрачивать энергию, т. е. речь идет о так называемом гидравлическом сопротивлении.
Теперь снова вернемся к шарикам, катящимся по желобкам. Пусть уклон дороги возрос, т. е. возросла и скорость. Тогда малейшая неровность одного из желобков приведет к тому, что шарик вылетит из него и перелетит в другой желобок. При этом он, вероятно, выбьет из этого желобка тот шарик, который там находился. Кроме того, и по этому желобку шарик прокатится недолго: любая помеха, неровность — и шарик опять срывается со своей траектории и перелетает в какой-то еще желобок. Через некоторое время картина будет такой: все шарики в беспорядке то движутся по каким-либо желобкам, то перелетают из одного желобка в другой.
Так и с жидкостью. Если начать увеличивать скорость, то в какой-то момент ламинарное течение станет неустойчивым. При любом возмущении («неровности желобка») частица сойдет со своего места в «строю» (в соответствующем цилиндрическом слое) и двинется куда-то в сторону, «расталкивая» те частицы, которые движутся там. Но ведь пространство трубы заполнено жидкостью, и если одна частица сместилась, то не на свободное место, а на позицию, которая ранее была занята. Таким образом, в беспорядочное, хаотическое движение окажутся вовлеченными многие частицы, а затем и весь поток.
Теперь картина потока иная. Жидкость по-прежнему движется вдоль трубы. Но на это "движение накладываются хаотические колебания (пульсации, флуктуации), происходящие в различных направлениях. Такой поток называют турбулентным (от латинского turbulentus — беспорядочный). Вы многократно сталкивались с этим явлением. Полоскание флага на ветру или ветер, который то и дело меняется перед переменой погоды,— вот два проявления турбулентности атмосферы. В общих чертах турбулентный поток «устроен» следующим образом. В текущей жидкости выделяются области, каждая из которых в данный момент движется приблизительно как единое целое. Приблизительно, потому что все время происходит взаимное перемещение более мелких частей этой области, причем в основном оно носит вихревой характер. Каждая такая область (частица) завихрена, по: этому их часто так и называют — вихри.
Типичный пример турбулентного вихря — атмосферный циклон, представляющий собой весьма внушительный вихрь: масса воздуха, переносимая в нем, может составлять миллиарды тонн; но и это явно не предел. Солнечные пятна — тоже вихри в турбулентной атмосфере Солнца, вихри, по сравнению с которыми Земля — как горошина рядом с речным водоворотом. И пожалуй, каждая галактика тоже может рассматриваться как вихрь в турбулентной Вселенной.
Вихрь в потоке (не будем говорить о галактиках) существует недолго. Турбулентные пульсации «растаскивают», разрывают его на более мелкие вихри, те, в свою очередь, распадаются на еще более мелкие. Но параллельно образуются новые большие вихри, и вся эта сложная картина многократно повторяется.
Может возникнуть вопрос: а разве в ламинарном потоке нет возмущений? Неужели там уж все так гладко? Возмущения, конечно, есть. Но вспомним нашу модель — дорогу с желобками. Пока скорость была невелика, возмущения гасили стенки желобка. В ламинарном потоке эту роль играет вязкость. «Возмутившаяся» частица отдает излишек импульса окружающим, те — дальше, и опять они движутся, «как все». Когда же скорость (и импульс) растет, сил вязкости уже не хватает, чтобы удержать частицу «в желобке». Возникает турбулентность. Поэтому условия перехода от ламинарного режима к турбулентному определяются соотношением между скоростью и вязкостью. Мерой этого соотношения является число Рейнольдса, или критерий Рейнольдса,— величина, названная в честь О. Рейнольдса, замечательного английского ученого, около 200 лет назад впервые изучившего переход из ламинарного режима течения в турбулентный. Число Рейнольдса Rе имеет вид:
![]() ,
,
где ω— скорость, d — размер, характеризующий данный поток, ρ и μ — соответственно плотность и вязкость жидкости. Если поток движется в трубе круглого сечения и d — ее диаметр, то при Rе<2320 устойчивым будет ламинарный режим, при Rе>10 000 — турбулентный, а в промежутке будет наблюдаться переменный режим. Правда, если трубу тщательно отполировать, чтобы исключить возмущения, то удается продлить область ламинарности до значительно больших значений Rе, но малейшая встряска — и наступает турбулентный режим.
Важнейшая для химической технологии особенность турбулентного потока — это характер процессов переноса в нем. Представим себе ламинарный поток на грани перехода в турбулентный. Пусть в результате возмущения одна из частиц, движущаяся вдоль оси трубы (и поэтому имеющая максимальную скорость), начинает смещаться к стенке. При этом она переносит в периферийную зону потока свою большую продольную составляющую импульса. Вдобавок, как сказано выше, она вытеснит более медленную частицу, которая будет смещаться ей навстречу, перенося свой малый импульс и уменьшая скорость осевой части потока. Скорости будут выравниваться по сечению.
Ясно, что описанная картина выравнивания скоростей аналогична картине переноса импульса механизмом вязкости. Разница лишь в том, что здесь перенос — конвективный (переносят импульс не молекулы, а частицы, состоящие из огромного числа молекул), и поэтому его мощность неизмеримо выше. Если выразить закономерности переноса уравнением (1), то коэффициент окажется очень большим. Теперь это уже не молекулярная вязкость μ, а турбулентная вязкость μт, обусловленная турбулентными пульсациями. В соответствии с большой величиной (μт производная в правой части уравнения (1) должна быть мала (иначе произведение дало бы нереальное значение потока ρтω)- Это значит, что наклон кривой, изображающей распределение скорости по поперечному сечению, мал. Это уже не парабола, а очень плоская кривая, так как перемешивание частиц выравнивает скорости.
Наряду с турбулентной вязкостью можно говорить о турбулентной теплопроводности и турбулентной диффузии. Турбулентность интенсивно перемешивает жидкость в поперечном направлении, перенося тепло и вещество, выравнивая температуру и концентрации всех веществ. Именно поэтому для химической технологии типичны турбулентные потоки, а турбулизация — один из важных приемов интенсификации процессов.

Рис.2 Схема потока направленного на стенку
Но картина турбулентного потока пока не полна. Необходимо рассмотреть еще одну важную его особенность: поведение потока у стенок. Здесь определяющую роль играют два обстоятельства. Во-первых, у самой стенки скорость и в турбулентном потоке тоже падает до нуля; во-вторых, если направить поток прямо на поверхность твердого тела (например, пустить из сопла струю воздуха, как показано на рис. 2), то он не дойдет до поверхности, а «расплющится» и начнет обтекать тело. То же самое происходит с турбулентными пульсациями. Они не способны дойти до самой стенки и вблизи от стенки поворачивают и начинают двигаться вдоль нее. В результате турбулентный перенос затухает. В непосредственной близости от стенки образуется тонкий (так называемый пограничный) слой, где перенос осуществляется в основном за счет молекулярного механизма*.(* Описанная здесь картина упрощена. Сам пограничный слой обладает сложной структурой, и молекулярные механизмы лимитируют процесс только в части его — подслое. Но для нашего изложения это несущественно) Основную часть потока, за вычетом пограничного слоя, обычно называют ядром.
Перенос импульса в пограничном слое осуществляется молекулярной вязкостью. Так как μ<<μT, градиент скорости здесь велик: скорость резко падает от большого значения, существующего в ядре, до нуля у стенки.
То же самое происходит с переносом тепла и вещества. В ядре потока температура и концентрации выровнены турбулентным перемешиванием, а в пограничном слое происходит резкое изменение этих величин. Дальше мы в основном будем говорить о переносе вещества, который наиболее специфичен для химико-технологических процессов. Рассмотрим поток, в котором движется раствор какого-либо вещества, причем на стенках это вещество расходуется (например, кристаллизуется или вступает в реакции). Тогда профиль концентраций будет таким, как изображено на рис. 3.
Точное описание изображенной на рисунке картины потребовало бы сложного количественного анализа механизмов переноса в турбулентном потоке и в пограничном слое. К сожалению, строгая теория турбулентного потока до сих пор не создана, поэтому при анализе процессов пользуются теми или иными упрощенными моделями.

Разберем простейшую модель. Ее предложил выдающийся немецкий физико-химик В. Нернст. Нернст, рассматривая процессы растворения твердых веществ и изучая скорость растворения, пришел к выводу, что процесс можно описать следующей схемой. В ядре потока концентрация растворяемого вещества распределена равномерно благодаря интенсивному перемешиванию. Но у поверхности твердого тела существует как бы неподвижная пленка, через которую растворяемое вещество диффундирует в ядро. Пользуясь современными представлениями, естественно сопоставить эту пленку с пограничным слоем. Разумеется, жидкость в нем движется, но для схемы Нернста это не важно. Важно, что перенос здесь происходит на молекулярном уровне. Правда, в действительности все гораздо сложнее. Если воспользоваться схемой Нернста (пленочной моделью), то распределение, показанное на рис. 3, преобразуется в картину, изображенную на рис. 4; в ней «срезаны» все закругления, в ядре — полная равномерность, пленка четко отграничена от ядра. В реальном же потоке ядро постепенно переходит в пограничный слой, причем как толщина слоя, так и характер перехода зависят от степени развития турбулентности. Но для качественного описания пленочная модель оказалась настолько удобной, что ею широко пользуются до сих пор.
Рассмотрим
в рамках пленочной модели
уравнение (3).
Если в пленке не идет
реакция, то вещество там не расходуется
и не образуется, поэтому поток
ц
не
меняется с расстоянием: сколько
вещества вошло в пленку с одной стороны,
столько же выйдет с другой. Но
тогда правая часть уравнения постоянна,
и в этом случае производная![]() просто
равна разности концентраций с разных
сторон пленки, деленной на толщину
пленки δ: qm=D(c2-c1)/δ.
Это уравнение легко привести к виду:
просто
равна разности концентраций с разных
сторон пленки, деленной на толщину
пленки δ: qm=D(c2-c1)/δ.
Это уравнение легко привести к виду:
qm=β∆c, (4)
где ∆с — разность концентраций между ядром потока и стенкой (ее обычно называют движущей силой массоотдачи); β — коэффициент массоотдачи. Уравнение (4) — основная формула, по которой рассчитывают процессы переноса вещества; в нем
β = D /δ (5)
Так же получается уравнение переноса тепла (а — коэффициент теплоотдачи) :
дя=аАТ. (6)
Влияние потока отражается на величинах β и а, которые определяются толщиной пограничного слоя δ. Чем быстрее поток, чем больше число Рейнольдса, тем сильнее развита турбулентность турбулентные пульсации подходят ближе к поверхности, т. е. δ уменьшается, β и а растут.
Обратите внимание на следующее В ядре потока действуют и конвекция и молекулярные механизмы. Но когда мы обсуждали выравнивание концентраций (скоростей, температур) в ядре, мы говорили только о турбулентном перемешивании, о конвекции. Это потому, что оба механизма здесь действуют параллельно и лимитирует более мощная конвекция
Если же рассмотреть поперечный перенос в целом, то процесс распадается на две последовательные стадии: вначале перенос в ядре, затем — через пограничный слой (если перенос идет от стенки, то пограничный слой — вначале, но это не принципиально). Раз стадии последовательны, то лимитирует медленная, т. е. перенос в пограничном слое. И воздействовать надо именно на этот слой — только так можно существенно ускорить процесс.
Как же это делается? Главный способ интенсификации — увеличение скорости потока. Почему мы мерзнем на ветру? Потому, что через тонкий пограничный слой интенсивно теряется тепло На том же ветру быстро сохнет белье, ибо одновременно растут скорости отдачи и тепла, и влаги.
В химической технологии есть две большие группы процессов, по существу сводящихся к переносу. Это теплообменные процессы (нагревание или охлаждение) и массообменные процессы. Набор массообменных процессов чрезвычайно широк. Это поглощение веществ из газа жидкостью (абсорбция); поглощение из газов или жидкостей поверхностью твердых тел (адсорбция); перегонка жидкостей; выделение веществ из растворов путем растворения в другой жидкости (экстракция). Сюда же относятся растворение, кристаллизация, сушка.
В этих процессах почти всегда увеличение скорости потока приводит к интенсификации переноса вещества. В большинстве современных типов массообменных и теплообменных аппаратов создаются высокие скорости потоков. Но такая интенсификация даром не дается. Чем больше скорость, тем выше гидравлическое сопротивление, тем больше потери энергии. Значительные усилия конструкторов направляются на создание таких аппаратов, где сопротивление снижено.
В некоторых случаях интенсифицировать поперечный перенос тепла и вещества удается не за счет повышения скорости, а путем создания особой конфигурации поверхности, вдоль которой движется поток.
ПЕРЕНОС ВЕЩЕСТВА И ХИМИЧЕСКАЯ РЕАКЦИЯ
Любая химическая реакция приводит к тому, что вещество либо расходуется, либо образуется. Поэтому нужно подводить реагенты в зону реакции и отводить из нее образующиеся вещества (продукты). В этом одна из главных функций потока. Если реакция гомогенная, т. е. проходит в объеме текущей жидкости, то, как правило, поток справляется со своей ролью.
Но далеко не все реакции проходят в объеме одной движущейся жидкости (или газа). В технологии чаще встречаются реакции гетерогенные. Гетерогенные реакции имеют несколько вариантов, важнейшие из которых два. Пример первого варианта — поглощение диоксида углерода щелочным раствором. В этом случае реакция проходит в жидкости, в ней. же с самого начала находится один из реагентов (щелочь).. Другой же реагент (СО2) должен прежде чем вступить в реакцию, перейти из газа в жидкость (из одной фазы в другую). При этом молекулы СО2 дважды проходят пограничные слои: в газе у границы с жидкостью и в жидкости у границы с газом. Пограничные слои возникают на границе фаз — именно наличие этой границы и определяет специфику гетерогенного процесса.
Второй вариант гетерогенных процессов не менее важен. Это случай, когда движется только одна фаза (чаще всего газ), а вторая фаза твердая. Но реакция происходит не в объеме газа, а на границе — на поверхности твердого тела. Прежде всего так идут гетерогенно-каталитические реакции, протекающие на поверхности твердого катализатора. Молекулы реагентов, прежде чем вступить в реакцию, должны продиффундировать через пограничный слой у твердой поверхности. Бывают и некаталитические реакции того же типа, например, горение твердого топлива, когда реакция идет на границе топлива с воздухом.
Общая черта гетерогенных реакций заключается в необходимости подвода вещества в зону реакции через пограничный слой. Если рассмотреть путь отдельной молекулы, вступающей в реакцию, то он складывается из ряда последовательных стадий: диффузия к поверхности (или из одной фазы в другую), реакция, затем часто и обратная диффузия продуктов реакции. Мы уже не в первый раз сталкиваемся с такой ситуацией, и поэтому становится ясным, что общая затрата времени на все стадии будет больше, чем на какую-либо одну. Значит, скорость суммарного процесса окажется меньше скорости одной стадии. Говорят: диффузия тормозит химическую реакцию, и все явление в целом называют диффузионным торможением. Ясно должно быть и еще одно. Если одна из стадий много медленнее остальных, она станет лимитировать весь процесс.
Как это происходит, разберем на простом примере необратимой реакции, проходящей на поверхности катализатора. При этом поверхность омывается потоком газа. Одно из современных направлений химии, изучающего скорость химических реакций в условиях, когда на нее влияют процессы переноса тепла и вещества. Это направление называют макрокинетикой.
Итак, вещество А превращается в вещество В по реакции А—>-В. Реакция идет на поверхности катализатора. Скорость реакции ω пропорциональна концентрации сА реагента А:
ω =кСА (7)
Коэффициент пропорциональности к называют константой скорости реакции. По-видимому, в формуле (7) есть все, что нужно для расчета скорости. Но эта видимость обманчива. Концентрация СА, определяющая скорость,— это концентрация у самой поверхности. Обозначим ее сп. Мы не имеем возможности непосредственно измерить эту концентрацию: слишком тонок этот приповерхностный слой, толщина которого порядка размера молекулы. Измерить мы можем лишь концентрацию вещества А в ядре потока ся; но она не равна сп, и задача состоит в том, чтобы их связать.
Рассмотрим решение этой задачи так. В уравнениях (7) и (4). Что такое ω? По определению, скорость гетерогенной реакции — это количество вещества, реагирующее в единицу времени на единице поверхности. А поток gт — количество вещества, подводимое в единицу времени к единице поверхности. Но если реакция подходит стационарно (а это главный случай, наиболее важный для анализа), то
ω = gт (8)
Действительно, если ω>gт, то откуда берется то вещество, которое реагирует, но не подводится к поверхности? А если ω<gт , то куда девается избыток подводимого вещества?
Но из соотношения (8) следует равенство правых частей формул (7) и (4), т. е. ксп=β(ся—сп), откуда сп= βся/(к+ β). Подставляя это выражение в уравнение (7), получим:
![]() (9)
(9)
Уравнение (9) почти полностью аналогично уравнению (7). Только вместо неизвестной сп здесь известная величина ся, а вместо коэффициента к, отражающего химизм реакции, величина к', которая учитывает как скорость реакции, так и перенос вещества. Легко также получить следующее соотношение: к′= кβ/(к+β) или
к′=1/β+1/к. (10)
Формулу (10) можно понимать так. Левая часть — общее сопротивление переносу, которое складывается из диффузионного сопротивления 1/β и кинетического сопротивления 1/к. Если β>>к (быстрая диффузия, медленная реакция), то из (10) следует: k'≈k ω≈kСя. В этом случае лимитирует кинетика (медленная химическая стадия); говорят, что реакция проходит в кинетической области. Наоборот, если β<<к (реакция много быстрее диффузии), то к′≈ β и ω≈ β Ся , т. е. лимитирует диффузия; реакция проходит в диффузионной области. Наконец, если к ≈ β , то лимитирующей стадии нет, реакция проходит в промежуточной области.
Что это значит практически? Для этого нужно учесть, что сильнее всего влияет на к и на β. Величина к наиболее сильно зависит от температуры. С повышением температуры на 10° обычно наблюдается рост к в 2—3 раза. В то же время к не зависит от состояния потока: турбулентный он или ламинарный, быстрый или медленный, все это на химизм реакции не влияет.
Наоборот, β сильно зависит от скорости потока (чем сильнее выражена турбулентность, тем тоньше пограничный слой) и довольно слабо зависит от температуры. Если движущаяся фаза — газ (так бывает чаще всего), то зависимость (β от температуры почти совсем отсутствует. Поэтому кинетическая область наиболее характерна для низких температур, а диффузионная — для высоких. Повышение скорости газа способствует переходу в кинетическую область. Подробный анализ уравнения (10) показывает, что зависимость ω от температуры Т имеет характер, изображенный на рис. 5. В нижнем левом углу — кинетическая область. При низких температурах скорость реакции мала, но зато быстро растет с ростом температуры. При высоких температурах рост скорости существенно замедляется. Теперь константа скорости реакций велика и продолжает расти, но мы этого не замечаем: лимитирует уже диффузия, которая с ростом температуры почти не ускоряется.
Если мы хотим ускорить процесс, проходящий в кинетической области, нужно прежде всего повысить температуру; если же область диффузионная, то нужно думать о турбулизации потока, повышении его скорости. Примером может служить процесс окисления древесины. Это очень сложный процесс и в действительности не полностью гетерогенный (горение идет не только на поверхности, но и в газовой фазе, куда выделяются продукты сухой перегонки). Но в основном реакция идет все же на поверхности. Этот процесс может проходить в двух основных вариантах. Первый — медленное окисление при сравнительно низких температурах под действием микроорганизмов — гниение. Оно проходит в кинетической области. Второй — быстрый, высокотемпературный — горение, проходящее в диффузионной области..
Проверим, как выведенные нами закономерности соблюдаются в этом случае. Скорость гниения (при достаточной влажности) зависит в первую очередь от температуры: бревно, которое на Земле Франца-Иосифа пролежит почти целым десятки лет, в джунглях Лаоса сгниет за год. В то же время гниение происходит почти с одинаковой скоростью и в штиль, и в шторм. А вот с горением — дело совсем иное. Известно,- что часто, чтобы заставить дрова разгореться, на них дуют. Задумывались ли вы, что это значит с точки зрения химии? Дуем мы воздухом из легких, содержащим не 21 % кислорода, а всего около 16 %. Скорость реакции должна бы уменьшиться! Кроме того, дуя, мы подводим в зону реакции холодный воздух: температура снижается, константа скорости реакции уменьшается. А дрова, казалось бы, вопреки химии, разгораются. Почему? Да потому, то когда мы дуем, мы утончаем пограничный слой и облегчаем диффузию кислорода. Для реакции, идущей в диффузионной области, это оказывается главным.

Рис. 4. Зависимость скорости реакции от температуры
ПРОДОЛЬНОЕ СМЕШЕНИЕ И РАСПРЕДЕЛЕНИЕ ВРЕМЕНИ ПРЕБЫВАНИЯ
Теперь перейдем к рассмотрению другого направления смешения — продольного, обусловленного целым рядом обстоятельств. В разных точках поперечного сечения аппарата скорости могут быть разными: либо из-за влияния стенок, как в ламинарном потоке, либо, например, из-за неравномерно распределенных загрязнений. Продольное смешение характерно и для турбулентного потока, где пульсации скорости приводят к взаимному перемешиванию впереди идущих и последующих частиц. Правда, обычно относительная интенсивность перемешивания в турбулентном потоке меньше, чем в ламинарном, так как сказывается выравнивание скоростей по сечению, о котором мы говорили при описании турбулентного потока.
Наконец, сильнейшее продольное перемешивание возникает, когда в аппарате происходят процессы, связанные с мощными циркуляционными потоками. Так бывает, если в аппарате вращается мешалка. Тот же самый эффект производит барботаж — пробулькивание пузырей газа через жидкость, а также некоторые другие процессы взаимного движения двух фаз (жидкости в жидкости; газа или жидкости, которые проходят через слой твердых частиц, перемешивая их).
Важное следствие продольного смешения — неравномерность времени пребывания. Если две частицы вошли в аппарат одна за другой, а затем вторая нагнала первую, перемешалась с ней и вышли они из аппарата вместе, то это значит, что первая частица пробыла в аппарате большее время, чем вторая. В результате каждая частица имеет свое, отличное от большинства других время пребывания.
В таком случае поток можно охарактеризовать двояко. Одна характеристика описывает различия во времени пребывания разных частиц. Это довольно сложная характеристика, и о ней мы поговорим позже. Другая — усредненная характеристика потока: среднее время пребывания. Среднее время τ легко найти, поскольку оно равно отношению объема аппарата Vр (или, точнее, той его части, через которую движется поток) к расходу жидкости Vс (т. е. объему жидкости, протекающему через аппарат в единицу времени):
τ= Vр / Vс . (11)
Величина τ характеризует поведение частиц в среднем. Как почти всякая усредненная характеристика, она, с одной стороны, очень проста, но, с другой — хорошо известно, что часто такие характеристики недостаточны.
Тем не менее, в каждом конкретном случае нужен анализ. Есть ведь и такие задачи, когда важно именно среднее. Если мы будем рассчитывать, какая масса сыпучего материала поместится в вагоне объемом 50 м3, для нас важна именно средняя плотность материала, а то, как эта плотность варьирует от точки к точке, менее существенно. Так, может быть, в случае потока такое же положение? Одни частицы будут проходить через аппарат за время, меньшее чем τ, и в них реакция пройдет недостаточно полно. Но зато другие частицы задержатся в аппарате (такие найдутся обязательно, так как среднее должно быть равно τ, а для этого нужны слагаемые и меньшие, и большие величины τ). В этих частицах реакция пройдет полнее, чем за среднее время. На выходе те и другие частицы перемешаются, и степень превращения исходных веществ усреднится. Не окажется ли так, что эта средняя степень превращения такая же, как если бы все частицы реагировали одинаковое время τ
Оказывается, в подавляющем большинстве случаев степень превращения зависит не только от τ, но и от того, из каких конкретных значений времени пребывания складывается это среднее. Это обусловлено следующей особенностью большинства химических реакций: по мере протекания реакции ее скорость падает, так как остается все меньше и меньше исходного вещества. В результате степень превращения окажется тем выше, чем равномернее время пребывания, чем ближе к среднему конкретные его значения для разных частиц.
Эту закономерность можно проиллюстрировать следующим примером. Представим себе цех, в котором работают 100 рабочих. Режим работы: 8 часов в день в одну смену. Однажды рабочие решили, что им удобнее работать иначе: половина будет работать не 8, а 4 часа, и у них освободится большая часть дня для личных дел. Но зато другая половина будет работать 12 часов — 8 за себя и 4 за тех, кто ушел раньше. Потом они станут меняться, так что все будет справедливо.
Есть и другая сторона вопроса: работа по 12 часов вредна для здоровья. Но мы обсуждать это не станем, а попытаемся лишь оценить вот что: если цех начнет работать по новому режиму, возрастет или нет производительность труда? Легко понять, что производительность уменьшится. Действительно, 50 рабочих будут уходить с работы через 4 часа не уставшие, полные сил, а 50 других будут за них работать, но работать после 8-часового рабочего дня, когда они уже устали и их работоспособность упала.
Точно то же происходит, если в потоке, в котором проходит реакция, время пребывания разных частиц неодинаково. С теми частицами, которые имеют малое время пребывания, из аппарата выходит много непрореагировавшего вещества. В частицах, которые находились в зоне реакции больше среднего времени, степень превращения велика; но выигрыш из-за большого времени пребывания меньше, чем проигрыш из-за недостаточного времени, поскольку скорость реакции уже упала и за это избыточное время реагирует мало вещества.
В идеальном вытеснении равномерно распределены скорости и соответственно время пребывания. Поток движется не как жидкость, а как твердый поршень, вдвигаемый в аппарат: все частицы вместе. Иногда его так и называют — поршневой поток. Но равномерности распределения концентраций в этом потоке нет. Например, если некоторое вещество А превращается в вещество R, то у входа будет много А и мало В, а затем концентрация А станет убывать, а R — возрастать.
В идеальном смешении, наоборот, равномерно распределены концентрации. В нем и поперечное, и продольное смешение полное. А как скорости частиц и время пребывания? О скоростях здесь говорить трудно, поскольку вряд ли можно представить себе идеально перемешиваемую жидкость. Во всяком случае ясно, что хорошее смешение возможно лишь при очень сложной картине потока: с многократной циркуляцией, с развитой турбулентностью. Что же касается времени пребывания, то оно разное у разных частиц.
И если для идеального вытеснения формула (11) определяет время пребывания любой из частиц, то для идеального смешения — это лишь среднее время пребывания; та или иная конкретная частица может находиться в аппарате совсем иное время.
В идеальном вытеснении частицы движутся, как солдаты на параде: каждый равняется на всех, никто не обгоняет и не отстает, и если один прошел площадь за какое-то время, то и любой другой затратит на этот путь то же самое время. Идеальное смещение подобно народному гулянию на той же площади: каждый описывает замысловатую траекторию; кто-то может войти на площадь и тут же уйти, а кто-то будет бродить по ней часами.
Встречаются ли на практике потоки, достаточно близкие к нашим схемам? Да, и довольно часто. Наиболее близок к идеальному вытеснению поток в аппаратах типа труб (или колонн). Правда, если поток ламинарен, то параболический профиль скоростей не позволяет рассматривать его как близкий к идеальному. Но при росте турбулентности скорости выравниваются, и часто такой по ток мы можем считать «почти идеальным». Особенно же близок к идеальному поток, если аппарат заполнен какими-либо неподвижными твердыми частицами, между которыми проходит (фильтруется) жидкость. Это довольно часто встречающийся случай: частицы могут быть, например, гранулами катализатора или насадкой (телами, по которым растекается жидкость, чтобы увеличилась поверхность ее взаимодействия с газом). Слой частиц сильно выравнивает поток жидкости, и вытеснение в таком потоке очень близко к идеальному.
Аппараты, в которых поток близок к идеальному смешению, пожалуй, еще более разнообразны. Прежде всего, это резервуары с мешалками, через которые проходит поток жидкости. Но интенсивно перемешивать жидкость может не только мешалка. Один из лучших способов перемешивания — барботаж. В то же время барботаж создает большую поверхность, на которой газ (или пар) может взаимодействовать с жидкостью, так что барботажные аппараты весьма широко распространены в химической технологии. Движение жидкости через барботажный слой — часто почти идеальное смешение; газ движется по-иному, и описание потока для него будет другим. Далее, очень важный случай, когда осуществляется интенсивное перемешивание во всех направлениях,— это псевдоожижение. Оно возникает тогда, когда сквозь слой твердых частиц снизу подается поток газа (реже — жидкости). При этом в определенном диапазоне скоростей частицы приходят в такое движение, когда они и не неподвижны, и не уносятся потоком, а циркулируют в объеме слоя, который напоминает по виду кипящую жидкость; такой слой называют псевдо-ожиженным или кипящим. Опять же движение газа в этом слое далеко от идеального смешения (и от идеального вытеснения часто тоже); но движение твердых частиц — практически идеальное смешение.
Зададимся вопросом: как различия между идеальными потоками сказываются на протекающих в них химических реакциях? По сути дела, это вопрос и о том, стоит ли заниматься продольным перемешиванием. Если разница между идеальным вытеснением и идеальным смешением невелика, то скорее всего остальные случаи тоже не так уж сильно отличаются, и заниматься этим не очень интересно. Иное дело, если разница велика. Тогда нужно внимательно анализировать реальные потоки, выяснять, насколько они близки к идеальным, и, по-видимому, разрабатывать способы описания не только идеальных, но и реальных потоков.
Сопоставление идеальных потоков начнем с качественного анализа. Пусть мы проводим некоторую реакцию А—> R. Естественно, наша цель — провести реакцию как можно полнее. Полнота проведения реакции характеризуется степенью превращения Х:
![]() (12)
(12)
Здесь GA,0 и GA,K -— количество вещества А в исходной жидкости и в жидкости после реакции. Где будет выше X — в аппарате вытеснения или смешения, если среднее время пребывания одинаково?
Начнем наш анализ с обсуждения влияния равномерности (или неравномерности) распределения времени пребывания. Такой анализ мы уже провели (разбирая режимы работы 100 рабочих в цехе), пришли к выводу, что равномерное распределение времени благоприятствует полноте протекания реакции, а следовательно, в аппарате идеального смешения степень превращения должна оказаться выше.
Попробуем подойти к этому вопросу с другой стороны. Выясним, как влияет на ход реакции выравнивание концентраций, характеризующее поток идеального смешения. При этом сначала обратим внимание на следующее. Мы говорили, что в идеальном смешении концентрация любого вещества одна и та же во всех точках внутри аппарата. А что делается на входе потока и на его выходе? Для нашего анализа очень важно понять, что на выходе концентрации всех веществ — такие же, как в объеме, т. е. состав жидкости на выходе и внутри аппарата один и тот же. А вот на входе концентрации (и температура) претерпевают скачок, поскольку входящая жидкость мгновенно смешивается с содержимым аппарата.
Изобразим графически изменение концентрации реагента А по длине аппарата (рис. 6). Пусть начальная концентрация СА,0 и конечная СА,К заданы. На оси абсцисс отложены значения продольной кординаты /, причем l=0 в начале аппарата, l=L в его конце. Часть графика левее l=0 соответствует трубе, вводящей смесь в аппарат; правее l=L — трубе, отводящей прореагировавшую смесь.
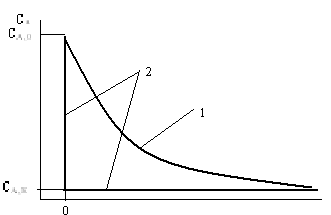
Рис. 5. Распределение концентрации по длине реактора: 1 - аппарат идеального вытеснения; 2- аппарат смешения.
Для случая потока идеального вытеснения изменение концентрации по длине можно изобразить кривой 1: жидкость движется по аппарату, идет реакция, CА уменьшается. В потоке идеального смешения (ломаная 2) концентрация падает от CА,0 до CА,K сразу, скачком, у входа. И дальше до выхода она неизменна.
Теперь сравним значения CА в каких-то поперечных сечениях обоих аппаратов. Какое бы сечение (кроме самого конца) мы ни взяли, концентрация CА в аппарате вытеснения окажется выше, чем в аппарате смешения. А скорость реакции почти всегда тем больше, чем выше CА. Поэтому в любом сечении потока вытеснения скорость реакции будет выше, чем в соответствующем сечении потока смешения, и, следовательно, чтобы степень превращения в этих аппаратах была одинаковой, объем аппарата смешения должен быть больше, при равных же объемах величина X в аппарате смешения окажется ниже.
Но все приведенные рассуждения еще недостаточны. Да, действительно, при равных объемах данная реакция полнее пройдет в аппарате вытеснения. Но насколько? Если разница невелика, то не окажутся ли более вескими иные соображения? Например, такое. Благодаря интенсивному перемешиванию в аппарате смешения выше коэффициенты тепло- и массоотдачи, поэтому отвод тепла в таком аппарате может быть организован проще. Для более основательного суждения одних качественных оценок мало. Нужны оценки количественные, для чего необходимо привлечь математическое списание протекания реакции в том и другом потоке.
Как и при анализе реакции на поверхности катализатора, будем считать, что скорость реакции превращения А в В пропорциональна концентрации реагента А:
![]() (13)
(13)
Отличие от формулы (7) незаметно. Но оно есть. Скорость реакции, проходящей на поверхности катализатора, определяется как количество реагента, превращающееся в единицу времени на единице поверхности. Здесь же реакция идет в объеме, и величина ω в уравнении (13) относится не к единице поверхности, а к единице объема. Заметим, что такую реакцию, скорость которой пропорциональна концентрации реагента в 1-й степени, называют реакцией первого порядка. Это во многих отношениях простейший тип реакций; но основные выводы, которые получаются при ее анализе, можно распространить на весьма широкий круг реакций.
Итак, реакция со скоростью, описываемой формулой (13), проходит в по токе. В потоке идеального вытеснения протекающая реакция будет приводить к уменьшению концентрации вещества А (и, следовательно, росту концентрации R), как это показано на рис. 6. Изменение CА -можно описать дифференциальным уравнением
![]() (14)
(14)
Здесь в левой части — производная от концентрации; знак «минус» справа обусловлен тем, что СА убывает во времени. Решение уравнения (14) хорошо известно в математике:
![]() (15)
(15)
Для конца аппарата получаем
![]() (16)
(16)
где τ, находимое по формуле (11), в аппарате идеального вытеснения — время пребывания частиц протекающей жидкости. График уравнения (15) и есть верхняя кривая на рис. 6.
Описание реакции в аппарате идеального смешения приходится строить совсем по-иному. Для этого аппарата записать уравнение в виде формулы (14) нельзя, поскольку нет единого времени, определяющего изменение концентрации для любой частицы. Перемешивание ведет к тому, что если мы будем двигаться от входа к выходу, никакого изменения СА не происходит. Но зато скорость реакции во всех точках объема одинакова, а это позволяет очень просто записать для такого аппарата уравнение материального баланса.
Материальный баланс — один из важнейших методов описания и анализа химико-технологических процессов. Он выражает закон сохранения вещества; уравнение баланса соответствует утверждению: приход вещества равен расходу вещества. При описании химических реакций в потоке обычно записывают отдельное уравнение баланса для каждого из веществ.
Изобразим материальные потоки в нашем аппарате (рис. 7). В аппарат объема VР входит жидкость в количестве VС (в единицах м3/с) и выходит такое же количество (изменение объема жидкости в процессе реакции мы для простоты рассматривать не будем; часто оно бывает пренебрежимо малым). На входе СА=СА,0, СR=0; на выходе концентрации СА и СR :— такие же, как в любой точке объема аппарата. В аппарате проходит реакция А—>R, скорость которой определяется уравнением (13).
Составим баланс за единицу времени для вещества А. Приход А — это то количество, которое внесет в аппарат входящий поток; он равен
VС СА,0. Расход же состоит из двух слагаемых. Во-первых, та часть А, которая не успела прореагировать, уходит с потоком наружу; ее количество составляет VС СА. Во-вторых, А расходуется в реакции; этот расход равен произведению скорости реакции на объем аппарата VР или, с учетом формулы (13), VРСА. Так как приход равен расходу, то
VС СА,0 = VС СА + VРСА (17)

Рис. 7. Схема материальных потоков в аппарате смешения
Чтобы
легче было сопоставлять уравнения
(16) и (17),
поделим обе части последнего
на V
и учтем, что VР
/ VС
=τ
, а СА=СА,К
:![]() ,
откуда
,
откуда
![]() .
(18)
.
(18)
Для сравнения обоих типов потока нетрудно сделать следующий расчет. Пусть нам нужно обеспечить в аппарате некоторую степень превращения %. Из уравнений (16) и (18) с учетом (11) легко вывести необходимый объем аппаратов вытеснения
Vвыт= VС ln(1-X)/k (19)
и смешения Vcм=X Vc/[k(1-X)] (20)
А теперь проведем такое сопоставление. Заданную степень превращения можно получить и в аппарате вытеснения объемом Vвыт, и в аппарате смешения объемом Vсм Естественно, что при разных значениях Х объемы и их соотношение будут неодинаковыми. Посмотрим, как меняется отношение Vсм/ Vвыт для различных Х:
-
X
0,5
0,7
0,9
0,95
0,99
0,999
Vсм/ Vвыт
1,5
2
4
6
22
140
Вот теперь можно сделать более обоснованные выводы. Уже из наших качественных рассуждений следует, что требуемый объем аппарата вытеснения будет меньше. Но во сколько раз меньше — это зависит от того, какой степени превращения нужно добиться. Если требуемая степень невысока, то различие в объемах идеальных потоков хотя и ощутимо, но не столь велико, чтобы целиком и полностью определять выбор типа аппарата. Может даже оказаться, что более выгодным будет аппарат, впятеро больший по объему, но зато устроенный проще и позволяющий легче отводить тепло реакции. Однако если требуется степень превращения порядка 0,99 и выше, то объем аппарата смешения становится нереально большим, особенно при возрастании количества перерабатываемой жидкости (множитель V в уравнении (20). Поэтому вопросы продольного перемешивания стали особенно важными на современном этапе развития химической технологии.
Нынешнее химическое производство разительно отличается от прежнего. Важнейшими объектами современной химической технологии стали агрегаты большой единичной мощности, каждый из которых выпускает продукции больше, чем химкомбинат 50-х годов. Эти агрегаты не могли бы работать, если бы при их проектировании самым тщательным образом не прорабатывались все особенности движения потоков в аппарате.
Необходимо отметить еще следующее обстоятельство. Степень превращения исходных реагентов — не единственная характеристика реакции, интересующая технолога. Не менее важно, во что превратятся реагенты. Очень часто наряду с той реакцией, которая нам нужна (целевая), идут и другие, побочные процессы, сопровождающиеся образованием лишних, а то и просто вредных продуктов. Для того чтобы определить, в какой мере реакция прошла в нужном нам направлении, рассчитывается еще одна (кроме степени превращения) важная характеристика — селективность. Не вдаваясь в математические детали расчета, отметим лишь, что селективность определяет, сколько получилось целевого продукта по отношению к сумме всех получившихся. Селективность также может сильно зависеть от степени продольного перемешивания, но эта зависимость окажется неодинаковой для разных типов реакций.

Рис. 8. Изменение концентрации вещества во времени
Вот случай последовательной побочной реакции: исходный реагент превращается в целевой продукт, но тот, в свою очередь, может вступать в реакцию, давая уже побочные продукты. Например, мы хотим получить хлористый метил СН3С1 при реакции метана с хлором. Но образующийся хлористый метил также может хлорироваться, давая СН2С12, который в данном случае не нужен.
Пусть реакция протекает по схеме: А→ R → S где R — целевое вещество. Концентрации веществ во времени будут изменяться так, как показано на рис. 8. Исходное вещество все время расходуется; для продукта R сначала превалирует накопление, но потом вещества R становится все меньше, и под конец оно целиком перейдет в S. Если проводить этот процесс в аппарате вытеснения, можно подобрать время реакции таким образом, чтобы концентрация R оказалась максимальной, либо даже взять еще меньшее время пребывания, и хотя концентрация R в этом случае будет ниже максимальной, зато концентрация S снизится еще сильнее, т. е. селективность возрастет. А непрореагировавшее вещество А можно отделить от реакционной смеси и вернуть в начало процесса. Этот прием — циркуляцию реагента — применяют почти всегда, если почему-либо не получается высокая степень превращения.
Если ту же реакцию проводить в аппарате смешения, то мы столкнемся со следующим обстоятельством. В этом потоке, как уже говорилось, присутствуют частицы с малым временем пребывания. В них окажется сниженной степень превращения, но зато высокой — селективность. Но есть и такие частицы, время пребывания которых велико, значительно больше среднего. Вот в этих частицах образуется столько побочного продукта, что он загрязнит всю смесь и понизит селективность по сравнению с аппаратом вытеснения. Это подтверждается как расчетами, так и богатым экспериментальным материалом. К сожалению, и промышленные установки неоднократно давали резко сниженную селективность из-за влияния продольного перемешивания.
Не будем подробно обсуждать другой тип побочных реакций — параллельный, когда из одного и того же реагента может получиться либо основной продукт, либо побочный (например, при хлорировании этилена может образоваться и хлорвинил СН2=СНС1 и дихлорэтан
СН2С1—СН2С1). Здесь в зависимости от особенностей целевой и побочной реакции селективность может оказаться выше и в аппарате вытеснения, и в аппарате смешения, и одинаковой в обоих типах потоков.
Теперь поговорим вот о чем. Для очень многих химических процессов поток вытеснения является теоретически наилучшим, поэтому довольно многие (в том числе и некоторые специалисты) делают заключение: следовательно, поток смешения—наихудший. Это ошибка, причем ошибка не только фактическая, но и логическая. Почему? Каждый из нас интуитивно не может не чувствовать, что живет в мире, развивающемся в борьбе противоположностей. И тогда в своих рассуждениях, доверяясь обыденному сознанию (а не научным истинам), мы невольно опираемся на стихийную диалектику: там, где есть свет, есть и тьма; где есть меньше, есть и больше; если есть наилучшее, есть и наихудшее. Именно с этим связана и ошибка в оценке достоинств и недостатков идеальных потоков.
Во-первых, в тех случаях, когда поток идеального вытеснения — теоретически лучший, теоретически худшего просто не существует. Могут быть потоки значительно худшие, чем идеальное смешение. Особенно плохо, если в потоке существуют застойные зоны — такие области, где жидкость практически неподвижна и не участвует в общем движении.
Во-вторых, как уже упоминалось, аппараты смешения обладают рядом достоинств: в них обычно сравнительно просто организовать отвод тепла, выделяющегося в реакции, их конструкция может оказаться проще, чем для других типов потока.
В-третьих, есть случаи (хотя и не частые), когда степень превращения в потоке смешения оказывается выше, чем в потоке вытеснения равного объема. Это вариант реакций с самоускорением, т. е. таких, скорость, которых сначала мала, затем растет и лишь к концу реакции снова падает. Явление самоускорения связано с тем, что в процессе реакции вырабатывается некая субстанция, ускоряющая реакцию. Для примера рассмотрим процесс ферментации:— совокупность химических реакций, проходящих под воздействием микроорганизмов. Пусть мы ввели в аппарат питательную среду, в которой будет происходить процесс, и небольшую порцию микроорганизмов (порция чаще всего невелика хотя бы потому, что препараты микроорганизмов дороги). Если это аппарат вытеснения, то вначале процесс будет идти медленно: мало микробов. Но по мере его протекания микробы размножаются, их число увеличивается, и в результате реакции ускоряются. Многие, вероятно, наблюдали подобное явление при приготовлении дрожжевого теста. Вначале, после того как смешают муку с водой и дрожжами и поставят тесто в теплое место, брожение идет не очень быстро, и на вид с тестом ничего не происходит. Но потом дрожжевых грибков становится все больше, брожение ускоряется, и, если недоглядеть, тесто «убежит» из квашни.
Но при таком проведении процесса объем аппарата используется очень плохо. Действительно, во всей его начальной части реакция идет с малой скоростью, и поэтому аппарат придется делать очень большим, Другое дело — аппарат смешения, где во всем объеме можно поддерживать такой состав смеси (включая содержание в ней микробов), который отвечает максимуму скорости процесса.
Мы уже говорили о том, что в ряде случаев в аппарате смешения может получиться и более высокая селективность, и тогда он превосходит своих конкурентов по всем статьям. Однако такие случаи достаточно редки. Типичная ситуация такова: с точки зрения продольного перемешивания аппарат вытеснения лучше, но слабое продольное смешение сопровождается слабым поперечным переносом. В результате затруднен теплообмен, усложняется конструкция. Можно ли найти решение, объединяющее достоинства обоих идеальных аппаратов?
КАСКАД РЕАКТОРОВ СМЕШЕНИЯ
Что произойдет, если мы вместо одного большого аппарата смешения пропустим реагирующий поток последовательно через несколько меньших по объему, каждый из которых — тоже аппарат идеального смешения? Как будет вести себя такой каскад реакторов?
Вначале проведем качественный анализ. Распределение времени пребывания в каскаде должно отличаться от распределения в одном аппарате смешения. Действительно, рассмотрим какую-то частицу, которая в первом аппарате каскада пробыла очень мало времени, сразу попав на выход. Но вряд ли и во втором аппарате она попадет в число самых быстроуходящих. А уж такое совпадение, чтобы эта частица уходила в числе первых из каждой ступени каскада, совсем маловероятно. Таким образом, при прохождении каскада время пребывания отдельных частиц выравнивается, приближаясь к среднему. Здесь проявляется очень общая закономерность, известная в теории вероятностей как закон больших чисел: если некоторое сложное событие складывается из ряда элементарных, то, чем больше этих элементарных событий, тем слабее характеристики суммарного события колеблются относительно своих средних значений, тем менее вероятны сильные отклонения от среднего. Все это означает, что чем больше в каскаде ступеней, тем ближе поток (по распределению времени пребывания частиц) к идеальному вытеснению.
Рис. 9. Распределение концентрации реагента по длине реактора:
Теперь посмотрим, как замена одного аппарата смешения каскадом повлияет на распределение концентрации реагирующего вещества по длине (если считать весь каскад одним аппаратом).
Рис. 9 изображает изменение по длине аппарата концентрации реагента А, который расходуется в реакции А → R. Кривая / относится к аппарату вытеснения, горизонталь 2 — к -аппарату смешения; ход изменения концентраций в каскаде из трех аппаратов смешения характеризует ступенчатая линия, где цифрой 3 обозначена первая ступень каскада, 4 — вторая, 5 — третья. Для последней ступени концентрация А такая же, как в едином аппарате смешения. Но для всех предыдущих ступеней она больше, здесь соответственно выше и скорость реакции. С ростом числа ступеней каскада ломаная линия на рис. 9 будет приближаться к кривой /, и если ступеней достаточно много, то общий характер распределения концентраций приближается к идеальному вытеснению.
Несложно
получить и количественные оценки.
Для этого рассматривают протекание
реакции сначала в первом аппарате
каскада; затем переходят ко второму,
учитывая при этом, что на входе во
второй аппарат концентрации веществ
такие же, как на выходе из первого;
далее переходят к третьему и т. д. Для
реакции первого порядка
![]() ,
длякоторой
применительно к идеальным потокам
ранее получены уравнения (15) — (20),
расчет для каскада аппаратов смешения
приводит к следующей формуле:
,
длякоторой
применительно к идеальным потокам
ранее получены уравнения (15) — (20),
расчет для каскада аппаратов смешения
приводит к следующей формуле:
 ,
(21)
,
(21)
где
![]() -среднее
время пребывания жидкости
во всем каскаде (следовательно,
-среднее
время пребывания жидкости
во всем каскаде (следовательно,
![]() /п
—
среднее время пребывания в
одной ступени); п
—
число ступеней. Естественно,
при п=1
формула (21) совпадает
с (18);
при п
→ ∞ формула (21) преобразуется
в уравнение (16).
/п
—
среднее время пребывания в
одной ступени); п
—
число ступеней. Естественно,
при п=1
формула (21) совпадает
с (18);
при п
→ ∞ формула (21) преобразуется
в уравнение (16).
Для
численного сопоставления нужно задаться
определенным значением величины
![]() к.
Чем больше это произведение, тем
больше объем аппарата либо быстрее
идет реакция. Сравним получаемые степени
превращения при
к.
Чем больше это произведение, тем
больше объем аппарата либо быстрее
идет реакция. Сравним получаемые степени
превращения при
![]() к=6:
при
п=1
Х=0,857
(один большой аппарат
идеального смешения); при п
=2 Х=0,938;
при п
=3 Х=0,963; при п=6
Х=0,984;
при -
п
→
∞ Х=0,996
(аппарат идеального
вытеснения).
к=6:
при
п=1
Х=0,857
(один большой аппарат
идеального смешения); при п
=2 Х=0,938;
при п
=3 Х=0,963; при п=6
Х=0,984;
при -
п
→
∞ Х=0,996
(аппарат идеального
вытеснения).
Уже разделение единого потока смешения на две последовательные ступени позволяет резко повысить Х. Учтем, что при Х>0,9 каждая «дополнительная сотая» — это уже немало. Для того чтобы получить в одном аппарате смешения значение х=0,938, его объем пришлось бы увеличить в 2,5 раза. Еще больший эффект дает дальнейший рост числа ступеней: для получения Х=0,963 объем аппарата смешения должен увеличиться более чем в 4 раза, а для Х=0,984 — в 10 с лишним раз.
Поэтому в химической технологии широко используется секционирование: аппарат делят на секции поперечными перегородками с отверстиями. Эти отверстия служат для перетекания жидкости из одной секции в другую, причем циркуляционные потоки, перемещающие жидкость навстречу основному потоку, на таких перегородках задерживаются. Поэтому продольное перемешивание происходит в основном только в пределах каждой ступени. Естественно, тот же эффект даст установка — на месте одного большого аппарата с мешалкой — нескольких маленьких, соединенных последовательно.
Секционирование влияет не только на степень превращения, но и на селективность. Зачастую простейшее конструктивное изменение — установка внутри аппарата нескольких перегородок с отверстиями — приводит к резкому улучшению всех основных показателей химического процесса.
ИЗУЧЕНИЕ РАСПРЕДЕЛЕНИЯ ВРЕМЕНИ ПРЕБЫВАНИЯ
Особенности структуры потока, связанные с продольным перемешиванием, одновременно связаны с неравномерностью времени пребывания. Поэтому один из лучших способов определить, какова структура данного потока,— это исследовать в нем распределение времени пребывания.
Задача заключается в следующем. Через аппарат движется поток. В какой-то момент мы отбираем на выходе пробу жидкости. И теперь хотим узнать, какая доля жидкости в этой пробе вошла в аппарат секунду назад, какая — две, три, четыре и т. д. Но как это сделать? Ведь разные частицы пробы для нас неразличимы. Давайте сделаем их различными. Для этого выделим среди всех частиц потока те, которые вошли в аппарат в какой-то определенный момент. С этой целью мы их пометим. Обычно это делается так. В определенный момент (в дальнейшем будем принимать его за начало отсчета времени, τ=0) в жидкость на входе коротким импульсом добавляется малое количество добавки-индикатора (ее называют также «трассер»). Теперь, если на выходе появится меченая частица, нам будет точно известно, когда она вошла в аппарат и, следовательно, сколько времени она в нем пробыла. Нам достаточно получить лишь зависимость концентрации индикатора на выходе из аппарата от времени (си от τ), поскольку она в определенном смысле представляет собой портрет распределения времени пребывания.
Что можно использовать в качестве индикатора? Эта примесь должна обладать следующими свойствами. Во-первых, она не должна влиять на движение потока. Отсюда прежде всего следует, что индикатора нужно добавлять очень мало. Во-вторых, с индикатором внутри аппарата ничего не должно происходить: он не должен вступать в реакцию, оседать на стенках и внутренних деталях аппарата. Единственное его назначение — двигаться вместе с мечеными частицами. Наконец, в-третьих, он должен быть легко идентифицирован на выходе.
Если движущаяся в аппарате фаза — вода, то индикатором может быть раствор красителя (на выходе мы поставим колориметр) или раствор электролита (на выходе — измеритель электропроводности, кондуктометр). Если движется воздух, то в качестве примеси чаще всего используют газ, сильно отличающийся по теплопроводности: гелий (теплопроводность велика) или СО2 (теплопроводность мала). На выходе — датчик теплопроводности.
Теперь подробнее исследуем зависимость Си от τ. Рассмотрение этого вопроса существенно упрощается, если привести Си и τ к безразмерному (приведенному) виду. Операция приведения очень широко распространена в физике, и сейчас мы немного отвлечемся, чтобы поговорить об этом.
Что значит измерить какую-то величину? Это — сравнить ее с неким эталоном. Измерить длину — сравнить длину данного предмета с длиной платиновой линейки, хранящейся в Севре (или, более современно, с длиной волны излучения, полученного в строго определенных условиях). Измерить массу — опять же сопоставить массу предмета с массой эталона килограмма и т. д. Каждый раз эталон — нечто совершенно чуждое данному конкретному измерению и зато общее всем измерениям данной величины.
Но можно поступать и иначе. Предположим, мы захотим определить размеры конкретной человеческой фигуры. И в качестве единицы (эталона) примем не метр, не сантиметр и даже не фут, а рост этого человека. Тогда , например, получится: ширина плеч — 0,276; окружность груди — 0,596; длина руки — 0,447 и т. д.
Если теперь попытаться по этим данным восстановить фигуру, то окажется, что полученный набор чисел одинаково хорошо подходит и к самому человеку, и к статуэтке высотой 20 см, и к статуе в два человеческих роста. Эти числа определяют не размер предмета, а только его пропорции. При таком способе измерения все подобные предметы неразличимы.
Хорошо это или плохо? С одной стороны, описание внешности оказалось явно неполным. Вы так и не поняли, какого он роста (скрывать не станем — 180 см). Лишь после указания роста этот набор чисел оказался связанным с эталоном, а значит, и с остальными предметами окружающего мира. Но зато получена характеристика, обладающая общностью: ею описывается не только конкретный человек, но и ряд возможных его изображений в разных масштабах.
Эти соображения оказались особенно важными после того, как понятие подобия удалось распространить на все физические величины и явления. Можно говорить о подобии движения в потоках, подобии протекания химических реакций и т. д. Около века назад оформилась теория подобия, анализирующая явления с позиций их подобия. Одна из важнейших возможностей, даваемых этой теорией, как раз и заключается в обобщенном характере описаний — описав поведение одного объекта, мы получаем характеристику любого объекта, подобного данному; достаточно только учесть его размер (масштаб). Если наш первый объект — модель какого-то практически важного оригинала, то теория подобия определяет правило переноса полученных зависимостей с модели на оригинал и, таким образом, является одной из основ моделирования.
Одна из особенностей теории подобия — использование безразмерных величин, т. е. величин, не связанных с общими эталонами, о которых говорилось вначале (размерность, по сути дела,— это и есть соотнесение с эталоном). Простейший способ получения безразмерной величины уже рассмотрен нами: сопоставление результатов измерения с принятым за единицу внутренним эталоном (в рассмотренном примере это был рост), характеризующим данную конкретную задачу. (Есть и более сложные способы: так, использованное нами при описании турбулентного потока число Рейнольдса, по сути, представляет собой безразмерную скорость.)
Теперь
вернемся к распределению времени
пребывания. Чтобы выразить τ
и
Си
в безразмерном виде, выберем внутренние
эталоны (единицы). В качестве единицы
времени естественно принять среднее
время пребывания
![]() =VP/VC
Безразмерное
время т для любого момента
/ будет равно
=VP/VC
Безразмерное
время т для любого момента
/ будет равно
τ=τ/![]() .
(22)
.
(22)
Единица концентрации Со определяется следующим образом. Обозначим количество индикатора, введенное на входе, g0, тогда
![]() (23)
(23)
Для безразмерной концентрации С индикатора на выходе имеем C=Cи/С0
Переход от переменных τ, СИ к безразмерным τ и С сразу же позволяет распространять полученные результаты на группу подобных друг другу случаев. Особенно ясно это преимущество в отношении величины с„. Ведь си пропорционально gо, т. е. чем больше мы введем индикатора, тем большую концентрацию получим; но gо — величина, не имеющая отношения к характеру потока, связанная со случайными обстоятельствами опыта. В то же время С не зависит от этих обстоятельств. Использование τ также удобно: установив условия подобия (в ряде случаев это удается сделать), мы получаем одинаковое описание и небольшой лабораторной модели с малым средним временем пребывания, и большого промышленного аппарата, где время велико. Есть и другое преимущество безразмерных переменных, но о нем мы поговорим немного позже.

Рис. 10. Зависимость безразмерной концентрации от безразмерного времени
Итак, наш опыт с вводом индикатора дал зависимость С от τ. Типичный (хотя далеко не единственно возможный) график функции С(τ) показан на рис. 10. Вначале на выходе нет индикатора. Затем появляются первые его порции — те, которые метят частицы с наименьшим временем пребывания. Потом С становится больше, проходит через максимум и начинает убывать: основная масса индикатора прошла, и выходит то, что задержалось в зонах циркуляции и застоя. Через достаточно большое время концентрация С практически падает до нуля, хотя теоретически не исключается и асимптотический характер приближения кривой зависимости к нулю.
Дальнейшее выяснение физического смысла функции С(τ) связано с одним из фундаментальных понятий современной математики — случайной величиной, о которой заранее нельзя точно сказать, какое значение примет она при нашем измерении. Мы не знаем, сколько зернышек окажется в арбузе, который собираемся разрезать; не знаем, каким будет время пребывания какой-то одной частицы из числа тех, которые в данный момент входят в аппарат. И число зернышек, и время — случайные величины.
Но чтобы наша величина в качестве случайной стала предметом научного рассмотрения, необходимо, чтобы эксперимент по ее измерению можно было проводить многократно, и каждый раз эта величина должна оставаться случайной. Например, мы заранее не знаем, сколько гор окажется на Титане — спутнике Сатурна. Но это не случайная величина: один раз сосчитаем и будем знать навсегда.
Важнейшая характеристика случайной величины — вероятность. Строго определить, что это такое, очень сложно. Нас удовлетворит приблизительное описание, не претендующее на строгость. Вероятность показывает, как часто в измерениях будет получаться данное значение величины. Но ведь величина — случайная, и в разных сериях измерений частота ее появления окажется различной (иначе мы заранее бы знали, когда что получится). Это верно; но если числе измерений будет становиться все больше и больше, то эта частота окажется во ближе и ближе к вероятности. Вероятность и есть в некотором (не вполне строгом) смысле тот предел, к которому стремится частота при увеличении числа измерений и вокруг которого она колеблется в различных сериях.
Вероятность Р любого значения случайной величины заключена в предела от 0 до 1. Если Р=0, то данное значение практически никогда не появится в измерениях. Если Р=1, то во всех измерениях наверняка будет получаться именно данное значение. Например, если мы станем подсчитывать количество певчих птиц в ближайшей роще, вероятность того, что их число составит 109 равна 0 (наверняка в роще не поместится миллиард птиц). Вероятность, равна 1, характеризует величины неслучайные. Так, сейчас у Земли с вероятностью имеется один крупный естественный спутник. В некоторых простых ситуациях определить вероятность можно исходя и числа возможных равновероятных результатов измерений. Скажем, при бросании игральной кости (кубика) вероятность того, что выпадет 5, равна 1/6. Для шести возможных вариантов вероятность того, что выпадет хотя бы один из них, равна 1, а вероятность любого конкретного варианта в 6 раз меньше. Все примеры, рассмотренные в предыдущем абзаце, относятся к одному классу случайных величин, так называемым дискретным. У этих величин их возможные значения — не любые, а отделены друг от друга каким-то интервалом. Число птиц, спутников, число очков при бросании кости — обязательно целые числа. Не может быть у планеты, скажем, 2,3 спутника. Есть дискретные величины, где интервал и не целый. Например, суммарный спин систем электронов может принимать значения, отделенные друг от друга интервалами, кратными ½. Но в любом случае у дискретных величин эти интервалы есть.
Другой случай — непрерывные случайные величины, к ним относятся масса, время, скорость и т. п. Здесь в некоторой области может получиться любое значение. Время может составить 1 с, 2 с, но может и 1,08356 с, и какое угодно другое значение.
Для непрерывных случайных величин вероятности приходится задавать по-особому. Дело вот в чем. Вероятность того, что непрерывная случайная величина примет какое-то точно заданное значение, всегда равна 0. Как же так? Ведь какое-то значение обязательно получится. Да, но это будет не то значение, которое мы заранее задали. Мы задали 1,5, а получилось 1,5000001. И даже если получили 1,5000000, никогда нельзя ручаться, что еще через 200 знаков не появится какой-то, отличный от нуля. Бесконечный диапазон возможных значений, как угодно близких к заданному, и приводит к тому, что для заданного значения получаем Р=0.
Но нельзя же сказать, что все значения непрерывной случайной величины равновероятны. Вероятность того, что масса яблока, сорванного с дерева, окажется равной точно 200 г, равна 0. Вероятность того, что эта масса окажется равной точно 200 кг, тоже равна 0. Но ясно, что это в каком-то смысле разные нули: яблоко в 200 г нас не удивит, яблоко в 200 кг совершенно невероятно.
Для того чтобы определить вероятность значения непрерывной случайной величины, это значение надо задать не точно, а с каким-то интервалом. Вероятность того, что масса яблока окажется в пределах от 200 до 200,1 г уже не равна нулю, хотя и мала (потому что мал интервал в 0,1 г).
Записывается этот способ определения вероятности так:
P(x≤ X ≤x+dx)=f(x)dx 25
Смысл формулы (25) таков. Здесь X —. случайная величина; х — какое-то ее значение; dx — бесконечно малое приращение (дифференциал) значения х. Левая часть обозначает вероятность того, что величина х окажется в интервале от х до х+ dx. Теперь обратимся к правой части. Множитель их введен сюда потому, что чем больше интервал, тем скорее «попадет» в него величина. Функция f(x) отражает то обстоятельство, что разные значения х не равновероятны (точнее, что вероятность попасть в интервал шириной dx зависит от того, где на оси х расположен этот интервал). Эта функция называется плотностью вероятности случайной величины.
Так вот, функция С(τ), оказывается, представляет собой плотность вероятности времени пребывания. Если выразить время не в приведенных, а в размерных единицах, то
![]() (26)
(26)
где С(τ) — та же самая безразмерная концентрация индикатора (делать ее размерной нет смысла).
Как же можно использовать полученную плотность вероятности, т. е. функцию С(τ) или f(τ)? Прежде всего для ряда случаев знание этой функции позволяет непосредственно рассчитать ход химической реакции. Так, протекание реакции первого порядка (см. формулы 13, 16, 18) в потоке, где распределение времени пребывания характеризуется плотностью вероятности f(τ), дает на выходе такое значение концентрации реагента:
![]() (27)
(27)
Рассчитать
этот интеграл не так уж сложно,
для чего, например, можно построить
график функции![]() от τ=0 до того значения τ, при котором
эта
функция для нас неотличима от нуля.
Площадь
под графиком приближенно равна
искомому интегралу. В практических
целях обычно пользуются более
быстрыми и точными методами численного
интегрирования. Формула (27) показывает,
что в этом простом случае для расчета
процесса достаточно знать уравнение
скорости реакции (13)
и функцию f(τ),
которую
можно получить из опыта с
пропусканием индикатора.
от τ=0 до того значения τ, при котором
эта
функция для нас неотличима от нуля.
Площадь
под графиком приближенно равна
искомому интегралу. В практических
целях обычно пользуются более
быстрыми и точными методами численного
интегрирования. Формула (27) показывает,
что в этом простом случае для расчета
процесса достаточно знать уравнение
скорости реакции (13)
и функцию f(τ),
которую
можно получить из опыта с
пропусканием индикатора.
В более сложных случаях не всегда можно получить аналогичную формулу. Тогда использование непосредственно функции C(τ) или f(τ) может быть затруднительно. Проще поступать по-другому: рассчитать на основе этой функции некоторые характеристики времени пребывания как случайной величины и дальше пользоваться для анализа этими характеристиками.
Чаще всего рассчитывают две основные характеристики. Первая характеризует среднее значение случайной величины. Раз величина случайная, то и получаемые для нее значения оказываются разными. Но какова она в среднем? Около какого среднего колеблются отдельные ее значения? Оказывается, в теории вероятностей можно определить несколько разных средних. Но чаще всего пользуются характеристикой, которая еще с XVII в. носит название математическое ожидание. Название сегодня мало о чем говорит. Когда-то оно означало ожидаемый средний выигрыш в азартной игре. Азартные игры, особенно кости, оказались прекрасной моделью, на которой изучали свойства вероятностей первые исследователи в этой области. Сейчас интересы математиков переместились на совсем иные вопросы, а термин остался. По существу, математическое ожидание — то же самое, что среднее арифметическое, только записанное так, чтобы можно было рассчитать его через вероятности. Поэтому в дальнейшем будущем будем называть его просто средним и обозначать чертой над усредняемой величиной.
Среднее значение безразмерного времени пребывания определяется формулой
![]() (28)
(28)
Но
эта формула практического интереса не
представляет. Дело в том, что, приводя
время к безразмерному виду, мы приняли
среднее время за единицу. И если дальше
все правильно, то формула (28.) должна
тождественно приводить к результату
![]() =1.
Гораздо интереснее формула,
которую можно вывести из (28), позволяющая
рассчитать Г из результатов
опыта с вводом индикатора
=1.
Гораздо интереснее формула,
которую можно вывести из (28), позволяющая
рассчитать Г из результатов
опыта с вводом индикатора
![]() (29)
(29)
Можно
возразить —
величину
![]() гораздо
быстрее и проще
рассчитать по формуле (11).
Зачем такие
сложности?»
гораздо
быстрее и проще
рассчитать по формуле (11).
Зачем такие
сложности?»
Формула (29) сложна, это верно. Но зато ее можно использовать тогда, когда неизвестен объем, занимаемый потоком. А затем при помощи формулы (11) определить этот самый неизвестный объем.
Работать таким методом первыми начали, по-видимому, спелеологи. Во многих местах (например, на Южном берегу Крыма) важную роль играют речки, вытекающие из подземных озер, спрятанных в пещерах. Такое озеро служит природным водохранилищем, и его объем важно знать для прогноза поведения реки. Но далеко не всегда удается обмерить озеро непосредственно. Тогда к пещере отправляется экспедиция. Экспедиция делится на два отряда. Один останавливается наверху, в том месте, где река выбивается из-под земли. Замерив расход воды в реке, он ждет. Другой отряд спускается в пещеру. И в заранее обусловленное время (например, ровно в полночь) спелеологи выливают в устье той подземной речки, которая впадает в озеро, бутылку индикатора. Чаще всего используют флюоресцеин. Даже очень разбавленные его растворы ярко флюоресцируют — светятся красивым зеленым светом. Начиная с момента ввода индикатора, наземный отряд каждые полчаса (или час, или 10 минут в зависимости от ожидаемых размеров озера и от расхода воды) отбирает пробы воды для анализа на индикатор. Нужно сказать, зрелище это очень красивое и немного жуткое:
вся вода в реке светится изумрудным сиянием. Говорят, жители глухих уголков Пиренеев, где такие опыты проводил знаменитый французский спелеолог Н. Кастере, никак не могли решить, кто же эти странные люди, заставляющие светиться реки: посланцы сил добрых или дьявольских.
В химической технологии и, близких к ней отраслях объем аппарата всегда известен. Поэтому здесь такая задача встает лишь тогда, когда поток занимает не весь объем. Так, часто через аппарат движутся два потока: сверху — жидкость, а снизу — газ или пар. При этом скорость газа велика, и его время пребывания мало. А вот жидкость находится в аппарате значительно дольше, и если обрабатываемые вещества способны разлагаться, то желательно сделать время пребывания минимальным. Поэтому стоит подобрать такой режим работы, когда объем, занимаемый стекающей жидкостью, невелик и в соответствии с уравнением (11) мало время пребывания. При отладке такого режима эксперимент с вводом индикатора может сослужить неоценимую службу.
Другой пример, когда, наоборот, малое значение I является грозным признаком — это случай образования козла в шахтных печах.. Название звучит несколько комично, но в самом явлении веселого мало. Козел в печи — это прилипший к стенке или к деталям конструкции материал, на который налипают еще и еще порции; постепенно образуется большой ком, давящий на стенку, перегораживающий путь материалу. Если вовремя не принять меры, козел может стать таким большим, что приведет, к аварии с весьма тяжелыми последствиями. В домне, например, козел может весить много тонн. Такая махина способна обрушить футеровку печи, что потребует остановки на капитальный ремонт и причинит громадные убытки.
Самый
простой способ обнаружить зарождающийся
козел, основан на том, что
он, перегораживая путь части движущейся
в печи шихты, образует застойную
зону, а это ведет к уменьшению рабочего
объема и соответственно
![]() .
.
Теперь еще об одной характеристике случайной величины, очень важной для анализа структуры потока. Это характеристика разброса относительно среднего. Если трехкилограммовый пакет с картофелем содержит 30 клубней, то средняя масса клубня составит 100 г. Но для нас не все равно, будут ли все 30 клубней приблизительно по 100 г (скажем, колебаться от 80 до 120 г) или в пакете будут лежать два гигантских клубня по 1,2 кг, а остальные 28 клубней — мелочь примерно по 20 г. В первом случае все значения массы близки к среднему, во втором наблюдается сильный разброс вокруг него. Наиболее принятая в теории вероятностей мера разброса — дисперсия, представляющая собой среднее значение квадрата отклонения случайной величины от ее математического ожидания (оказалось удобнее изучать квадраты отклонений, чем сами отклонения). Если нам нужно оценить не квадрат, а само отклонение, то достаточно извлечь из дисперсии корень квадратный и получим среднее квадратичное отклонение.

Рис. 9.Плотность вероятности времени пребывания для идеальных потоков: 1 - вытеснение; 2 - смешение
Формула
для расчета дисперсии безразмерного
времени пребывания
![]() имеет
вид
имеет
вид
![]() (30)
(30)
В подавляющем большинстве случаев, чем больше дисперсия, тем дальше поток от идеального вытеснения. Для того чтобы яснее представить себе это, рассмотрим плотности вероятности для тех типов потока, которые были рассмотрены раньше.
Для
идеальных потоков графики С(т)
показаны на рис. 9. Для идеального
вытеснения, строго говоря, график
построить
нельзя. Действительно, опишем
поведение индикатора, движущегося с
потоком в аппарате идеального вытеснения.
При этом нам придется учесть одно
свойство плотности вероятности
(физически
достаточно очевидное), согласно которому
всегда
![]() (31)
(31)
Левая часть выражения (31) задает вероятность того, что время пребывания частицы в интервале от 0 до ∞ примет какое-то значение, что будет в любом случае, поэтому соответствующая вероятность и равна единице.
Теперь рассмотрим движение индикатора. Для любого τ <1 на выходе нет индикатора: си=0, С=0. Все частицы, помеченные индикатором, движутся вместе, и ни одна из них еще не появилась на выходе. То же верно и для любого т>1; все меченые частицы уже вышли. При τ= 1 все частицы выходят одновременно. На графике должен быть скачок вверх-вниз (пик), причем ширина этого пика равна нулю. Но мы уже говорили, что интеграл равен площади под кривой. Уравнение (31) требует, чтобы эта площадь была равна 1; тогда высоту пика придется считать бесконечной. Очень странная получается функция: всюду, кроме одной точки, она равна нулю; а в этой точке — бесконечный пик с площадью, равной 1. До начала нашего века такое, пожалуй, и функцией бы не назвали. Потом эта функция остро понадобилась физикам, и один из величайших физиков XX в. П. Дирак ее ввел и назвал дельта-функцией. То, что показано на рис. 11, лишь весьма отдаленное подобие дельта-функции, которую точно изобразить невозможно.
Для идеального смешения функции С(т) совсем другая. Она описывается формулой
С=ехр[-τ] (32)
Тоже довольно необычная зависимость. В этом потоке наиболее вероятно, что время пребывания частицы окажется очень близким к нулю: не успеет она войти в аппарат, как идеальная мешалка перекинет ее к выходу, и частица покидает аппарат, не успев принять участие в реакции (об этом мы уже говорили). Наряду с такими частицами есть и другие, хотя и в гораздо меньшем количестве. Они долго странствуют по аппарату, перемешиваемые по всему объему, и теоретически на выходе могут найтись частицы, вошедшие в аппарат как угодно давно.
Дисперсия времени пребывания для потока идеального вытеснения равна нулю, здесь никакого разброса вокруг среднего нет. Для потока идеального смешения а2(т) = 1. Расчет легко провести по формулам (30) и (32).
Для
очень многих реальных потоков величина
σ2(τ)
лежит между 0 и 1. Их в
первом приближении можно рассматривать
как промежуточные случаи между обоими
идеальными потоками. Но возможны
иные случаи, и об этом мы уже говорили.
Разумеется, исключен вариант, когда
σ2(τ)
<0,
но больше единицы дисперсия
может быть, и теоретически может
встретиться сколь угодно большое
значение
σ2(τ).
Правда, если
σ2(τ)
>1, то
это означает, как правило, чрезвычайно
плохую организацию потока; обычно
так получается, когда в аппарате
имеется
очень большая застойная зона, а движущийся
поток проходит малой частью
объема и поэтому весьма быстро. Другой
вариант, приводящий к большим значениям
σ2(τ)
,
напоминает предыдущий: это случай
резкой неравномерности потока
по поперечному сечению, когда нет
настоящей застойной зоны, но в одних
частях сечения скорость в несколько
раз
больше, чем в других. К сожалению, этот
вариант довольно часто встречается в
аппаратах большого поперечного сечения,
и создание агрегатов большой
единичной
мощности ставит перед исследователями
непростую задачу: добиваться
равномерности потока в крупномерных
аппаратах.
Наконец, проследим поведение функции
С(τ) для каскада аппаратов смешения
Рис. 10. Плотность вероятности времени пребывания для каскада аппаратов смешения
.
Графики на рис. 10 построены с учетом
того, что
![]() —
среднее время пребывания
во всем каскаде, рассматриваемом
как один аппарат. Уже при п=2
график
непохож на идеальное смешение
(п=1):С=0
при τ=0, а затем кривая
проходит через максимум. Чем больше
п,
тем
круче и выше пик; как
мы уже отмечали, предел n
→ ∞ coответствует
переходу к дельта-функции.
Интересно
выражение для дисперсии:
—
среднее время пребывания
во всем каскаде, рассматриваемом
как один аппарат. Уже при п=2
график
непохож на идеальное смешение
(п=1):С=0
при τ=0, а затем кривая
проходит через максимум. Чем больше
п,
тем
круче и выше пик; как
мы уже отмечали, предел n
→ ∞ coответствует
переходу к дельта-функции.
Интересно
выражение для дисперсии:
![]() (33)
(33)
Довольно часто понятие каскада используют в качестве схемы, с той или иной степенью приближения описывающей реальный поток, отличающийся от обоих идеальных типов. Тогда один аппарат каскада рассматривают как участок аппарата (ячейку). Такую схему называют ячеечной моделью потока. Эксперимент с вводом индикатора позволяет по формуле (33) легко определить параметр модели — число ячеек, при котором схема лучше всего соответствует нашему потоку.
Химические реакторы с неидеальной структурой потока.
При составлении математической модели реакторов идеального смешения и вытеснения был сделан ряд допущений, облегчающих как построение моделей, так и расчеты на их основе. Однако эти допущения не всегда близки к реальным условиям. Рассмотрим сначала основные причины отклонений от идеальности.
Причина отклонения в непрерывно действующих (проточных) реакторах можно охарактеризовать следующим образом: в аппарат поступает реакционная смесь и каким-то образом перемещается от входного отверстия до выходного

. При этом предполагается, что все элементы реакционного потока находятся в реакторе некоторое время, в течение которого может протекать химическая реакция. В общем случае время протекания отдельных элементов потока в проточном аппарате – это непрерывная случайная величина, значение которой может меняться от 0 до бесконечности. Может оказаться так, что какой-то элемент потока в реакции не участвует, так как он попадает в реакторе в так называемую застойную зону. Здесь реакционная смесь задерживается и скорость химической реакции если не равна 0, то существенно отличается от скорости реакции в основном потоке. Возможные варианты застойных зон:
2) Второй причиной, по которой часть реакционного потока может не применять участие в реакции, является наличие байпасов.

Образование внутренних байпасных линий
Особенно часто байпасы возникают при недостаточно продуманном конструктивном решении в аппарате, где реакционным пространством является поверхность зернистого катализатора.
Наилучшие результаты могли бы быть получены, если бы все элементы реакционного потока находились в зоне реакции строго одинаковое время. Это возможно в аппарате идеального вытеснения, характеризующимся плоским профилем линейных скоростей потока. Однако в реальных реакторах, даже близких к идеальному вытеснению, все-таки существует какое-то распределение элементов потока во времени пребывания, возможно вследствие частичного перемешивания элементов потока в осевом направлении. Такое перемешивание может возникнуть в результате молекулярной диффузии в двух соседних точках потока по длине реактора вытеснения концентрации участников реакции будут разными, разность концентрации ΔС является движущей силой диффузии. Наличие продольной диффузии приводит к нарушению поршневого течения потока – произойдет размывание поршня, если рассматривать некоторый элемент потока как поршень.
Наряду с молекулярной диффузией происходит турбулентная диффузия. Турбулентный поток отличается наличием направленных во все стороны хаотических пульсаций скорости относительно ее среднего значения. При этом пульсации в радиальном направлении приводят к выравниванию условий (концентраций, температуры) по поперечному значению и следовательно необходимы для реактора идеального вытеснения. Пульсации в продольном направлении, наоборот, приводят к тому, что одни элементы потока обгоняют основную массу, другие отстают от нее, т.е. происходит перемешивание или диффузия. Диффузия в осевом направлении происходит не только в турбулентном течении потока. Продольное перемешивание может быть следствием неравномерности поля скоростей, например при ламинарном течении жидкости. В этом случае элементы потока движутся в центре канала быстрее, чем у стенки. Если в какой-то момент времени τ поместить частицы, находящиеся в каком-то сечении потока, то в более поздние моменты τ2, τ3 помеченные частицы окажутся на поверхности параболоида, те из них, которые движутся по оси трубы, уйдут дальше всех, т.е. у самой стенки не сдвинутся с места – их скорость равна 0. И хотя характер движения не хаотический (в любой момент времени можно предсказать положение выбранной частицы), результат будет тот же, что и в случае молекулярной диффузии - размывание поршня. Такой вид диффузии носит название – тейлоровская диффузия.

τ1 τ2 τ3 τ4