- •Техническая термодинамика. Лабораторная работа №1. Определение термодинамических характеристик воды и водяного пара.
- •Описание установки.
- •Лабораторная работа № 2 Определение теплоёмкости воздуха при атмосферном давлении.
- •Изохорная массовая теплоёмкость воздуха по уравнения Майера составляет
- •Контрольные вопросы
- •Лабораторная работа №3 Исследование изохорного процесса
- •Контрольные вопросы
- •Лабораторная работа №4 Градуирование термопар
- •Лабораторная работа №5
- •Описание установки
- •Контрольные вопросы
- •Определение коэффициента теплопроводности методом плиты (метод двух образцов)
- •Описание установки
- •Выполнение работы и обработка результатов исследование
- •Контрольные вопросы
Техническая термодинамика. Лабораторная работа №1. Определение термодинамических характеристик воды и водяного пара.
Цель
работы – определение параметров влажного
пара
![]() которые вычисляются на основе
экспериментальных данных и таблиц
термодинамических особенностей сухого
насыщенного пар и кипящей жидкости на
линии насыщения.
которые вычисляются на основе
экспериментальных данных и таблиц
термодинамических особенностей сухого
насыщенного пар и кипящей жидкости на
линии насыщения.
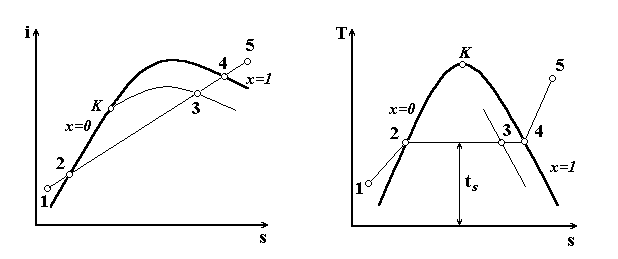
Процесс
преобразования воды в перегретый пар
при постоянном давлении (с подведенным
теплом) складывается из трёх последовательных
стадий: подогрев жидкости, парообразования
и перегрев пара. В процессе парообразования
осуществляется переход из кипящей воды
в сухой пар. В обратном процессе (с
отведением теплоты) имеют место такие
стадии: охлаждение перегретого пара,
конденсация, охлаждение жидкости. В
этой работе должен обратить внимание
на характерные особенности стадий и
чётко знать расчётные формулы как
отдельных из них, так и всего процесса
в целом. Первая стадия получения пара
– нагрев жидкости до кипения, процесс
1-2 при постоянном давлении (рис.12). На
начало отсчёта энтальпии для воды и
водяного пар принимают значения io=O
при
температуре О
оС
и давлении
О,101325 МПа.
Без особых
потерь для точности расчётов можно
считать, что при температуре О
оС
энтальпия не зависит от давления и
равняется нулю. Энтальпия кипящей
жидкости
![]() численно
равна теплотеq
рд,
которая необходима для нагрева 1кг
жидкости в изобарном процессе от О
оС
до температуры кипения
численно
равна теплотеq
рд,
которая необходима для нагрева 1кг
жидкости в изобарном процессе от О
оС
до температуры кипения
![]() .
.
q
рд
=
![]() -
io=
-
io=
![]()
Вычисляют энтальпию кипящей воды по формуле:
![]() (1.1)
(1.1)
где
![]() -средняя
теплоёмкость воды. Дж/(кг
К);
-средняя
теплоёмкость воды. Дж/(кг
К);
![]() -
температура кипения, которая зависит
от давления.
-
температура кипения, которая зависит
от давления.
Чем
выше давление пара, тем больше температура
насыщения
![]() и энтальпияi
кипящей
жидкости, которая измеряется в джоулях
на килограмм (Дж/кг).
Энтропия кипящей жидкости:
и энтальпияi
кипящей
жидкости, которая измеряется в джоулях
на килограмм (Дж/кг).
Энтропия кипящей жидкости:
![]()
![]() (1.2)
(1.2)
(изменение энтропии отсчитывают от О °С, когда энтропия условно равна 0).
Вторая стадия – переход кипящей жидкости в парообразное состояние – процесс 2-4 (кипение жидкости), существенно отличается от первой. Процесс характеризуется не только постоянным давлением, но и постоянной температурой, то есть он есть изобарно-изотермическим, при котором давление и температура кипения взаимозависимы.
Парообразование
начинается с момента закипания жидкости
при подведении теплоты и заканчивается
её полным испарением – состояние сухого
пара точка 4 (рис.12). Количество теплоты,
необходимое для преобразования одного
килограмма кипящей жидкости в сухой
пар при постоянном давлении называется
теплотой парообразования
![]() (Дж/кг).
(Дж/кг).
С
повышением давления теплота парообразования
уменьшается, приближаясь к нулю в
критической точке при критическом
давлении
![]() 22,13
МПа и
критической температуре
22,13
МПа и
критической температуре
![]() 374‚15С.
374‚15С.
В
процессе кипения масса жидкости масса
жидкости уменьшается, а количество пара
увеличивается. Состояние, при котором
одновременно существуют кипящая жидкость
и сухой пар называется влажным паром,
точка 3 (рис.12). Массовое соотношение
пара с жидкостью оценивается степенью
сухости
![]() ,
которая составляет массовую часть пара
в пароводяной смеси, то есть отношение
массы сухого пара
,
которая составляет массовую часть пара
в пароводяной смеси, то есть отношение
массы сухого пара![]() к массе влажного пара
к массе влажного пара![]() .
Масса влажного пара равна сумме масс
кипящей жидкости и сухого пара
.
Масса влажного пара равна сумме масс
кипящей жидкости и сухого пара![]() .
Очевидно, что на момент начала выпаривания
доля кипящей жидкости
.
Очевидно, что на момент начала выпаривания
доля кипящей жидкости
![]() 0,
а на при полном выпаривании для сухого
пара
0,
а на при полном выпаривании для сухого
пара
![]() 1.
Пар в последнем случае получил название
сухого насыщенного пара. Если выпаривание
воды не доведено до конца то есть 0
1.
Пар в последнем случае получил название
сухого насыщенного пара. Если выпаривание
воды не доведено до конца то есть 0![]() 1,
то пар становится влажным насыщенным,
и на его образование тратится в процессе
выпаривания меньше теплоты, чем для
сухого пара.
1,
то пар становится влажным насыщенным,
и на его образование тратится в процессе
выпаривания меньше теплоты, чем для
сухого пара.
|
|
Рис. 12
Для влажного пара энтальпия ix и энтропия s x находятся по формулам:
![]() ;
;
![]() ;
(1.3)
;
(1.3)
Изменение энтальпии и энтропии в процессе выпаривания
![]() (1.4)
(1.4)
Энтальпия и энтропия сухого насыщенного пара при x=1 составляют
![]() ;
;![]()
![]() (1.5)
(1.5)
Третья
стадия – перегрева пара – осуществляется
при дополнительной подачи теплоты до
сухого насыщенного пара, процесс 4-5
(рис.12). В этом случае между давлением
пар и его температурой существует
полнейшая независимость: мы можем
нагреть пар выше температуры насыщения
![]() ,
до любой заданной температурыtпп
=
,
до любой заданной температурыtпп
=![]() .
Перегретый пар приобретает особенности
близкие к идеальному газу. Теплоту
перегрева рассчитывают по формуле
.
Перегретый пар приобретает особенности
близкие к идеальному газу. Теплоту
перегрева рассчитывают по формуле
![]() , (1.6)
, (1.6)
где
![]() -- средняя удельная теплоёмкость удельного
пара в интервале температурыts
… tпп,
и зависит не только от температуры, но
и от давления (определяют по таблицам
воды и перегретого пара).
-- средняя удельная теплоёмкость удельного
пара в интервале температурыts
… tпп,
и зависит не только от температуры, но
и от давления (определяют по таблицам
воды и перегретого пара).
Энтальпия перегретого пара численно равна сумме теплот трёх последовательных стадий парообразования, т.е.
![]() (1.7)
(1.7)
Энтропия перегретого пара также определяет её аддитивную сторону
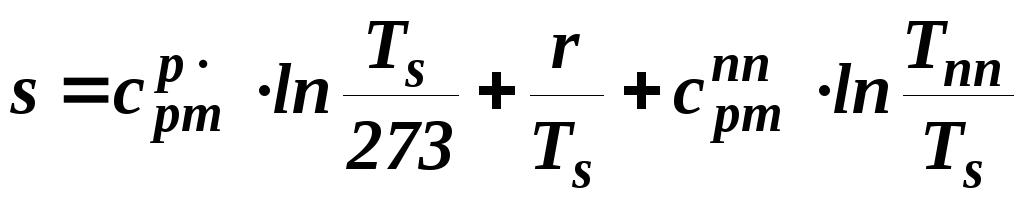 .
(1.9)
.
(1.9)
Таким образом, энтальпия перегретого пара численно равна количеству теплоты в джоулях на килограмм массы, нужной для нагревания 1кг воды от О °С до температуры кипения, дальнейшее выпаривания и для перегрева до заданной температуры при постоянном давлении.