- •Фгоу впо «Пермская государственная сельскохозяйственная академия имени академика д. Н. Прянишникова» методическое пособие по теме «физиология системы крови»
- •Оглавление
- •Введение
- •Физиология системы крови
- •Распределение агглютиногенов и агглютининов в крови системы аво
- •Практические работы Тема: Кровь, ее состав и свойства.
- •Вопросы для самоконтроля знаний.
- •Вопросы к экзамену.
- •Список использованных терминов
- •Эозинопения - уменьшение числа эозинофилов в крови.
- •Бав - биологически активные вещества.
- •Рекомендуемая литература
- •Основные физиологические константы крови сельскохозяйственных животных
Распределение агглютиногенов и агглютининов в крови системы аво
|
Группы крови |
Наличие
| |
|
агглютиногенов в эритроцитах |
агглютининов в плазме | |
|
I (0) |
нет |
, |
|
II (А) |
А |
|
|
III (В) |
В |
|
|
IV (АВ) |
А, В |
нет |
В медицинской практике рекомендуется переливать только кровь одноименной группы с учетом других систем, особенно системы резус - антирезус. Это необходимо строго соблюдать при переливании больших объемов крови.
При переливании небольшого объема крови иногда допускается переливание другой, но совместимой группы. В такой ситуации надо опасаться склеивания вводимых (донорских) эритроцитов. Агглютинины донорской крови при переливании ее в небольшом объеме не несут угрозу эритроцитам реципиента (смешиваясь с кровью реципиента, они оказываются сильно разведены, и уже не в состоянии вызвать агглютинацию). Следовательно, основное правило при переливании крови заключается в том, что эритроциты донорской крови не должны содержать агглютиногены, на которые у реципиента в плазме имеются одноименные агглютинины (см. таблицу 2).
Поскольку кровь доноров 1-й группы крови не содержит агглютиногенов, её в небольших количествах допустимо переливать реципиентам с любой группой крови. Небольшое количество крови доноров 2-й группы допустимо перелить реципиентам с кровью, не содержащей -агглютинины (реципиентам 2-й или 4-й группы), а кровь 3-й группы - реципиентам 3-й или 4-й группы. Кровь доноров 4-й группы переливается только в одноименную труппу, но реципиентам 4-й группы допустимо переливание (в небольшом объеме) крови любой группы.
Таблица 2.
Схема допустимого переливания крови разных групп системы АВ0.
|
Группы крови доноров |
Группы крови реципиентов | |||
|
I |
II |
III |
IV | |
|
I |
+ |
+ |
+ |
+ |
|
II |
- |
+ |
- |
+ |
|
III |
- |
- |
+ |
+ |
|
IV |
- |
- |
- |
+ |
|
П р и м е ч а н и е: знак «+» переливание допустимо, знак «-» переливание недопустимо. | ||||
Практические работы Тема: Кровь, ее состав и свойства.
Цель занятия: Освоить методы забора крови у различных сельскохозяйственных животных. Ознакомиться с методиками, характеризующими плотность и вязкость крови, гематокрит, осмотическую резистентность эритроцитов. Уяснить основные свойства крови и их значимость.
Практические работы:
Взятие крови у животных.
Определение объема плазмы и форменных элементов крови.
Определение резистентности эритроцитов.
Гемолиз эритроцитов.
РАБОТА 1. ВЗЯТИЕ КРОВИ У ЖИВОТНЫХ
Перед взятием крови кожу в участке манипуляции выстригают или выбривают, а при необходимости моют теплой водой с мылом, просушивают марлевой салфеткой и дезинфицируют спиртом или 5% раствором йода.
Цель работы. Освоить технику взятия крови у разных видов животных.
Объект исследования, материалы и оборудование. Животные разных видов, ножницы, иглы кровопускательные, скарификатор, штатив с пробирками, жгут, спирт, 5% раствор йода, вата, марля.
Ход работы. Инструменты стерилизуют. Животных фиксируют с соблюдением всех требований техники безопасности и проводят подготовку кожи, как отмечено выше. В месте взятия крови стерильной иглой (или скарификатором) прокалывают кожу и стенку сосуда или стерильными ножницами надрезают кончик уха или хвоста, гребешка, в зависимости от вида животного и количество крови необходимого для исследования.
Небольшое количество крови у лошади, КРС, овцы, козы берут путем прокола стерильной иглой ушной вены или надреза скальпелем кончика уха. Выступившую первую каплю крови, снимают стерильной ватой, а следующие ее капли берут для исследования.
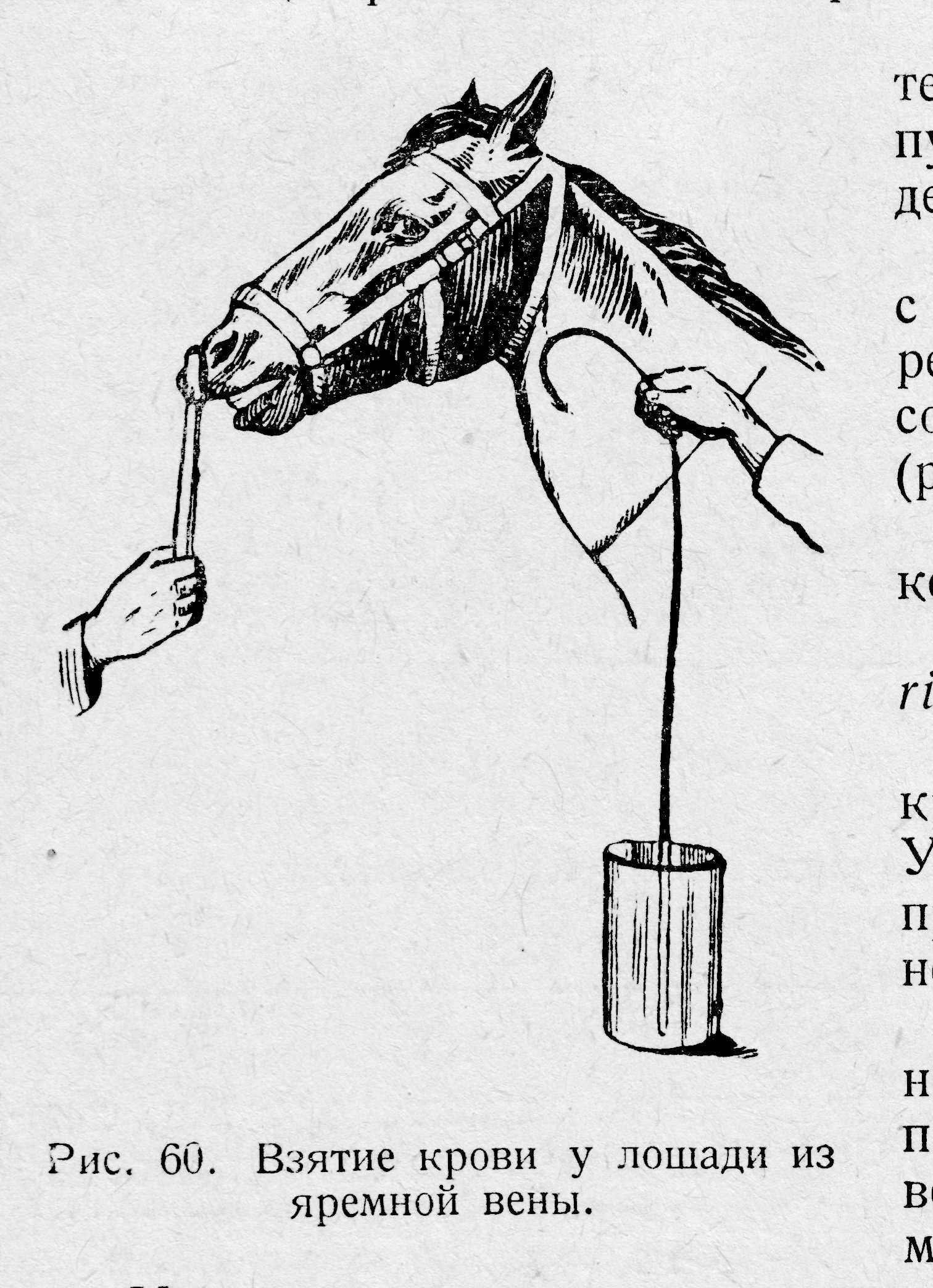
Улошадей(рис. 1.),крупного и мелкого рогатого скотабольшой объем крови удобнее брать из левой яремной вены на границе верхней и средней трети шеи. Для этого ниже подготовленного места взятия крови вокруг шеи накладывают резиновый или обычный жгут. При отсутствии жгута вену сдавливают большим пальцем левой руки ниже места вкола иглы. Это способствует наполнению вены кровью, и она хорошо просматривается. Берут кровопускательную иглу в правую руку и быстрым движением иглу вводят в сосуд под углом 45 градусов против тока крови. Вытекающую из иглы кровь собирают направляя ее по стенке в пробирку. Перед извлечением иглы из сосуда снимают жгут или прекращают сдавливание вены пальцем. Место вкола придерживают ватой, смоченной спиртом, иглу вытаскивают, кожу протирают спиртом.
|
|
Рис. 1. Взятие больших количеств крови у лошади из яремной вены. |
У свиней большой объем крови получают при отрезании кончика хвоста стерильным скальпелем или ножницами. После взятия крови надрез хвоста дезинфицируют, а его кончик, выше раны на несколько минут, сдавливают бинтом или надевают на него резиновое кольцо. Небольшое количество крови у свиней получают при надрезе или проколе ушной вены.
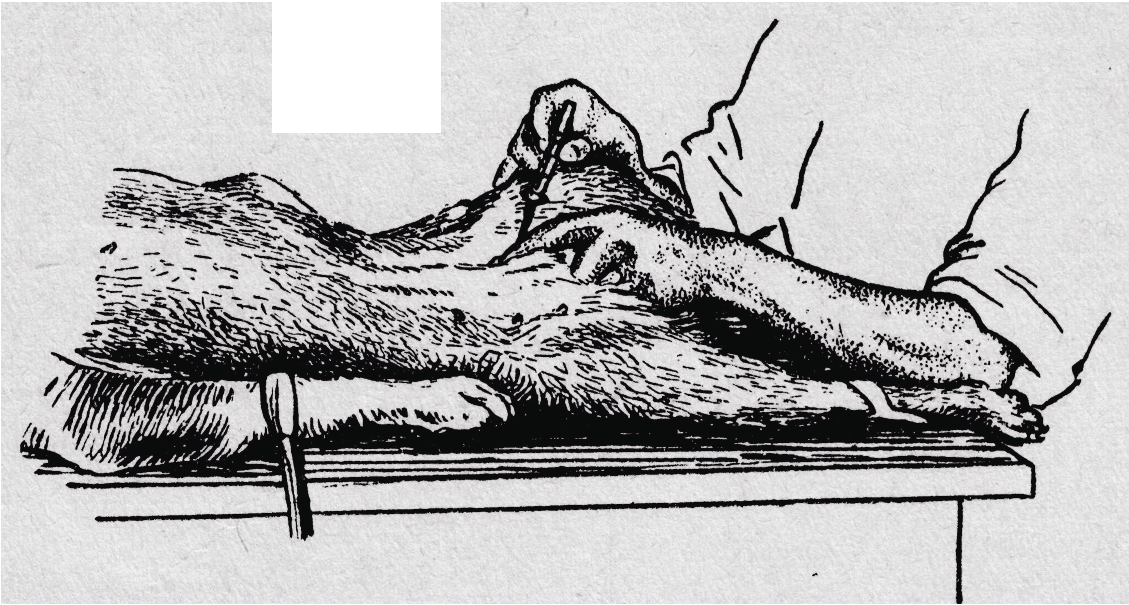
Усобак(рис. 2.) большой объем крови берут из вены сафена, для чего животное кладут на бок и фиксируют или устанавливают в станок. В области верхней трети голени накладывают жгут, после наполнения вены прокалывают кожу и стенку сосуда. Кровь набирают в пробирку или шприц. После взятия крови жгут снимают, место введения иглы сдерживают ватой и извлекают иглу из сосуда. Место пункции протирают спиртом или 5% раствором йода. Небольшое количество крови у собак берут из сосудов уха путем надреза ее края или прокола иглой.
|
|
|
Рис. 2. Взятие крови у собаки из v. femoralis |
У кроликовбольшое количество крови чаще всего берут непосредственно из сердца. Для этого животное фиксируют на правом боку, готовят место пункции и вводят иглу в третий межреберный промежуток слева на 3-4 см выше наружного края грудной кости. Небольшую порцию крови у кроликов (рис. 3.) получают путем надреза или прокола ушной вены.
|
|
|
Рис. 3. Взятие крови у кролика из ушной вены. |
У морских свинокбольшое количество крови берут из сердца, для чего в точке наиболее ощутимого сердечного толчка делают пункцию. Кончик иглы ставят у левого края грудной кости и быстрым движением прокалывают кожу и все ткани, направляя иглу внутрь к средней линии грудной полости на глубину 1,5-2 см. Показатель попадания иглы в сердце - ее движения соответственно сокращению мышцы сердца. Иглу соединяют со шприцем и в него набирают кровь. Чтобы предупредить свертывание крови, перед ее взятием в шприц набирают 2-3 капли 1% раствора гепарина. Небольшое количество крови у морских свинок получают путем надреза края уха или прокола его иглой после предварительного смазывания кожи ушной раковины ксилолом.
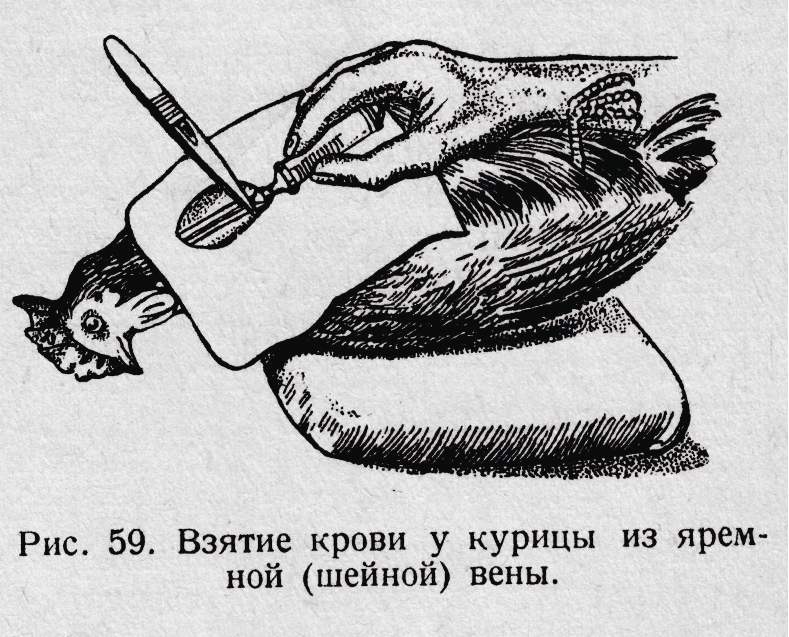
У птиц (рис. 4) кровь получают из подмышечной вены, расположенной под кожей с внутренней стороны крыла. Предварительно в этом месте выщипывают перья, кожу дезинфицируют и протирают 1% раствором гепарина. В пробирку или часовое стекло, в которые собирают кровь, также вносят 2-3 капли 1% раствора гепарина (для предупреждения свертывания крови). Небольшое количество крови у птиц берут чаще всего путем надреза или прокола иглой гребешка, а у гусей, уток - при прокалывании мягких тканей межпальцевых перепонок.
У мышей (рис. 5.) и крыс кровь берут из сосудов хвоста путем срезания его кончика ножницами.
|
|
|
Рис. 4. Взятие крови у курицы из яремной (шейной) вены. |
|
|
|
Рис. 5. Взятие крови у мыши из кончика хвоста. |
Работа №2.Определение объема плазмы и форменных элементов крови.
Материалы и оборудование: Кролик, штатив, градуированные центрифужные пробирки, антикоагулянт (например, лимоннокислый натрий, ЭДТА, гепарин).
Ход работы: В пробирку добавляют антикоагулянт, из вены уха кролика набирают 5 мл крови. Содержимое пробирки тщательно перемешивают и центрифугируют при 3000 об/мин в течение 5 минут. Кровь при центрифугировании разделяется на две части: плазму и форменные элементы. Определить объем плазмы и форменных элементов.
Данные записать и сравнить с нормальными показателями.
Работа №3.Определение осмотической резистентности эритроцитов.
Цель занятия: изучить устойчивость эритроцитов к гипотоническим растворам.
Материалы и оборудование: штатив и в каждом по 8 пронумерованных центрифужных пробирок, 1% р-р поваренной соли. Дистиллированная вода в стаканчиках, 2 пипетки на 10 мл на каждый стол, 20% взвесь эритроцитов.
Ход работы: В каждую пробирку наливают 1% р-р поваренной соли в убывающем количестве. Прибавляют в пробирки дистиллированную воду и получают растворы в убывающей концентрации в соответствии с таблицей 3.
В пробирку пипеткой вносят по одной капле исследуемой крови. Жидкость смешивают, дают постоять 5-10 минут и затем центрифугируют (5 минут).
Расставляют в штативе пробирки в порядке убывающей концентрации. По окраске разбавленного раствора и по осадку определяют границы минимальной и максимальной резистентности.
Таблица 3.
Схема подготовки растворов в пробирках и результаты оценки осмотической резистентности эритроцитов.
|
№ пробирки |
1% раствор поваренной соли (в мл) |
Дистиллированная вода (в мл) |
Полученная концентрация поваренной соли (в %) |
Гемолиз: + полный, ± частичный, - отсутствует |
|
1 |
4,5 |
0,5 |
0,9 |
|
|
2 |
4,0 |
1,0 |
0,8 |
|
|
3 |
3,5 |
1,5 |
0,7 |
|
|
4 |
3,0 |
2,0 |
0,6 |
|
|
5 |
2,5 |
2,5 |
0,5 |
|
|
6 |
2,0 |
3,0 |
0,4 |
|
|
7 |
1,5 |
3,5 |
0,3 |
|
|
8 |
1,0 |
4,0 |
0,2 |
|
Сделать вывод о механизме гемолиза в гипотонических растворах и о диапазоне осмотической резистентности эритроцитов.
Работа №4.Химический гемолиз эритроцитов.
Материалы и оборудование. Кровь животных, штатив с пробирками, пипетки на 5 мл, глазные пипетки, 0,9%-ный раствор натрия хлорида, хлороформ, концентрированный аммиак, спирт этиловый, дистиллированная вода, вата.
Таблица 4.
Схема подготовки растворов в пробирках и результаты оценки химического гемолиза.
|
№ пробирки |
0,9% раствор поваренной соли (в мл) |
Вода (в мл) |
Хлороформ (в мл) |
Нашатырный спирт (в мл) |
Этиловый спирт (в мл) |
Кровь (в каплях) |
Результат |
|
1 |
5,0 |
- |
- |
- |
- |
5 |
|
|
2 |
- |
5,0 |
- |
- |
- |
5 |
|
|
3 |
4,0 |
- |
1,0 |
- |
- |
5 |
|
|
4 |
4,0 |
- |
- |
1,0 |
- |
5 |
|
|
5 |
3,0 |
- |
- |
- |
2,0 |
5 |
|
Гемолиз: + полный, ± частичный, - отсутствует
Ход работы. В соответствии с таблицей 4, в пронумерованные пробирки наливают: в первую - 5 мл 0,9% раствора натрия хлорида, во вторую - 5 мл дистиллированной воды, в третью - 4 мл 0,9% раствора натрия хлорида и 1 мл хлороформа, в четвертую - 4 мл 0,9% раствора натрия хлорида и 1 мл концентрированного аммиака, в пятую - 3 мл 0,9% раствора натрия хлорида и 2 мл этилового спирта. В каждую пробирку вносят по 5 капель стабилизированной крови, содержимое хорошо, но осторожно (для исключения механического гемолиза) смешивают и оставляют в штативе на 10 мин. Результат определяют по цвету жидкости и ее прозрачности. При гемолизе жидкость приобретает лаковый цвет. Заполнить таблицу и сделать вывод о химическом гемолизе.
Тема: ФОРМЕННЫЕ ЭЛЕМЕНТЫ КРОВИ ИХ СВОЙСТВА И МЕТОДЫ ПОДСЧЕТА.
Практические работы:
Подсчет эритроцитов камерным способом.
Подсчет лейкоцитов.
Выведение лейкоцитарной формулы.
Подсчет тромбоцитов.
Работа №1.Подсчет эритроцитов камерным способом.
Цель работы:Овладеть методикой подсчета красных кровяных телец.
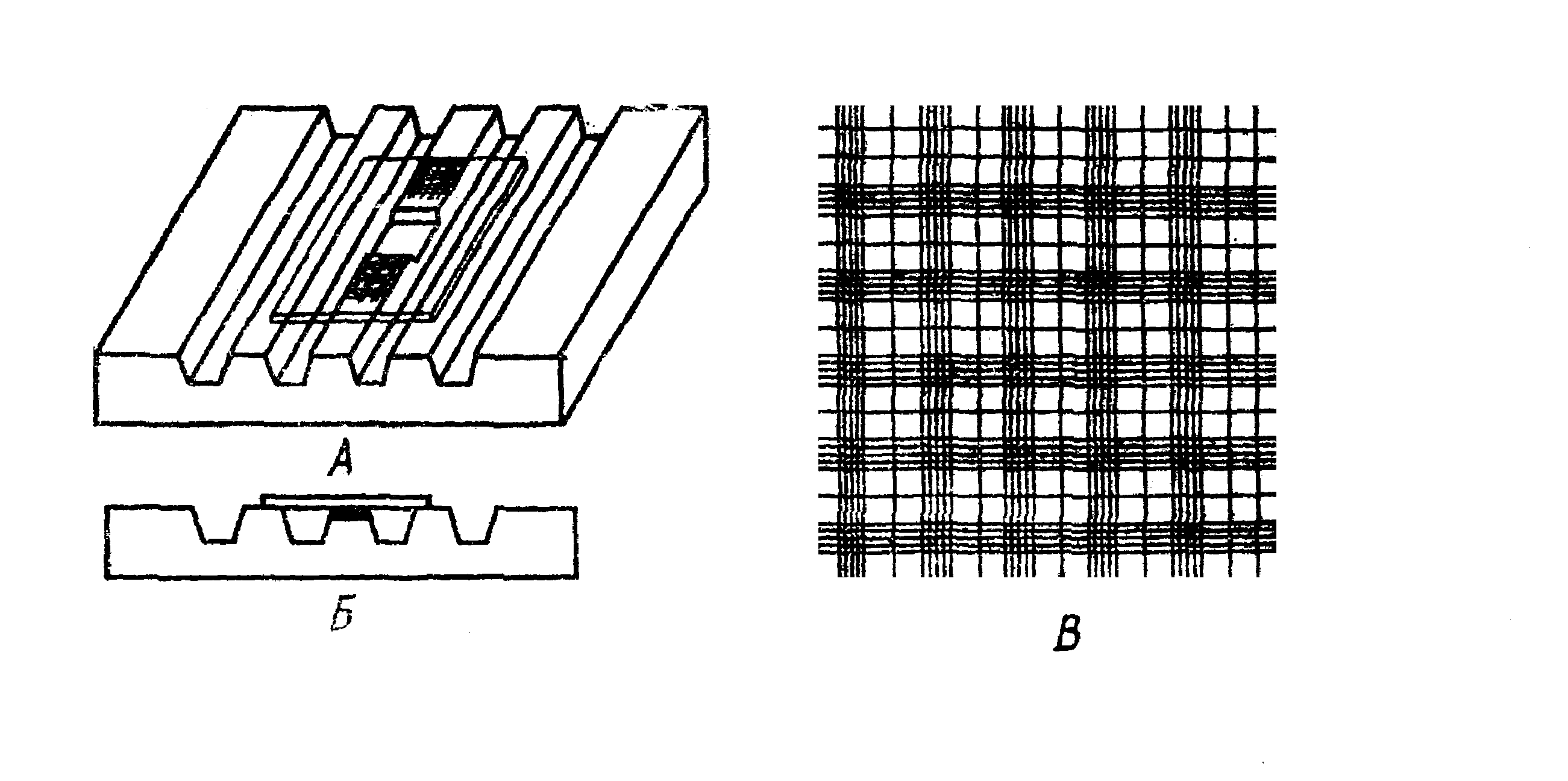
Материалы и оборудование:кровь, 2-3% р-рNaCl, микроскопы, счетные камеры Горяева, покровные стекла, игла, спирт, вата, меланжеры. Камера Горяева (рис. 6.) - толстое стекло, разделенное желобками на опорные пластинки. Средние опорные пластинки ниже боковых на 0,1 мм (глубина камеры). Поперечной канавкой средние опорные пластинки разделены пополам, на каждой части опорных пластинок нанесены сетки для подсчета кровяных телец. В каждой сетке камеры Горяева имеется 25 больших квадратов, каждый из которых состоит из 16 маленьких. Сторона одного малого квадрата равна 1/20 мм, площадь - 1/400, объем жидкости над малым квадратом равен 1/4000 мм3.
|
|
|
Рис. 6. Счетная камера Горяева: А - вид сверху; Б - вид сбоку; В - сетка камеры |
Смеситель (меланжер) для подсчета эритроцитов имеет деление 0,5; 1,0; 101 (в расширенной части смесителя имеется красная бусинка).
|
|
Рис. 7. Смеситель (меланжер) для разведения крови |
|
| |
Ход работы и техника подсчета:К камере Горяева притирают покровное стекло до появления радужных колец и под микроскопом знакомятся с сеткой.
В смеситель набирают кровь до метки 0,5 или 1,0. Обтерев кончик смесителя ваткой от приставшей к нему крови опустить его в 2-3% р-р поваренной соли и набрать его до метки 101 (если кровь была взята до метки 0,5; разбавление ее будет в 200 раз, а если до метки 1,0, то в 100 раз.)
Тщательно в течение 2-3 минут жидкость перемешивают, встряхивая меланжер, концы которого при этом зажимают 1 или 3 пальцами правой руки. Откладывают меланжер на 5-10 минут.
По прошествии этого времени после повторного перемешивания выпускают 2-3 капли раствора на ватку (т.к. они не содержат эритроцитов), а последующую каплю выпустить на среднюю опорную пластинку под притертое к камере покровное стекло, не допуская попадания пузырей воздуха.
Подсчет эритроцитов производится при большом увеличении (7*40) в 5 больших квадратах (каждый из них состоит из 16 маленьких). Рекомендуется подсчитывать эритроциты, расположенные внутри каждого маленького квадрата, а также на верхней и левой его сторонах. Подсчитав количество эритроцитов в 5 больших (или 80 маленьких квадратах), рассчитывают содержание эритроцитов в 1 мм3крови.
Для этого используют формулу:
|
Х= |
А* 4000 *200 (100) |
или А*10000 (5000 при разведении в 100 раз), где |
|
80 |
Х - содержание эритроцитов в 1 мм3 крови
А - количество эритроцитов, подсчитанных в 5 больших (80 маленьких) квадратах
1/4000 мм3- объем жидкости над одним маленьким квадратиком
200 или 100 - разбавление крови
80 - количество маленьких квадратов
Записать в тетрадь результаты подсчета.
Работа №2.Подсчет лейкоцитов.
Цель опыта.Отработать технику подсчета лейкоцитов.
Материалы и оборудование:микроскопы, счетные камеры Горяева, покровные стекла, смесители для лейкоцитов, 1% р-р уксусной кислоты с метиленовой синькой (жидкость Тюрка), скарификатор, спирт, вата.
Ход работы:Для подсчета лейкоцитов берется кровь в смеситель (до метки 0,5 или 1) и разбавляется в 10 или 20 раз жидкостью Тюрка (до метки 11). Тщательно перемешивают, встряхивая меланжер, концы которого при этом зажимают 1 или 3 пальцами правой руки. Откладывают меланжер на 10-15 минут для того, чтобы уксусная кислота разрушила эритроциты, а ядра лейкоцитов окрасились метиленовой синью.
По прошествии этого времени после повторного перемешивания выпускают 2-3 капли раствора на ватку и затем одну каплю в счетную камеру под покровное стеклышко. Подсчет лейкоцитов ведут в счетной камере Горяева под малым увеличением микроскопа в 100 неразграфленных больших квадратах. Большой квадрат равен 16 малым.
Техника подготовки камеры Горяева для подсчета лейкоцитов та же, что и для эритроцитов.
Расчет количества лейкоцитов в 1 мм3 крови ведут по формуле:
|
Х= |
А* 4000 *20 (10) |
или А*50 (25), где |
|
1600 |
А - количество лейкоцитов, сосчитанных в 100 больших квадратах
1/4000 мм3- объем жидкости над одним маленьким квадратом
20 (10) - разведение крови в 20 (или 10 раз)
1600 - количество малых квадратов в 100 больших квадратах.
Результаты подсчета записать в тетрадь.
Работа №3.Выведение лейкоцитарной формулы (лейкограммы).
При оценке физиологического состояния организма животных важное значение имеет не только подсчет общего количества лейкоцитов, но и определение процентного соотношения отдельных форм белых клеток крови - лейкоцитарной формулы.
Цель работы:Освоение метода подготовки мазков крови и проведение дифференциации лейкоцитов. Ознакомление с разными формами лейкоцитов. Выведение лейкоформулы (лейкограммы).
Материалы и оборудование:Животное, обезжиренные предметные стекла, стекла с шлифованным краем, краска Романовского-Гимзы, ванночка, колба с дистиллированной водой, 5% раствор йода, вата, марля, смесь спирта с медицинским эфиром, спирт этиловый, скарификатор, иммерсионное масло, окрашенные мазки крови, микроскоп, осветитель для микроскопа, счетчик для клеток, атлас клеток крови, окрашенные мазки крови.
Ход работы. Для приготовления мазка у животных берут кровь. Каплю крови наносят на край сухого обезжиренного предметного стекла, которое удерживают между большим и средним пальцами левой руки. Впереди капли под углом 45° подводят шлифованный край покровного стекла так, чтобы образовавшийся угол между стеклами был равномерно заполнен кровью. Движением правой руки от себя каплю распределяют тонким слоем по предметному стеклу (рис. 8.).
Хорошим мазком будет такой, в котором кровь располагается на поверхности стекла без просветов, в виде равномерной полоски, не выходящей за ее края.
|
|
Рис. 8. Приготовление мазка крови. |
Приготовленный мазок высушивают на воздухе и фиксируют; для этого его кладут в ванночку и наливают на него спирт метиловый на 3-5 мин, или смесь эфира с абсолютным этиловым спиртом 1:1 на 15-20 мин, или хлороформа на несколько секунд. Мазок извлекают из ванночки, высушивают и окрашивают одним из описанных ниже способов. Для окрашивания берут две стеклянные палочки, скрепляют их параллельно резиновыми трубками и кладут в виде подставки над ванночкой и кюветой. На подставке размещают фиксированные и высушенные препараты мазком кверху и окрашивают.
Окраска по Романовскому - Гимзе. Готовую краску предварительно разводят дистиллированной водой из расчета 1 мл на 2-3 капли краски. Полученную смесь наливают на мазок, держат 30-40 мин (в зависимости от температуры воздуха и активности краски), после чего ее смывают дистиллированной водой, а препарат высушивают. Хорошо окрашенный мазок будет розовато-фиолетового цвета, недокрашенный - розово-красного, а перекрашенный - темно-фиолетового цвета.
Окраска по Паппенгейму - Крюкову. Осуществляется в два приема без предварительной фиксации мазка, так как в состав краски входит фиксирующий реактив. В первый прием на сухой мазок наливают 2 мл готовой краски Май-Грюнвальда на 5 мин, а затем 2 мл дистиллированной воды и смешивают ее с краской при помощи пипетки. Через 2 мин эту смесь удаляют. Во второй прием, не высушивая, на мазок наливают краску Романовского-Гимзе на 20 мин, после чего смывают, ее дистиллированной водой и высушивают препарат на воздухе (при такой комбинированной окраске более четко просматриваются зернистость и структура ядра клеток).
На окрашенный мазок крови наносят каплю иммерсионного масла, помещают мазок на столик микроскопа и укрепляют в препаратоводителе. Обеспечивают хорошую освещенность поля зрения при широко открытой диафрагме и поднятом кверху до упора конденсоре. Под визуальным контролем в каплю иммерсионного масла погружают объектив X 90, с помощью микровинта добиваются лучшей видимости и резкости.
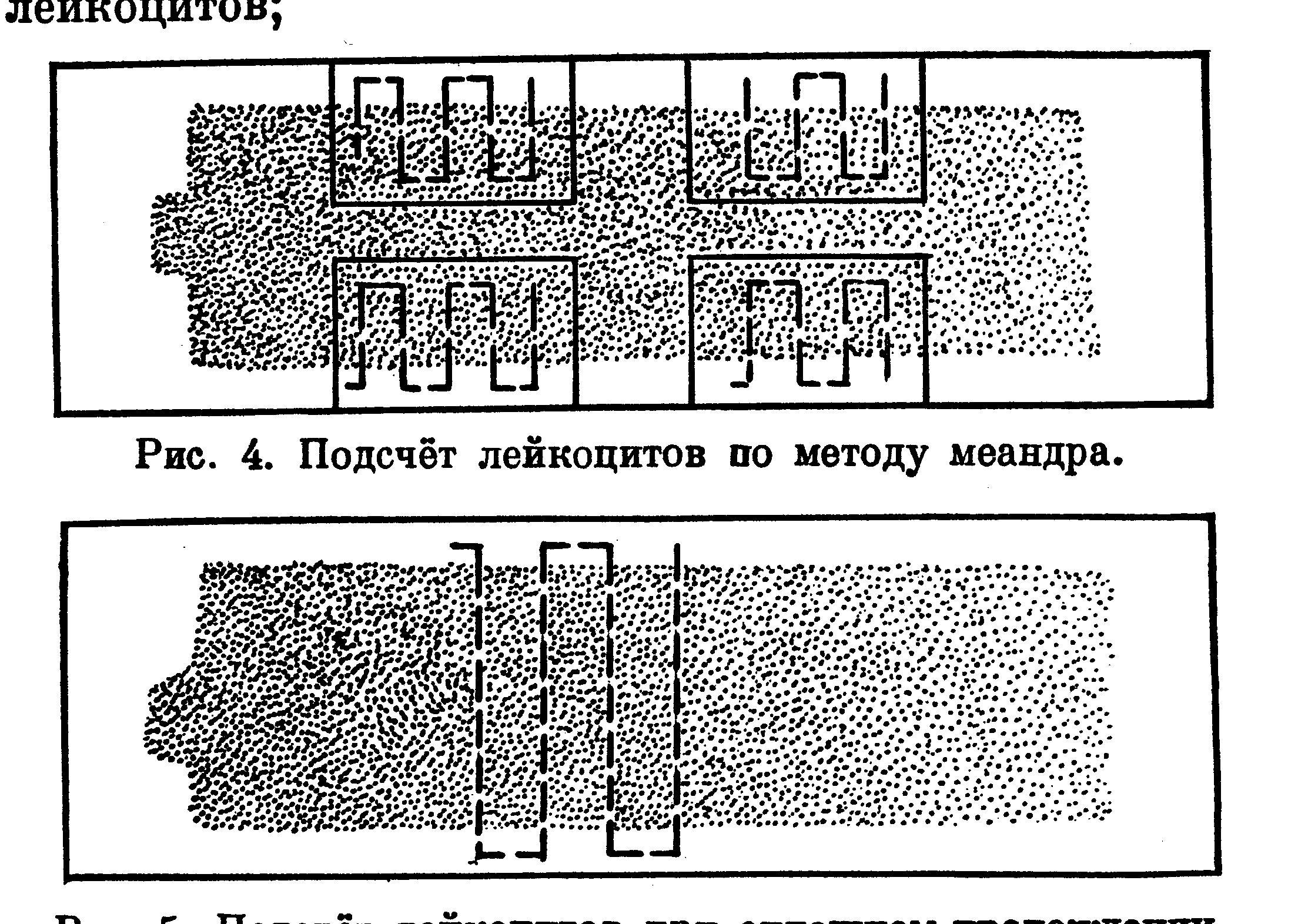
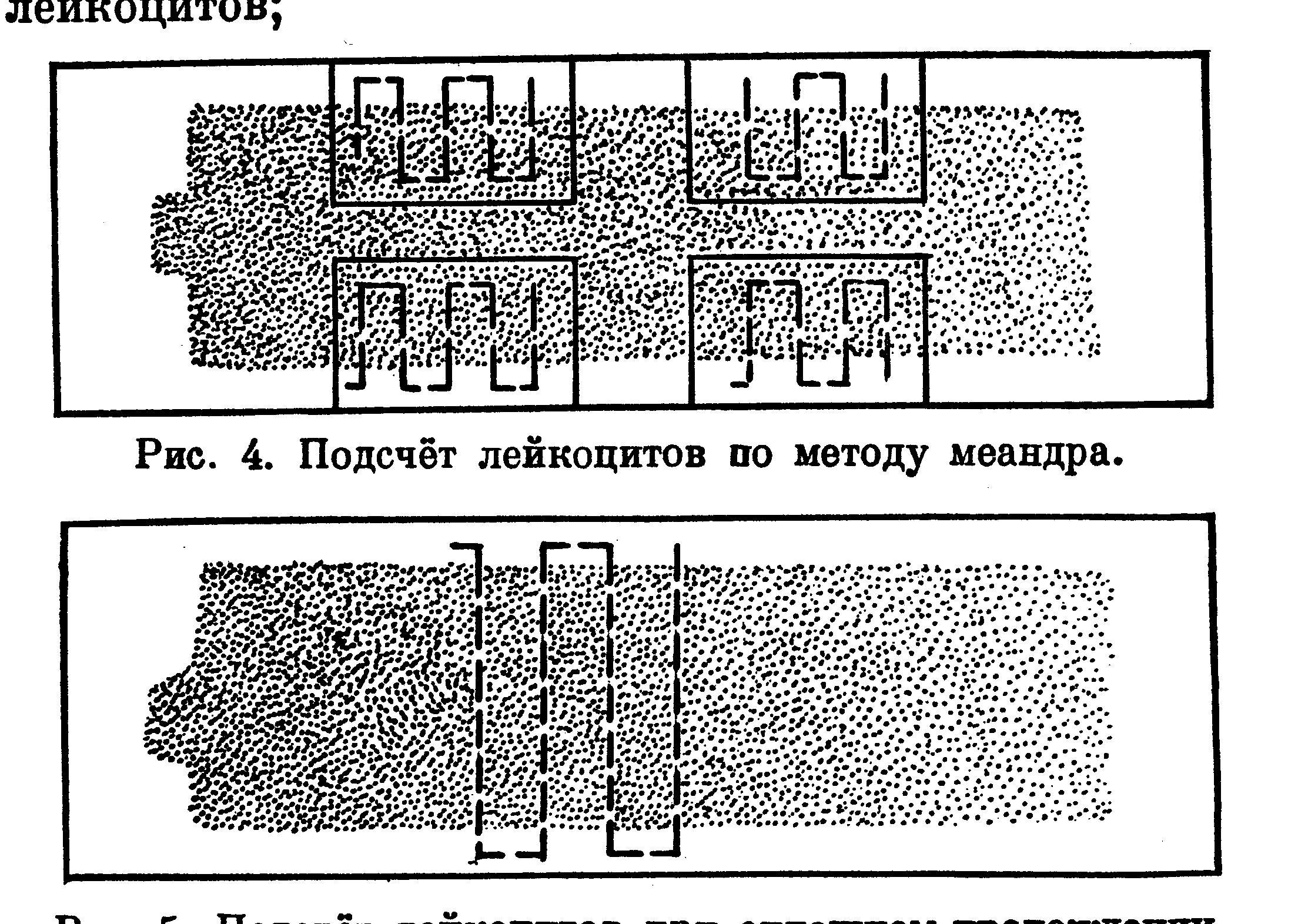
При подсчете лейкоцитов по методу меандра (рис. 9.) мазок условно делят на 4 участка. Затем, отступив от края мазка на 3-4 поля зрения, внимательно просматривают его зигзагообразно, то есть 3-5 полей - вдоль края мазка, затем 3-5 полей - под прямым углом к середине, далее 3-5 полей - параллельно краю мазка и снова под прямым углом возвращаются к краю мазка. В таком порядке микроскопируют каждый из условно разделенных участков. Данный способ подсчета не учитывает того, что на периферии мазка относительно больше гранулоцитов, а в глубине лимфоцитов. Поэтому, особенно у животных с лимфатическим и переходным профилем крови (корова, свинья, кролик, коза, овца, курица), лучше вести подсчет через всю ширину мазка (рис. 10.).
|
|
Рис. 9. Подсчет лейкоцитов по методу меандра |
|
|
Рис. 10. Подсчет лейкоцитов при сплошном прохождении полем зрения мазка |
Рассматривая клетки в мазке, необходимо для контроля сравнивать их с рисунками атласа. При изучении и дифференциации клеток белой крови обращают внимание на величину лейкоцитов, окраску протоплазмы, ее зернистую форму и строение ядра клетки.Для подсчета лейкоцитов можно использовать специальный счетчик, который имеет одиннадцать клавишей; на трех из них имеются цифры, а на восьми - буквы М, Ю, П, Э, соответствующие названию отдельных лейкоцитов (моноциты, юные, палочкоядерные, эозинофилы и т. д.). Над клавишами имеются смотровые окна. В последних, при нажатии соответствующей клавиши, появляются цифры, показывающие количество обнаруженных клеток. В крайнем окне справа автоматически откладывается сумма всех клеток. Как только будет подсчитано 100 лейкоцитоз, в счетчике возникает сигнал, извещающий об окончании подсчета.
Для большей достоверности результатов лучше подсчитать 200 клеток. После подсчета сумму каждого вида лейкоцитов делят пополам и получают процентное их содержание в %. Полученную лейкограмму у разных видов животных анализируют и делают выводы.
Работа №4. Подсчет тромбоцитов.
Цель работы:Знакомство с методом подсчета тромбоцитов в крови.
Материалы и оборудование:Микроскоп, счетная камера, смеситель для эритроцитов, скарификатор, спирт, йод, вата, раствор для определения количества тромбоцитов.
Ход работы:Набирают в меланжер для эритроцитов кровь до метки 0,5. Тотчас разбавляют ее раствором до метки 101 (разведение в 200 раз). Тщательно перемешивают, встряхивая меланжер, концы которого при этом зажимают 1 или 3 пальцами правой руки. Откладывают меланжер на 10-15 минут для того, чтобы тромбоциты окрасились метиленовой синью.
По прошествии этого времени после повторного перемешивания выпускают 2-3 капли раствора на ватку и затем одну каплю в счетную камеру под покровное стеклышко.
Подсчет тромбоцитов ведется под большим увеличением. При правильном соблюдении всех условий тромбоциты распределяются в камере равномерно между эритроцитами и имеют вид голубоватых глыбок. Подсчитывают их число в 25 больших квадратах и вычисляют количество тромбоцитов в 1 мм3крови по формуле:
|
Х= |
С* 4000 *200 |
или С*2000, |
|
25 *16 |
где С - число тромбоцитов в 25 больших квадратах (составляющих 25*16 = 400 маленьких квадратов).
Тема: БИОЛОГИЧЕСКИЕ СВОЙСТВА КРОВИ. ГЕМОГЛОБИН. СКОРОСТЬ ОСЕДАНИЯ ЭРИТРОЦИТОВ. СВЕРТЫВАНИЕ КРОВИ. ГРУППЫ КРОВИ.
Практические работы:
Определение количества гемоглобина по методу Сали.
Измерение СОЭ.
Определение свертываемости крови.
Определение группы крови.
Работа №1.Определение количества гемоглобина по Сали.
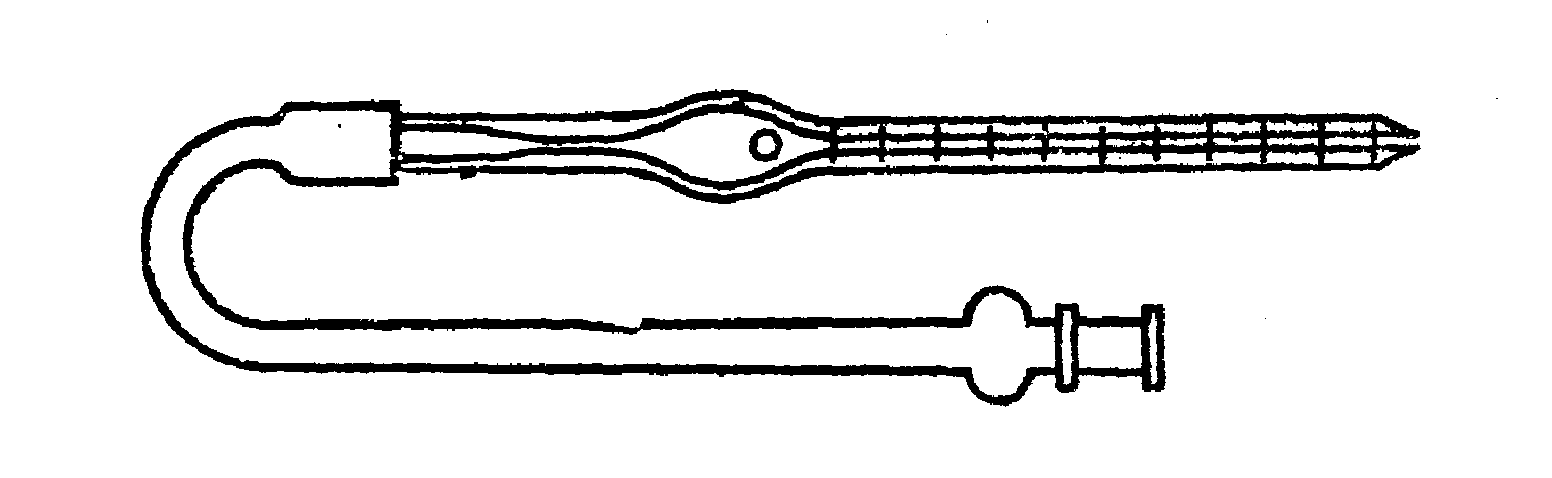
Материалы и оборудование:Гемометр Сали (рис. 11.), скарификатор, 0,1% раствор НCl, дистиллированная вода, капельница, вата, спирт.
Ход работы:в мерную пробирку наливают из капельницы 0,1% р-р НClдо первой метки.
|
|
Рис. 11. Гемометр Сали. 1 - корпус прибора; 2 - пробирки со стандартным раствором; 3 - градуированная пробирка; 4 - пипетка для взятия крови. |
|
|
|
Обработать ваткой со спиртом поверхность кожи (палец человека или вена уха кролика). После того как поверхность кожи высохнет, сделать укол и набрать кровь в капиллярную пипетку (прилагается к гемометру) до метки соответствующей 0,02 мл. Вытереть кончик капилляра чистой сухой ваткой. Осторожно опустить капилляр в мерную пробирку до соприкосновения капилляра с раствором соляной кислоты (до дна пробирки капилляр не опускать!!!). Аккуратно выдуть кровь в мерную пробирку (кровь должна образовать слой жидкости над раствором соляной кислоты) и опустив кончик капилляра до дна пробирки, промыть капилляр этим же раствором. Взболтать кровь с находящейся там соляной кислотой до появления коричневого окрашивания (коричневая окраска свидетельствует о гемолизе эритроцитов и образовании солянокислого гематина). Пробирку поставить в штатив на 5-10 минут, затем по каплям добавить в нее дистиллированной воды (образующуюся смесь необходимо регулярно перемешивать тонкой стеклянной палочкой) до выравнивания цвета
Результат читается по показаниям шкалы на мерной пробирке соответствующей уровню нижнего мениска смеси содержащейся в пробирке при достижении равенства окраски этой смеси с цветом стандартных пробирок.
Работа №2.Измерение СОЭ.
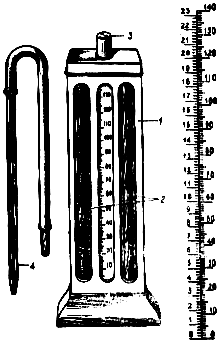
Материалы и оборудование:Кролик, аппарат и капилляр Панченкова (рис. 12), игла для взятия крови, цитратная кровь лошади, часовые стекла, 5% р-р лимоннокислого натрия.
Ход работы:Набирают в капилляр Панченкова 5% раствора лимоннокислого натрия до метки Р и выпускают на часовое стекло.
|
|
Рис. 12. Аппарат Панченкова |
Набирают дважды в одну пипетку кровь до метки К и каждый раз аккуратно выдувают ее в раствор лимоннокислого натрия на часовое стекло и тщательно перемешивают кончиком капилляра. Наполняют этой кровью капилляр до метки К и укрепляют его строго вертикально в штативе.
Через час проверить и записать результат оседания.
В один капилляр набрать цитратную кровь лошади для сравнения.
Сделать выводы.
Работа №3.Определение времени свертывания крови.
Свертывание крови - сложная защитно-приспособительная реакция организма, направленная на предупреждение кровопотери. Процесс свертывания осуществляется под влиянием многочисленных факторов, протекает с неодинаковой скоростью у разных видов животных.
Цель работы. Ознакомиться с методикой работы и определить скорость свертывания крови у животных.
Объект исследования, материалы и оборудование. Животные, инструменты для взятия крови, водяная баня, предметные стекла, секундомер, капроновая нить на палочке или стеклянный крючок), центрифужные пробирки, водяная баня, спирт этиловый, 5%-ный раствор йода, вата, марлевые салфетки.
Ход работы. Способ 1. Определение времени свертывания крови, заключается в том, что нагревают водяную баню до 37 °С. Над жидкостью вместо крышки водяной бани кладут подставку из двух стеклянных палочек, соединенных резиновыми трубками. На подставку помещают обезжиренное предметное стекло, на которое наносят 1-2 капли исследуемой крови, и замечают время. Через каждые 30 с в каплю погружают стеклянный крючок (или чистую сухую капроновую нить укрепленную подковообразно на деревянной палочке или спичке), делают 2 - 3 движения внутри капли и приподнимают. Как только за крючком (или нитью) начнут тянуться волокна образовавшегося фибрина, регистрируется время начала свертывания.
Способ 2. У животного берут кровь, 2 капли помещают на предметное стекло. При комнатной температуре через каждую минуту стекло наклоняют и наблюдают за каплей, повторяя этот прием до тех пор, пока кровь не свернется в сгусток и не перестанет изменять формы. Время от нанесения капли крови на стекло до превращения ее в сгусток будет соответствовать скорости окончания свертывания крови у опытного животного. У крупного рогатого скота кровь свертывается за 5-6 мин, у свиньи - за 10-15 мин, у лошади - за 8-10 мин,
Работа №4.Определение группы крови
Способ 1. Определение группы крови поликлональными иммунными моноспецифическими сыворотками.
Определяют группу крови методом иммунных антител. Набор сывороток-реагентов получают путем иммунизаций. Моноспецифическая сыворотка содержит иммунные антитела к одному какому-либо кровяному фактору группы крови.
Группы крови в течение всей жизни не меняются, определяются 1 раз и заносятся в карточку племенного животного.
В настоящее время у КРС обнаружены 100 факторов крови, у кур и свиней - по 60, у лошадей и овец - более 20.
Материал и оборудование:Скарификатор, спирт, вата, предметные стекла, стандартная сыворотка (I,II,III,IVгрупп), глазные пипетки (4 штуки), карандаш по стеклу, физиологический раствор.
Ход работы. Из только что полученной капли крови стеклянными палочками или уголками предметного стекла переносят небольшое количество крови в стандартные сыворотки (сыворотки по одной капле, заранее наносятся на предметное стекло или тарелку с подписанными номерами групп крови соответствующих сывороток) и содержимое перемешивают (обязательно теми же палочками или уголками предметного стекла). Соотношение объёмов сыворотки и крови должно быть около 10:1. По истечении 5-10 минут, покачивая предметное стекло (или тарелку), по агглютинации эритроцитов определяют группу крови. Агглютинация эритроцитов хорошо видна невооруженным глазом (имеет вид песка или комочков с зонами просветления).
Если агглютинация отсутствует во всех каплях, то испытуемая кровь принадлежит к Iгруппе. Если же агглютинация произошла в сывороткеIиIIгруппы и не произошла в сывороткеIII- кровьIIIгруппы. Если агглютинация произошла в сывороткеIиIIIгруппы и не произошла воII-IIгруппы. В случае агглютинации в трех сыворотках - кровьIVгруппы. В сывороткеIVгруппы агглютинация не происходит (контроль на отсутствие агглютинации).
Если в сыворотку добавлено большое количество крови - возможно образование сгустков затрудняющих выявление агглютинации. В этих случаях работу надо повторить или же добавить в смесь сыворотки и крови несколько капель физиологического раствора. Это же делают в тех случаях, когда агглютинация нечеткая.
Учитывая важность определения групп крови данное исследование должно выполняться с двумя комплектами сывороток из разных серий. А результат считается правильным, если данные, полученные с разными сериями сывороток, совпадут.
Записать результаты и сделать выводы.
Способ 2. Определение группы крови с помощью моноклональных антител (ЦОЛИКЛОНОВ Анти-А, Анти-В и Анти-АВ).
ЦОЛИКЛОНЫ Анти-А, Анти-В и Анти-АВ предназначены для определения (на плоскости: пластине или планшете) групп крови системы АВО в прямых реакциях гемагглютинации и применяются взамен или параллельно с поликлональными иммунными сыворотками.
Моноклональные Анти-А и Анти-В антитела принадлежат к иммуноглобулинам класса М. ЦОЛИКЛОНЫ (изготавливаются из асцитной жидкости мышей-носителей анти-А и анти-В гибридом). ЦОЛИКЛОН Анти-АБ является смесью моноклональных анти-А и анти-В антител.
Определение группы крови производится в помещении с хорошим освещением при комнатной температуре (15-25 °С). ЦОЛИКЛОНЫ выпускаются в жидкой форме (флаконы по 10 мл). Жидкость с Анти-А красного цвета, Анти-В - синяя и Анти-АВ - бесцветная.
Материал и оборудование:Скарификатор, спирт, вата, предметные стекла, комплект ЦОЛИКЛОНОВ с пипетками (или капельницами), карандаш по стеклу.
Ход работы.
Нанесите под соответствующими надписями на планшет или пластину индивидуальными пипетками ЦОЛИКЛОНЫ Анти-А, Анти-В и Анти-АВ по одной капле (около 0,1 мл).
Рядом с каплями антител нанесите по одной маленькой капле исследуемой крови (объём 0,01-0,03 мл).
Смешайте кровь с реагентом.
Наблюдайте за ходом реакции с ЦОЛИКЛОНАМИ визуально при легком покачивании пластины или планшета в течение 3 минут. Агглютинация эритроцитов с ЦОЛИКЛОНАМИ обычно наступает в первые 3-5 сек, но наблюдение следует вести 3 мин ввиду более позднего появления агглютинации с эритроцитами, содержащими слабые разновидности антигенов А или В.
Результат реакции в каждой капле может быть положительным или отрицательным. Положительный результат выражается в агглютинации (склеивании) эритроцитов. Агглютинация видна невооруженным глазом в виде мелких красных агрегатов, быстро сливающихся в крупные хлопья. При отрицательной реакции капля остается равномерно окрашенной в красный цвет, агглютинаты не обнаруживаются.
Интерпретация результатов реакции агглютинации исследуемой крови с ЦОЛИКЛОНАМИ представлена в таблице.
|
Результат реакции* с ЦОЛИКЛОНОМ: |
Исследуемая кровь принадлежит к группе** | ||
|
Анти-А |
Анти-В |
Анти-АВ | |
|
- |
- |
- |
0(I) |
|
+ |
- |
+ |
А(II) |
|
- |
+ |
+ |
В(III) |
|
+ |
+ |
+ |
АВ(IV) |
* Знаком плюс (+) обозначено наличие агглютинации, знаком минус (-) - отсутствие агглютинации
** Окончательно АВО принадлежность устанавливается по результатам перекрестного определения: антигенов А и В на эритроцитах и изогемагглютининов а сыворотке.
При наличии агглютинации со всеми тремя ЦОЛИКЛОНАМИ необходимо исключить спонтанную неспецифическую агглютинацию исследуемых эритроцитов. Для этого необходимо смешать на плоскости 1 каплю исследуемой крови с каплей физиологического раствора.
Кровь можно отнести к группе АВ (IV) только если и в физиологическом растворе (без ЦОЛИКЛОНОВ) агглютинации эритроцитов нет.
Записать результаты и сделать выводы.