
1Otvety_na_bilety_shpargalka
.doc|
1. ФЕРМЕНТЫ или энзимы - белки, выполняющие роль катализаторов в живых организмах. Осн. ф-ции ферментов- ускорять превращение в-в, поступающих в организм и образующихся при метаболизме (для обновления клеточных структур, для обеспечения его энергией и др.), а также регулировать биохим. процессы (напр., реализацию генетич. информации), в т. ч. в ответ на изменяющиеся условия. По рекомендации Международного биохимического союза, Ф. разделяют на 6 классов: 1) оксидоредуктазы, 2) трансферазы, 3) гидролазы, 4) лиазы, 5) изомеразы, 6) лигазы (синтетазы). Рекомендована следующая нумерация Ф. Шифр (индекс) каждого Ф. содержит 4 числа, разделённых точками. Первая цифра указывает класс, вторая – подкласс, третья – подподкласс, четвёртая – порядковый номер в данном подподклассе. Так, Ф. аргиназа, расщепляющий аргинин на орнитин и мочевину, имеет шифр 3.5.3.1, т. е. относится к классу гидролаз, подклассу Ф., действующих на непептидные С–N-cвязи, и подподклассу Ф., расщепляющих эти связи в линейных (не циклических) соединениях.
5. Аденозинтрифосфа́т— нуклеотид, играет исключительно важную роль в обмене энергии и веществ в организмах; в первую очередь соединение известно как универсальный источник энергии для всех биохимических процессов, протекающих в живых системах. Субстратное фосфорилирование - синтез богатых энергией фосфорных соединений за счёт энергии окислительно-восстановительных реакций Гликолиза (катализируемых фосфоглицеральдегиддегидрогеназой и енолазой) и при окислении α-кетоглутаровой кислоты в Трикарбоновых кислот цикле (под действием α-кетоглутаратдегидрогеназы и сукцинаттиокиназы). Для бактерий описаны случаи С. ф. при окислении пировиноградной кислоты. С. ф., в отличие от фосфорилирования в цепи переноса электронов (см. Окислительное фосфорилирование), не ингибируется «разобщающими» ядами (например, динитрофенолом) и не связано с фиксацией ферментов в мембранах митохондрий. Вклад С. ф. в клеточный фонд АТФ в аэробных условиях значительно меньше, чем вклад фосфорилирования в цепи переноса электронов. Окислительное фосфорилирование — один из важнейших компонентов клеточного дыхания, приводящего к получению энергии в виде АТФ. Субстратами окислительного фосфорилирования служат продукты расщепления органических соединений — белки, жиры и углеводы. Однако чаще всего в качестве субстрата используются углеводы. Так, клетки головного мозга не способны использовать для дыхания никакой другой субстрат, кроме углеводов. Коэффициент фосфорилирования В расчете на каждый атом поглощенного кислорода (или на каждую пару переносимых электронов) митохондрии образуют максимум три молекулы АТФ (т. е. связывают три молекулы Н3Р04 с АДФ). Отношение количества связанной Н3Р04к( Скачано с dsmahelp.org.ua) количеству поглощенного кислорода (О) называют коэффициентом фосфорили-рования и обозначают Р/О; следовательно, коэффициент Р/О < 3. ФАД-зависи-мые дегидрогеназы мембраны митохондрий не являются протонными насосами (см. рис. 8.4): в этом случае в цепи переноса электронов действуют только два пункта перекачки протонов — комплексы III и IV, и коэффициент Р/О не может быть больше двух.
10. Обмен гликогена Гликоген обнаруживается в цитоплазме и ядрах клеток в виде прозрачных капель. Он хорошо растворим в воде. Поэтому ткани, исследуемые па гликоген, необходимо предохранять от воздействия водных растворов и фиксировать в безводном спирте, ацетоне и др. Правильнее говорить не о гликогене, а о гликогенах с различной степенью полимеризации и растворимости. В связи с этим возникают трудности в гистохимическом его изучении. Непосредственно синтез гликогена осуществляют следующие ферменты: 1. Фосфоглюкомутаза – превращает глюкозо-6-фосфат в глюкозо-1-фосфат; 2. Глюкозо-1-фосфат-уридилтрансфераза – фермент, осуществляющий ключевую реакцию синтеза. Необратимость этой реакции обеспечивается гидролизом образующегося дифосфата; 3. Гликогенсинтаза – образует α1,4-гликозидные связи и удлиняет гликогеновую цепочку, присоединяя активированный С1 УДФ-глюкозы к С4 концевых остатков гликогена; 4. Амило-α1,4-α1,6-гликозилтрансфераза,"гликоген-ветвящий" фермент – переносит фрагмент с минимальной длиной в 6 остатков глюкозы на соседнюю цепь с образованием α1,6-гликозидной связи. Фермент фосфорилаза, регулирующий распад гликогена, существует в двух формах: неактивной фосфорилазы b и высокоактивной фосфорилазы a. Превращение неактивной фосфорилазы b в активную фосфорилазу a происходит в результате реакции переноса фосфатной группы с АТФ на OH-группу серина — одной из аминокислот в белковой цепи фермента. Для этой реакции переноса необходим еще один фермент — специфическая киназа, а также специфический кофактор — циклическая адениловая кислота. Подготовительным этапом при активации фосфорилазы является образование из АТФ циклической адениловой кислоты; эта реакция происходит при участии фермента аденилциклазы, связанной с мембранами клеток. Активность аденилциклазы стимулируется гормонами адреналином или глюкагоном. Благодаря этому сложному механизму оба гормона вызывают повышение содержания сахара в крови млекопитающих. Биологическое значение обмена гликогена в печени и мышцах Сравнение этих процессов позволяет сделать следующие выводы:
13. синтез глицерина Восстановлением ацетона был получен изопропиловый спирт СН3—СНОН—СН3, при отнятии воды дающий пропилен СН3—СН=СН2, который, присоединяя хлор, превращается в хлористый пропилен СН3—СНСl—СН2Сl; при действии на него хлора получается трихлорпропан (трихлоргидрин глицерина) СН2Сl—СНСl—СН2Сl, при нагревании с водой дающий глицерин. Глицерин может быть получен также осторожным окислением аллилового спирта перманганатом в щелочной среде. Окисление глицерина Глицерин сначала фосфорилируется с участием АТФ до глицерофосфата (3-фосфоглицерол). Затем под действием НАД-зависимой глицерофосфатдегидрогеназы окисляется до 3-фосфоглицеринового альдегида. Фосфоглицериновый альдегид далее может окисляться до пировиноградной и молочной кислоты. Распад глицерина. Значительная часть р-моноглицеридов, глицерина и свободных высших жирных кислот, освобождающихся при гидролизе триглицеридов, используется для ресинтеза триглицеридов же, но несколько иного состава и строения, характерного для того или иного организма (если для этого используются пищевые жиры) или органа (если идет перестройка жиров в пределах организма). Так как новообразованные жиры неизбежно отличаются от распавшихся триглицеридов по строению и соотношению остатков высших жирных кислот (в соответствии с их видовой или тканевой специфичностью), то часть высших жирных кислот и некоторая доля глицерина подвергаются дальнейшей деструкции. Глицерин независимо от того, поступил ли он на ресинтез жиров или будет претерпевать дальнейший распад, прежде всего фосфорилируется. Донором остатка фосфорной кислоты в этой реакции служит АТФ. Процесс ускоряется соответствующей фосфотрансферазой. Глицерофосфат в основном идет на синтез новых молекул триглицеридов, но часть его окисляется с образованием диоксиацетон-фосфата
17.КЕТО́НОВЫЕ ТЕЛА́— группа продуктов обмена веществ, которые образуются в печени из ацетил-КоА:1.ацетон (пропанон) [H3C—CO—CH3] 2.ацетоуксусная кислота (ацетоацетат) [H3C—CO—CH2—COOH]3.бета-гидроксимасляная кислота [H3C—CHOH—CH2—COOH] Ацетон в плазме крови в норме присутствует в крайне низких концентрациях, образуется в результате спонтанного декарбоксилирования ацетоуксусной кислоты и не имеет определённого физиологического значение.Нормальное содержание кетоновых тел в плазме крови составлет 1…2 мг% (по ацетону).Кетоновые тела синтезируются в печени из ацетил-КоА: На первом этапе из двух молекул ацетил-КоА синтезируется ацетоацетил-КоА. Данная реакция катализируется ферментом ацетоацетил-КоА-тиолазой. Ac—КоА + Ac—КоА → H3C—CO—CH2—CO—S—КоА Затем под влиянием фермента оксиметилглутарил-КоА-синтазы присоединяется ещё одна молекула ацетил-КоА. H3C—CO—CH2—CO—S—КоА + Ac—КоА → HOOC—CH2—COH(CH3)—CH2—CO—S—КоА Образовавшийся β-окси-β-метилглутарил-КоА способен под действием фермента оксиметилглутарил-КоА-лиазы расщепляться на ацетоуксусную кислоту и ацетил-КоА. HOOC—CH2—COH(CH3)—CH2—CO—S—КоА → H3C—CO—CH2—COOH + Ac—КоА Ацетоуксусная кислота способна восстанавливаться при участии НАД-зависимой D-β-оксибутиратдегидрогеназы; при этом образуется D-β-оксимасляная кислота. Фермент специфичен по отношению к D-стереоизомеру и не действует на КоА-эфиры. H3C—CO—CH2—COOH + NADH → H3C—CHOH—CH2—COOH Ацетоуксусная кислота в процессе метаболизма способна окисляться до ацетона с выделением молекулы углекислого газа: H3C—CO—CH2—COOH → CO2 + H3C—CO—CH3 Биологическая роль В плазме крови здорового человека кетоновые тела содержатся в весьма незначительных концентрациях. Однако при патологических состояниях концентрация кетоновых тел может значительно повышаться и достигать 20 ммоль/л (кетонемия). Кетонемия возникает при нарушении равновесия — скорость синтеза кетоновых тел превышает скорость их утилизации периферическими тканями организма. Кетоновые тела — топливо для мышечной ткани, почек и действуют, вероятно, как часть регуляторного механизма с обратной связью, предотвращая излишнюю мобилизацию жирных кислот из жировых депо. Во время голодания кетоновые тела являются одним из основных источников энергии для мозга
21.Дезаминирование аминокислот. Доказано существование 4 типов дезаминирования аминокислот (отщепление аминогруппы). Выделены соответствующие ферментные системы, катализирующие эти реакции, и идентифицированы продукты реакции. Во всех случаях NH2-группа аминокислоты освобождается в виде аммиака:
Реакция синтеза глутаминовой кислоты:
Аланин вступает в реакцию трансаминирования. Образованный в результате реакции пируват идет в глюконеогенез или энергетический обмен. Параллельно образуется глутаминовая кислота. Пришедшая из крови или полученная при трансаминировании глутаминовая кислота дезаминируется глутаматдегидрогеназой.
25. Нуклеоти́ды — фосфорные эфиры нуклеозидов, нуклеозидфосфаты. Соединения, состоящие из двух нуклеотидовых молекул, называются динуклеотидами, из трёх — тринуклеотидами, из небольшого числа — олигонуклеотидами, а из многих — полинуклеотидами, или нуклеиновыми кислотами. 1. Выступают в роли коферментов (ФАД, ФМН, НАД+, НАДФ+) 2.Циклические мононуклеотиды являются вторичными посредниками при действии гормонов и других сигналов(цАМФ, цГМФ). 3. Аллостерические регуляторы активности ферментов. 4. Являются мономерами в составе нуклеиновых кислот, связанные 3'-5'- фосфодиэфирными связями. Синтез пуриновых нуклеотидов: Может осуществляться двумя путями: заново и путем повторного использования готовых пуриновых оснований. Регуляция синтеза: 1. избыток ИМФ, АМФ и ГМФ алоостерически ингибируют фосфорибозиламидотрансферазу 2. ГМФ и АМФ ингибируют первые этапы своих собственных синтезов из ИМФ 3. Увеличение ГТФ приводит к активации синтеза АМФ, а накопление АТФ стимулирует синтез ГМФ, что приводит к балансу образования адениловых и гуаниловых нуклеотидов.
29. Адреналин(L-1(3,4-Диоксифенил)-2-метиламиноэтанол) — основной гормон мозгового вещества надпочечников, а также нейромедиатор. По химическому строению является катехоламином. Адреналин содержится в разных органах и тканях, в значительных количествах образуется в хромаффинной ткани, особенно в мозговом веществе надпочечников. Секреция адреналина надпочечниками и выброс его в кровь усиливаются в ситуациях, требующих быстрых адаптивных перестроек обмена веществ. В связи с этим адреналин проявляет себя гл. обр. как вещество, изменяющее течение обменных процессов: он вызывает повышение потребления кислорода, концентрации глюкозы в крови и пр. В других ситуациях надпочечники увеличивают секрецию и выброс в кровь норадреналина. Aдреналин производится в моменты возбуждения. адреналин ускоряет обмен веществ и помогает в расщеплении жиров, высвобождая из них энергию. Он запускает особый механизм, называемый «термогенезис» - повышение температуры тела, вызываемое сгоранием энергетических запасов организма. Кроме этого, выброс адреналина обычно подавляет аппетит.К сожалению, чем больше вес человека, тем ниже у него производство адреналина.
33.
Аэробный
обмен ПВК. В
аэробных условиях пировиноградная
кислота окисляется; этот процесс
называется окислительным
декарбоксилированием пировиноградной
кислоты. Катализирует этот процесс
мультиэнзимный комплекс, который
называется пируватдегидрогеназным
комплексом. В состав этого комплекса
входят три фермента и пять коферментов.
Первый этап аэробного превращения
ПВК заключается в ее декарбоксилировании,
катализируемом пируватдекарбоксилазой
(E1), коферментом которой является
тиаминпирофосфат. В результате
образуется оксиэтильный радикал,
ковалентно связанный с коферментом.
Фермент, ускоряющий второй этап
окислительного декарбоксилирования
ПВК, - липоат-ацетилтрансфераза содержит
в своем составе два кофермента: липоевую
кислоту и коэнзим A (KoASH). Происходит
окисление оксиэтильного радикала в
ацетильный, который сначала акцептируется
липоевой кислотой, а затем переносится
на KoASH. Результатом второго этапа
является образование
Превращения
ацетил-КоА начинаются с реакции
конденсации его со щавелевоуксусной
кислотой, в результате которой
образуется лимонная кислота. Эта
реакция не требует расхода АТФ, так
как необходимая для этого процесса
энергия обеспечивается гидролизом
тиоэфирной связи с ацетил-КоА, которая,
как мы уже отмечали, является
макроэргической:
37. В процессе расщепления и дальнейшего превращения глюкозы в печени образуются жирные кислоты и глицерин. Жирные кислоты (часть из них в виде триглицеридов, а часть в свободном виде) выделяются в кровь и транспортируются в депо жировой ткани, например, в подкожную жировую клетчатку, и откладываются там. При избыточном поступлении сахара в организм может повыситься содержание жира в крови (гиперлипидемия), и он в большей степени откладывается в жировых депо.Источниками ресинтеза глюкозы также служат глицерин, образующийся при обмене липидов, и некоторые промежуточные продукты цикла Кребса – лимонная, кетоглутаровая, но в большей степени щавелевоуксусная кислоты.Обмен глюкозы частично осуществляется и через образование глюкуроната (глюкуронатный цикл), который посредством промежуточных стадий ксилулозо-5-фосфата взаимосвязан с гексозомонофосфатным циклом. Глюкуронатный цикл у всех млекопитающих, кроме человека и морской свинки, является местом эндогенного образования аскорбиновой кислоты (витамин С). Глюкуронаты образуются в толстой кишке в процессе бактериального расщепления полисахаридов, поступают в печень, где и включаются в глюкуронатный цикл.
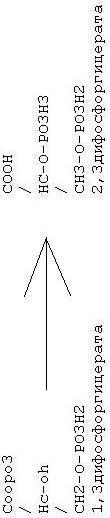
41. Эритроциты – специализированные клетки крови, которые обеспечивают транспорт О2, благодаря наличию в них гемоглобина. В отличии от остальных клеток эритроциты не имеют ядра, митохондрий и рибосом. Поэтому в них не синтезируются белки и нуклеиновые кислоты, отсуцтвует тканевое дыхание и окислительное фосфорилирование, не окисляются жирные кислоты. Жизнедеятельность эритроцита обеспечивается за счет окисления глюкозы. При этом 90% глюкозы распадается путем гликолиза, а 10% в пентозо-фосфатном пути. Поскольку в эритроцитах нет митохондрий, гликолиз заканчивается образованием лактата. Значение гликолиза для эритроцитов. Являются источником АТФ для работы К+, Na+ - АТФазы, которая обеспечивает градиент ионов К+ и Na+ для поддержания структуры эритроцитов. Являются источником 2,3-дифосфоглицерата,который снижает сродство гемоглобина к О3. Образуется из метаболита 1,3дифосфоргицерата.
Является источником НАДН, водород который используется ферментами метгемобинредуктазой. Метгемоглобин образуется в эритроцитах в результате окисления двухвалентного железа в ставе гемоглобина в трехвалентное под действием различных окислителей в том числе кислорода: HbFe+O2=МетHbFe(OH)+O2 Метгемоглобин не присоединяет кислород, но его образование происходит постоянно. Специальный фермент- метгемогобинредуктаза-производит всстановление МетНbFe2+ в нормальоный HbFe3+ с использованием гликолитического НАДН МетHb(Fe2+ )+НАДН---Hb(Fe3+ )+НАД+ Значение пентозно-фосфатного пути для эритроцитов: Является источником НАДФн, водород который используется для работы антиокислительной системы эритроцитов, в частности фермента глутатионпродуктазы. Антиоксидантная система направлена на борьбу с гемолизом эритроцитов, который может наступить при действии большого количества окисляющих веществ на мембраны. В состав этой системы входят ферменты: супероксиддисмутаза, каталаза, глутатионпероксидаза, глутатионпредуктаза. Супероксиддисмутаза обеспечивает защиту от супероксидных ионов, вызывающих свободнорадикальные процессы, которые стимулируют перекисное окисление мембранных фосфолипидов, приводящее к повреждению мембраны и гемолизу эритроцитов. Супероксидные ионы легко окисляются и восстанавливаются, т. Е. отдают и принимают электрон, что используется супероксиддисмутазой для обезвреживания О2+О2+Н2=О2+Н2О2 Каталаза-обеспечивает защиту эритроцитов от Н2О2 т. К. каталаза катализирует ее распад. 2Н2О2-----2Н2О+О2 Глутатиопероксидаза защищает эритроциты от перекисного окисления мембран т. К. обеспечивает расщепление органических и неорг перекисей. Фермент содержит в качестве кофермента трипептид глутатион.
|
2.Ферментопатии — болезни и патологические состояния, обусловленные полным отсутствием синтеза ферментов или стойкой функциональной недостаточностью ферментных систем органов и тканей. Среди врожденных ферментопатий наиболее часто встречается недостаточность дисахаридаз (лактазы, сахаразы, изомальтазы и др.), пептидаз (глутеновая энтеропатия), энтерокиназы. Приобретенные ферментопатии могут быть следствием токсического воздействия ксенобиотиков и мутагенов внешней среды, они ответственны за многообразные проявления так называемые экопатологии человека. Приобретенные ферментопатий наблюдаются при заболеваниях (хронический энтерит, болезнь Крона, дивертикулез с дивертикулитом и др.) и резекции тонкой кишки, заболеваниях других органов пищеварения (панкреатит, гепатит, цирроз печени) и органов эндокринной системы (диабет, гипертиреоз), а также при приеме некоторых лекарственных препаратов (антибиотики, цитостатики и др.) и облучении. Активность фермента выражают количеством субстрата, превращенного ферментом в единицу времени при оптимальных для фермента условиях. Витамин В2, рибофлавин. Коферментная форма: ФМН и ФАД. Витамин В3, пантотеновая кислота. Коферментная форма - КоА. Витамин В5 (PP), никотиновая кислота. Коферментная форма: НАД и НАДФ. Витамин В12 имеет две коферментные формы: метилкобаламин и 5 - дезоксиаденозилкобаламин.
6. Общие пути катаболизма. Катаболизм – расщепление и окисление сложных органических молекул до более простых конечных продуктов. Оно сопровождается высвобождением энергии, заключенной в сложной структуре веществ. Большая часть высвобожденной энергии рассеивается в виде тепла. Меньшая часть этой энергии "перехватывается" коферментами окислительных реакций НАД и ФАД, некоторая часть сразу используется для синтеза АТФ. Следует заметить, что атомы водорода, высвобождаемые в реакциях окисления веществ, могут использоваться клеткой только по двум направлениям: на анаболические реакции в составе НАДФН. на образование АТФ в митохондриях при окислении НАДН и ФАДН2 . Весь катаболизм условно подразделяется на три этапа: I этап Происходит в кишечнике (переваривание пищи) или в лизосомах при расщеплении уже ненужных молекул. При этом освобождается около 1% энергии, заключенной в молекуле. Она рассеивается в виде тепла. II этап Вещества, образованные при внутриклеточном гидролизе или проникающие в клетку из крови, на втором этапе обычно превращаются в пировиноградную кислоту, ацетильную группу (в составе ацетил-S-КоА) и в некоторые другие мелкие органические молекулы. Локализация второго этапа – цитозоль и митохондрии. Часть энергии рассеивается в виде тепла и примерно 13% энергии вещества усваивается, т.е. запасается в виде макроэргических связей АТФ. III этап Все реакции этого этапа идут в митохондриях. Ацетил-SКоА включается в реакции цикла трикарбоновых кислот и окисляется до углекислого газа. Выделенные атомы водорода соединяются с НАД и ФАД и восстанавливают их. После этого НАДН и ФАДН2 переносят водород в цепь дыхательных ферментов, расположенную на внутренней мембране митохондрий. Здесь в результате процесса под названием "окислительное фосфорилирование" образуется вода и главный продукт биологического окисления – АТФ. Часть выделенной на этом этапе энергии молекулы рассеивается в виде тепла и около 46% энергии исходного вещества усваивается, т.е. запасается в связях АТФ и ГТФ.
11. Пентозо-фосфатный путь расщепления глюкозы: протекает в цитоплазме клеток и включает две стадии: 1) окислительная 2)неокислительная. В ходе окислительноо этапа образуются НАДФН, а также фосфорилированные пентозы. Неокислительная стадия: в ней происходит превращение пентоз, при этом образуются промежуточные продукты С3,С4,С6 углеродных атомов. В пентозо-фосфатном пути, в который вступают 6 молекул глюкозы, одна расщепляется до СО2, а остальные регенирируются. Окислительная стадия: 1. Глюкозо-6-фосфат + 6 НАДФ = 6-Фосфоглюко-нолактон + 6 НАДФН + 6Н+ 2. 6-Фосфоглюконолактон=6-Фосфоглюконат 3. 6-Фосфоглюконат + 6 НАДФ=6 Риболозо-5-фосфат + 6 НАДФН + 6 H+ + 6CO2 4. 2 Рибулозо-5-фосфат=2 Рибозо-5-фосфат 5. 4 Рибулозо-5-фосфат = 4 2-Ксилулозо-5-фосфат Значение пентозо-фосфатного пути: Образование пентозы используется для синтеза нуклеотканных коферментов, мононуклеотидов( АМФ, УМФ, ЦМФ, ТМФ) и нуклеиновых кислот. Пентозо-фосфатный путь сост. 50% НАДФН необходимого организму. ПФП наиболее активен в печени, жировой ткани, коре надпочечников, щитовидной железе, эритроцитах.
14. Триглицериды синтезируются в стенке кишечника, в печени и жировой ткани (в адипоцитах). Синтез триглицеридов в стенке кишечника может происходить из моноглицерида (из 2-моноацилглицерола) и двух молекул активных жирных кислот (остатки жирных кислот в комплексе с ацилпереносящим энзимом – S-КоА), или из глицерина и трех молекул активных жирных кислот с участием АТФ, что более характерно для процессов в печени и жировой ткани. Синтез жира из глицерина и жирных кислот в печени и жировой ткани происходит по следующему пути. Глицерин фосфорилируется с использованием АТФ до глицерофосфата (фермент глицеролкиназа), затем под действием фермента глицеролфосфатацилтрансферазы взаимодействует с двумя молекулами ацилкоэнзима-А (например, с пальмитил-КоА). Образуется фосфатидная кислота (3-фосфо-1,2-диацилглицерол). При взаимодействии последней с ацилкоэнзимом-А образуется триглицерид, свободный HS-КоА и остаток ортофосфорной кислоты. Печень – основной орган, где идет синтез жирных кислот из продуктов гликолиза. Основной путь синтеза триглицелидов в печени из жирных кислот и глицерофосфата. Глицерофосфат, в свою очередь, в печень поступает из гидролиза жиров, а так же при восстановлении диоксиацетонфосфата (из гликолиза) при помощи восстановленного НАДФ (НАДФ Н+Н). Распад триацилглицеринов активируется ферментом — тканевой липазой.
18.Транспортные формы липидов. в плазме крови находятся липопротеиновые частички, которые являются транспортной формой липидов в организме человека, то есть они осуществляют движение холестерина и триглицеридов по нашему организму. В тоже время, отдельные липопротеины обладают способностью захватывать избыточный холестерин из клеток периферических тканей и транспортировать его в печень, где происходит окисление его до жирных кислот и дальнейшее выведение из организма. Кроме того, липопротеины транспортируют по нашему организму жирорастворимые гормоны и витамины. Существуют несколько видов липопротеинов, которые отличаются друг от друга по степени плотности: очень низкой плотности – пре-бета-липопротеины; низкой плотности – бета-липопротеины; высокой плотности – альфа-липопротеины. Липиды являются третьим классом органических веществ из которых состоит живой организм. Правильный качественный и количественный состав липидов клетки определяет ее возможности, активность и выживаемость. Жирнокислотный состав мембранных фосфолипидов, недостаток или избыток холестерола в мембране неизбежно влияет на деятельность мембранных белков – транспортеров, рецепторов, ионных каналов. Все это влечет за собой изменение работы клеток и, конечно, функций всего органа, как например, при инсулиннезависимом сахарном диабете. Существуют наследственные болезни накопления липидов липидозы, сопровождающиеся тяжелыми нарушениями в организме.
22.Пути образования аммиака: 1. окислительное дезаминирование глутаминовой кислоты 2. распад пуриновых и пиримидиновых нуклеотидов, нуклеозидов, азотистых оснований. 3. окисление аминов 4. распад аминосахаридов 5 гидролиз глутамина, аспарагина Обезвреживание аммиака в организме. В организме человека подвергается распаду около 70г аминокислот в сутки: при этом освобождается большое количество аммиака, являющегося высокотоксичным соединением. Поэтому крнцентрация аммиака должна сохраняться на низком уровне (в норме уровень его не превышает 60 мкмоль/л). Концентрация аммиака 3 ммоль/л является летальной. Одним из путей связывания и обезвреживания аммиака в мозге, сетчатке, почках и мышцах, является биосинтез глутамина( и, возможно, аспарагина). Поскольку глутамин и аспарагин с мочой выделяются в небольших количествах, было высказано предположение, что они выполняют скорее транспортную функцию переноса аммиака в нетоксичной форме. Часть аммиака легко связывается с ?-кетоглутаровой кислотой благодаря обратимости глутаматдегидрогеназной реакции; при синтезе глутамина связывается ещё 1 молекула, т.о. нейтрализуются две молекулы аммиака. Гиперамонемия -результат печеночной недостаточности.
Остаточный азот в крови: Это азот, который определяется в плазме крови после осаждения и отделения всех белков плазмы. Его содержание 15-25 моль/л. Его состав: 50% азот мочевины, 25% АК, 4% мочевой кислоты, 5% креатина, 0,5% аммиака. При ряде пат. состояний уровень остаточного азота в крови повышается, что называется азотемией.В зависимости от происхождения различают ретеционную и продукционную азотемию.
26.Распад пуриновых нуклеотидов Основным продуктом распада пуриновых нуклеотидов является мочевая кислота, которая выводится мочой. Кроме того образуются аммиак и пентозы: 1. Внутриклеточная нуклеиновая кислоты распадаются под влиянием нуклеоз до нуклеотидов. 2. Нуклеотиды под воздействием нуклеотидаз превращаются в нуклеозиды. 3. Аденозин превращаются в ионозин. 4. Нуклеозидфосфорилаза разрезает диозин или гуадозин на рибозо-1-фосфат и азотистое основание –гипоксантин или гуанин. 5. Гуанин дезаминируется в ксантин. 6. Гипоксантин и ксантин окисляются, кеантиноксидазой в мочевую кислоту. Гиперурикемия — повышенное содержание мочевой кислоты в крови. Причины Гиперурикемия вызывается ускоренным образованием мочевой кислоты из-за участия пурина в обмене веществ, или из-за ослабленной работы почек, или из-за повышенного содержания фруктозы в пище. Потребление богатой пурином пищи — это одна из основных причин гиперурицемии. Другая вызываемая едой причина — это потребление высококалорийной и жирной пищи и голодание. Результатом голодания бывает то, что для получения энергии начинает тратиться мышечная масса тела и высвобождаемые в процессе этого пурины попадают в кровообращение. Содержание пуриновых оснований в пище различно. Еда с высоким содержанием пуриновых оснований аденина и гипоксантина способствуют усилению гиперурицемии. Человеку необходима урата оксидаза, энзим, который разрушает мочевую кислоту. Повышение уровня мочевой кислоты увеличивает предрасположенность к подагре и (при очень высоком уровне) почечной недостаточности. Независимо от обычных отклонений (с генетической составляющей), синдром распада новообразования[5] вырабатывает критическое содержание мочевой кислоты, что почти всегда приводит к почечной недостаточности. Синдром Лёша-Нихена также взаимосвязан с критически высокими уровнями мочевой кислоты. Метаболический синдром часто представлен гиперурицемией. Аллопуринол — лекарственный препарат, используемый в основном при гиперурицемии (повышенном уровне мочевой кислоты в крови) и её осложнений, таких как подагра. Механизм действия Аллопуринол является ингибитором ксантиноксидазы. Под действием ксантиноксидазы аллопуринол превращается в оксипуринол, неокисляемый аналог ксантина. Аллопуринол является структурным изомером гипоксантина (природный пурин встречающийся в теле). Ксантиноксидаза отвечает за последующее окисление гипоксантина и ксантина, образуя мочевую кислоту - продукт метаболизма пуринов в теле. В добавок к блокированию производства мочевой кислоты, ингибирование ксантина оксидазы вызывает увеличение гипоксантита и ксантина, которые конвертируется в родственный пурину рибонуклеотиду аденозин и гуанозин монофосфаты. Увеличение уровня этих рибонуклеотидов вызывает обратное ингибироивание амидофосфорибозилтрансфераза,первый и скоростьлимитирующий энзим синтеза рибонуклеотидов.
30.Инсулин. Молекула инсулина, содержащая 51 аминокислотный остаток, состоит из двух полипептидных цепей, соединенных между собой в двух точках дисульфидными мостиками. В настоящее время принято обозначать цепью А инсулина 21-членный пептид и цепью В – пептид, содержащий 30 остатков аминокислот. Во многих лабораториях осуществлен, кроме того, химический синтез инсулина. Наиболее близким по своей структуре к инсулину человека является инсулин свиньи, у которого в цепи В вместо треонина в положении 30 содержится аланин. Синтезированный из проинсулина инсулин может существовать в нескольких формах, различающихся по биологическим, иммунологическим и физико-химическим свойствам. Различают две формы инсулина: 1) свободную, вступающую во взаимодействие с антителами, полученными к кристаллическому инсулину, и стимулирующую усвоение глюкозы мышечной и жировой тканями; 2) связанную, не реагирующую с антителами и активную только в отношении жировой ткани. В настоящее время доказано существование связанной формы инсулина и установлена локализация ее в белковых фракциях сыворотки крови, в частности в области трансферринов и α-глобулинов. Молекулярная масса связанного инсулина от 60000 до 100000. Различают, кроме того, так называемую форму А инсулина, отличающуюся от двух предыдущих рядом физико-химических и биологических свойств, занимающую промежуточное положение и появляющуюся в ответ на быструю, срочную потребность организма в инсулине. Механизм действия инсулина окончательно не расшифрован, несмотря на огромное количество фактических данных, свидетельствующих о существовании тесной и прямой зависимости между инсулином и процессами обмена веществ в организме. В соответствии с «унитарной» теорией все эффекты инсулина вызваны его влиянием на обмен глюкозы через фермент гексокиназу. Новые экспериментальные данные свидетельствуют, что усиление и стимуляция инсулином таких процессов, как транспорт ионов и аминокислот, трансляция и синтез белка, экспрессия генов и др., являются независимыми. Это послужило основанием для предположения о множественных механизмах действия инсулина.
34.Участь метаболіт ЦТК у синтезі амінокислот, гему. Приклади цих реакцій. Синтез тетрагидропиррольных колец начинается в митохондриях. Из сукцинил-КоА , промежуточного продукта цитратного цикла, конденсацией с глицином получается продукт, декарбоксилирование которого приводит к 5-аминолевулинату (ALA). Отвечающая за эту стадию 5-аминолевулинат-синтаза (ALA-синтаза) является ключевым ферментом всего пути. Экспрессия синтеза ALA-синтазы тормозится гемом, т. е. конечным продуктом, и имеющимся ферментом. Это типичный случай торможения конечным продуктом, или ингибирования по типу обратной связи.
АЛА + α-КетоГлутарат → ГЛУ + Пируват
38 Жирные кислоты поступают с пищей или синтезируются в организме (кроме полиеновых кислот). Субстраты, необходимые для синтеза жирных кислот, образуются при катаболизме глюкозы и таким образом, часть глюкозы превращается сначала в жирные кислоты, а затем в жиры. Хотя специфический путь катаболизма жирных кислот заканчивается образованием ацетил-КоА, служащим исходным субстратом для синтеза жирных кислот, процессы синтеза и окисления жирных кислот необратимы. Они происходят в разных компартментах клеток (биосинтез протекает в цитозоле, а окисление - в митохондриях) и катализируются разными ферментами. Окисление жирных кислот как источников энергии увеличивается в постабсорбтивный период, при голодании и физической работе. В этих состояниях их концентрация в крови увеличивается в результате мобилизации из жировых депо, и они активно окисляются печенью, мышцами и другими тканями. При голодании часть жирных кислот в печени превращается в другие "топливные" молекулы - кетоновые тела. Они, в отличие от жирных кислот, могут использоваться нервной тканью как источник энергии. При голодании и длительной физической работе кетоновые тела служат источником энергии для мышц и некоторых других тканей.
42.Тромбоцитарно-сосудистый гемостаз Характеризуется целым рядом последовательных фаз. Повреждение сосудистой стенки, обнажение ее внутренних структур способствуют адгезии и агрегации тромбоцитов. В эту фазу выделяются биологически активные вещества, которые вызывают сужение сосуда, уменьшая размер повреждения, усиливают адгезию и агрегацию тромбоцитов. Образуется первичный рыхлый тромбоцитарный. Повреждение внутренней поверхности сосуда - Адгезия тромбоцитов - Активация тромбоцитов - Агрегация тромбоцитов - Первичный тромбоцитарный тромб Большинство факторов свертывания крови — вещества белковой природы, образующиеся в печени. Их недостаток может быть связан с нарушением функции печени. Основные фазы процесса: 1) образование тромбопластина; 2) образование тромбина; 3) образование фибрина. Первая фаза — образование и высвобождение тромбопластина (тромбокиназы) — весьма активного фермента. Различают тканевой (внешний) тромбопластин, выделяющийся из клеток поврежденного сосуда и тканей, и кровяной (внутренний), освобождающийся при разрушении тромбоцитов. Вторая фаза - образование тромбина. Последний образуется при взаимодействии протромбина и тромбопластина с обязательным участием ионов кальция и других факторов свертывающей системы. Тромбин, расщепляя фибриноген, превращает его нерастворимый белок фибрин. Это и есть третья фаза свертывания крови. Нити фибрина, выпадая в осадок, образуют густ сеть, в которой «запутываются» клетки крови, прежде всего эритроциты. Сгусток приобретает красный цвет. Тромбин, кроме того, активирует XIII фактор свертывания крови, который связывает нити фибрина, укрепляя тромб. Противосвертывающая система Включает следующие основные компоненты: простациклин (тормозит адгезию и агрегацию тромбоцитов); антитромбин III (активирует тромбин и другие факторы свертывания крови); гепарин (препятствует образованию кровяного тромбопластина, сдерживает превращение фибриногена в фибрин). Фибринолитическая система Эта система разрушает фибрин. Основным компонентом ее является плазмин, который образуется из плазминогена под действием тканевого активатора плазминогена (ТАЛ). Плазмин расщепляет фибрин на отдельные фрагменты — продукты деградации фибрина (ПДФ). В дальнейшем тромб, остановивший кровотечение, подвергается ретракции (сжатию) и лизису (растворению).
|
3. Регуляции синтеза и каталитической активности ферментов: 1. Влияние закона действия масс. В катализируемой ферментом обратимой химической реакции, например А + В <=> С + D, концентрация компонентов реакции и соответственно направление реакции будут регулироваться влиянием закона действия масс. Оно, в частности, может быть показано в обратимой реакции трансаминирования, катализируемой ферментом аланинаминотрансферазой: Аланин + α-Кетоглутарат <=> Пируват + Глутамат. 2. Изменение количества фермента. На бактериях хорошо изучен феномен индуцированного синтеза ферментов при выращивании их на среде, где единственным источником углерода и энергии служит тот или иной углевод, например глюкоза. Замена в среде глюкозы на лактозу приводит к индуцированному или адаптивному синтезу фермента галактозидазы, расщепляющей лактозу на глюкозу и галактозу. 3. Проферменты. Протеолитические ферменты пищеварительного тракта, а также поджелудочной железы синтезируются в неактивной форме – в виде проферментов (зимогенов). Регуляция в этих случаях сводится к превращению проферментов в активные ферменты под влиянием специфических агентов или других ферментов – протеиназ. 4. Химическая модификация фермента. Некоторые белки при формировании третичной структуры подвергаются постсинтетической химической модификации. Оказалось, что активность ряда ключевых ферментов обмена углеводов, в частности фосфорилазы, гликогенсинтазы и др., также контролируется путем фосфорилирования и дефосфорили-рования, осуществляемого специфическими ферментами – протеинкиназой и протеинфосфатазой, активность которых в свою очередь регулируется гормонами. 5. Аллостерическая регуляция. Во многих строго биосинтетических реакциях основным типом регуляции скорости многоступенчатого ферментативного процесса является ингибирование по принципу обратной связи. Это означает, что конечный продукт биосинтетической цепи подавляет активность фермента, катализирующего первую стадию синтеза, которая является ключевой для данной цепи реакции. Поскольку конечный продукт структурно отличается от субстрата, он связывается с аллостерическим (некаталитическим) центром молекулы фермента, вызывая ингибирование всей цепи синтетической реакции. 6. Другие типы регуляции активности ферментов. Абсолютное количество присутствующего в клетке фермента регулируется временем его синтеза и распада. К регуляторным механизмам могут быть отнесены также конкуренция ферментов за общий субстрат, выключение активности одного из изоферментов (у множественных форм ферментов), влияние концентраций кофакторов и явление компартментализации. Различают обратимое и необратимое ингибирование. Если ингибитор вызывает стойкие изменения пространственной третичной структуры молекулы фермента или модификацию функциональных групп фермента, то такой тип ингибирования называется необратимым. Обратимое ингибирование в свою очередь разделяют на конкурентное и неконкурентное в зависимости от того, удается или не удается преодолеть торможение ферментативной реакции путем увеличения концентрации субстрата. Конкурентное ингибирование может быть вызвано веществами, имеющими структуру, похожую на структуру субстрата, но несколько отличающуюся от структуры истинного субстрата. Такое ингибирование основано на связывании ингибитора с активным центром. Неконкурентное обратимое ингибирование не может быть ослаблено или устранено повышением концентрации субстрата, так как эти ингибиторы присоединяются к ферменту не в активном центре, а в другом месте.
7. Ци́кл трикарбо́новых кисло́т (цикл Кре́бса, цитра́тный цикл) — центральная часть общего пути катаболизма, циклический биохимический аэробный процесс, в ходе которого происходит превращение двух- и трёхуглеродных соединений, образующихся как промежуточные продукты в живых организмах при распаде углеводов, жиров и белков, до CO2. При этом освобождённый водород направляется в цепь тканевого дыхания, где в дальнейшем окисляется до воды, принимая непосредственное участие в синтезе универсального источника энергии — АТФ. Цикл Кребса регулируется «по механизму отрицательной обратной связи», при наличии большого количества субстратов (ацетил-КоА, оксалоацетат), цикл активно работает, а при избытке продуктов реакции (NADH, ATP) тормозится. Регуляция осуществляется и при помощи гормонов, основным источником ацетил-КоА является глюкоза, поэтому гормоны, способствующие аэробному распаду глюкозы, способствуют работе цикла Кребса. Такими гормонами являются: инсулин и адреналин. Глюкагон стимулирует синтез глюкозы и ингибирует реакции цикла Кребса. Как правило работа цикла Кребса не прерывается за счёт анаплеротических реакций, которые пополняют цикл субстратами: Пируват + СО2 + АТФ = Оксалацетат(субстрат Цикла Кребса) + АДФ + Фн. Функции Интегративная функция — цикл является связующим звеном между реакциями анаболизма и катаболизма.
Арг, Гис, Глу — α-кетоглутарат. Фен, тир — фумарат.
Сукцинил-КоА — синтез гема. CО2 — реакции карбоксилирования.
12. Распад жирных кислот Жирные кислоты в виде триглицеридов накапливаются в жировых тканях. При потребности под действием таких веществ как адреналин, норадреналин, глюкагон и адренокортикотропина запускается процесс липолиза. Освобождённые жирные кислоты выделяются в кровоток, по которому попадают к нуждающимся в энергии клеткам, где сперва при участии АТФ происходит связывание (активация) с коферментом А (КоА). При этом АТФ гидролизуется до АМФ с освобождением двух молекул неорганического фосфата (Pi). R-COOH + КоА-SH + АТФ → R-CO-S-КоА + 2Pi + H+ + АМФ Синтез жирных кислот протекает в цитозоле из Ацетил-КоА, образовавшегося в митохондриях при гликолизе. Для использования ацетилкоэнзима-А в процессах, протекающих в цитоплазме клетки, протекает ряд реакций для переноса Ацетил-КоА через митохондриальную мембрану. В митохондриях ацетил-КоА взаимодействует со Щавелевоуксусной кислотой (ЩУК), образуется лимонная кислота. В цитоплазме протекает обратный процесс. Таким образом, в цитоплазме образуется Ацетил-КоА.Для синтеза жирных кислот протекает еще ряд последовательных реакций, образуется малонил-КоА. Ацетильная и малонильная группы переносятся на АПБ при участии ацетил-и малонил-трансацилаз. АПБ — ацилпереносящий белок. Далее к Ацетил-АПБ прибавляется Малонил-АПБ с образованием Ацетоацетил-АПБ. Наступает цакл реакций, противоположных бета-окислению жирных кислот, но вместо КоА носителем является АПБ, а вместо НАД и ФАД в процессах гидрирования участвует НАДФН2. Бутирил-АПБ вступает в новый цикл (взаимодействует с малонил-АПБ), в результате которого углеродная цепь удлиняется на 2 атома. Циклы повторяются, пока цепь включит 16 атомов углерода (пальмитиновая кислота) или большего четного числа. Насыщенные жирные кислоты Общая формула: CnH2n+1COOH или CH3-(CH2)n-COOH важная роль НЖК в организме определяется, прежде всего, биологическими эффектами специфического для них перекисного окисления и высокой физиологической активностью образующихся эйкозаноидов. Ненасыщенные жирные кислоты - это профилактика атеросклероза, строительный материал для клеток, профилактика внезапной смерти от остановки сердца.
15. Фосфолипи́ды — сложные липиды, сложные эфиры многоатомных спиртов и высших жирных кислот. Содержат остаток фосфорной кислоты и соединенную с ней добавочную группу атомов различной химической природы. Классификация:В зависимости от входящего в их состав многоатомного спирта принято делить фосфолипиды на три группы:1.глицерофосфолипиды - содержат остаток глицерина;2.фосфосфинголипиды - содержат остаток сфингозина;3.фосфоинозитиды - содержат остаток инозитола Биологическая роль:Главный липидный компонент клеточных мембран. Они сопутствуют жирам в пище и служат источником фосфорной кислоты, необходимый для жизни человека. Фосфолипиды входят в состав всех клеточных мембран. Между плазмой и эритроцитами происходит обмен фосфолипидами, которые играют важнейшую роль, поддерживая в растворимом состоянии неполярные липиды. Стеатоз печени и стеатогепатит — это заболевания, при которых в печеночных клетках происходит накопление жира (стеатоз) и развитие реакции воспаления и гибель клеток (стеатогепатит). Факторы риска тяжелого течения заболевания: возраст старше 45 лет; патологическое ожирение; сахарный диабет 2 типа; генетические факторы; женский пол.
19.Под трансаминированием подразумевают реакции межмолекулярного переноса аминогруппы (NH2—) от аминокислоты на α-кетокислоту без промежуточного образования аммиака. замечено, что при добавлении к гомогенату мышц глутаминовой и пиро-виноградной кислот образуются α-кетоглутаровая кислота и аланин без промежуточного свободного аммиака; добавление аланина и α-кетоглу-таровой кислоты приводило к образованию соответственно пировиноград-ной и глутаминовой кислот.
Реакции
трансаминирования являются обратимыми
и, как выяснилось позже, универсальными
для всех живых организмов. Эти реакции
протекают при участии специфических
ферментов.Теоретически реакции
трансаминиро-вания возможны между
любой амино- и кетокислотой, однако
наиболее интенсивно они протекают в
том случае, когда один из партнеров
представлен дикарбоновой амино- или
кетокислотой. Клиническое
значение
определения активности трансаминаз.
Широкое распространение и высокая
активность трансаминаз в органах и
тканях человека, а также сравнительно
низкие величины активности этих
ферментов в крови послужили основанием
для определения уровня ряда трансаминаз
в сыворотке крови человека при
органических и функциональных
поражениях разных органов. Для
клинических целей наибольшее значение
имеют две трансаминазы –
аспартат-аминотрансфераза (AcAT) и
аланин-аминотрансфераза (АлАТ),
катализирующие соответственно
следующие обратимые реакции:
23. Обзор метаболизма глутамина. Представление списка метаболических процессов, в которых участвует глутамин, можно начать с изучения связи этой аминокислоты и ее метаболитов с циклом трикарбоновых кислот (ЦТК) (рис.1). Глутамин метаболизируется до глутамата, который легко превращается в a-кетоглутарат - неотъемлемый компонент ЦТК. Этот путь метаболизма имеет большое значение для получения энергии. Как видно из рис.1, глутамин имеет несколько важных метаболитов. Скачано с dsmahelp.org.ua. Деаминирование глутамина глутаминазой приводит к образованию глутамата - предшественника g-аминомасляной кислоты, являющейся тормозным нейромедиатором. При циклизации глутамина образуется пролин - важный аминокислотный компонент коллагена (компонента соединительной ткани). Процессы деаминирования и трансаминирования глутамата участвуют в переносе аммиака между тканями. Перенос азота аминогруппы глутамина аминотрансферазой также участвует в процессе биосинтеза пуринов и пиримидинов. Аминогруппа глутамина играет важную роль в синтезе гексозаминов - веществ, жизненно необходимых для поддержания целостности и функции слизистых оболочек.
27.
31.Глюкокортикостероиды. — общее собирательное название подкласса гормонов коры надпочечников, обладающих более сильным действием на углеводный, чем на водно-солевой обмен, и их синтетических аналогов. Функция: регуляция минерального, углеводного и белкового баланса. По строению все глюкокортикоиды являются стероидами. Основным и наиболее активным естественным глюкокортикоидом человека является кортизол, но это верно не для всех видов животных. Например, у крысы основным глюкокортикоидом является кортикостерон, а кортизола производится мало, и он малоактивен для тканей организма крысы. У человека наоборот: кортикостерон производится в очень малых количествах, и он малоактивен для тканей человеческого организма. Влияние на обмен веществ:Глюкокортикоиды повышают уровень глюкозы в крови, увеличивают глюконеогенез из аминокислот в печени, тормозят захват и утилизацию глюкозы клетками периферических тканей, угнетают активность ключевых ферментов гликолиза, повышают синтез гликогена в печени и скелетных мышцах, усиливают катаболизм белков и уменьшают их синтез, повышают катаболизм жиров в подкожной жировой клетчатке и других тканях.Кроме того, глюкокортикоиды оказывают также определённое минералокортикоидное действие — способствуют задержке катиона натрия, аниона хлора и воды, усилению выведения катионов калия и кальция.
35. Для получения органических соединений, необходимых клеткам, нужен углерод. Из атомов углерода состоит скелет молекул белков, углеводов, жиров, витаминов, гормонов и ферментов. Все клетки организма по способу получения углерода можно разделить на две большие группы: - аутотрофные - их еще называют «сами себя питающие» - это клетки растений, они получают углерод из окружающей среды в виде его двуокиси (CO2), из этого углерода они строят все необходимые для них углеродсодержащие соединения; - гетеротрофные - «питающиеся за счет других» - это клетки животных и человека, они получают углерод из сравнительно сложных органических соединений, таких, например, как глюкоза. Синтез
мочевины.
В образовании 1 моля мочевины участвуют
1 моль ионов аммония, 1 моль двуокиси
углерода и 1 моль альфа-аминного азота
аспартата. В ходе синтеза потребляются
3 моля АТР, в нем последовательно
участвуют пять ферментов. Из 6
аминокислот, вовлекаемых в синтез
мочевины, одна (N- ацетилглутамат )
служит активатором одного из ферментов
и в химических превращениях не
участвует. Остальные пять - аспартат
, аргинин , орнитин , цитруллин и
аргининосукцинат - служат переносчиками
атомов, которые в итоге образуют
молекулу мочевины:
Синтез глюкозы. Большинство стадий глюконеогенеза представляет собой обращение реакции гликолиза. Только 3 реакции гликолиза (гексокиназная, фосфо-фруктокиназная и пируваткиназная) необратимы, поэтому в процесс глюконеогенеза на 3 этапах используются другие ферменты. Суммарный результат глюконеогенеза из пирувата: 2 Пируват + 4 АТФ + 2 ГТФ + 2 (NADH + Н+)+ 4 Н20 → Глюкоза + 4 АДФ + 2 ГДФ + 6 H3PO4 + 2 NAD+ Синтез жирных кислот. Процесс осуществляется в различных частях клетки. В цитоплазме синтезируются насыщенные жирные кислоты с углеродной цепью до С16 (пальмитат). В митохондриях происходит дальнейшее наращивание цепи, а в ретикулуме насыщенные жирные кислоты превращаются в ненасыщенные, и также происходит удлинение цепи. Основным продуктом системы синтеза, содержащимся в цитозоле, является пальмитиновая кислота . Субстратом для синтеза жирной кислоты служит ацетил—СоА , образующийся из глюкозы в результате окисления пирувата. Суммарное уравнение синтеза пальмитата (7 циклов): Ацетил—СоА+7Малонил—КоА+14(NADPH+Н+) → пальмитат + 8HS—CoA+ 7CO2+14NADP++7H2O 39. Углеводный обмен, процессы усвоения углеводов в организме; их расщепление с образованием промежуточных и конечных продуктов (деградация, диссимиляция), а также новообразование из соединений, не являющихся углеводами (глюконсогенез), или превращение простых углеводов в более сложные. Под влиянием пищеварительных ферментов гидролаз (различного типа амилаз, гликозидаз) сложные поли- и олигосахариды подвергаются расщеплению до моносахаридов — гексоз или пентоз, которые утилизируются организмом. Полисахариды ферментативно расщепляются также фосфорилазами с образованием глюкозо-1-фосфата. Деградация гексоз, поступивших в клетку, осуществляется в процессе брожения или гликолиза, а также окислением в пентозофосфатиом цикле. Печень активно участвует в обмене как простых (жиры) липидов, так и сложных. К последним относятся липопротеиды и сложные липиды. Среди сложных липидов важную роль играют холестерин, желчные кислоты, гормоны. Осуществляя синтез холестерина в обычных условиях, печень использует 30—40% своей мощности. Часть холестерина в гепатоцитах метаболизируется в желчные кислоты, гормоны, ничтожная часть — в дегидрохолестерин (витамин D2). В печени синтезируются первичные желчные кислоты — холевая и хенодезоксихолевая. Обычно эти желчные кислоты представлены холатами и связаны с таурином и глицином. Соли первичных желчных кислот, поступая с желчью в кишечник, преобразуются в соли вторичных желчных кислот — дезоксихолевую и литохолевую.
|
4. Окисление биологическое (клеточное или тканевое дыхание) — окислительно-восстановительные реакции, протекающие в клетках организма, в результате которых сложные органические вещества окисляются при участии специфических ферментов кислородом, доставляемым кровью. Конечными продуктами биологического окисления являются вода и двуокись углерода. Реакции отщепления водорода осуществляются ферментами класса дегидрогеназ, причем атомы водорода (т. е. протоны + электроны) присоединяются к коферментам: никотинамидадениндинуклеотиду (НАД), никотинамидадениндинуклеотид-фосфату (НАДФ), флавинадениндинуклеотиду (ФАД) и др. Оксидоредуктазы - класс ферментов, катализирующихокислительно-восстановительные реакции. Играют важную роль в обеспеченииклеток энергией. Важнейшие группы оксидоредуктаз: дегидрогеназы,гидроксилазы, оксигеназы, оксидазы, пероксидазы. Оксидоредуктазы катализируют биохимические процессы, сопровождающиеся выделением энергии. Оксидоредуктазы чрезвычайно важны для клетки, так как с их помощью осуществляются определенные экзотермические реакции, в результате которых бактерии получают энергию, необходимую для их жизнедеятельности. Оксидоредуктазы ускоряют протекание химических процессов, связанных с высвобождением энергии. Оксидоредуктазы ускоряют химические процессы, протекающие в клетке, в результате которых высвобождается энергия. Процессы окисления неразрывно связаны с фосфорилированием органических веществ, так называемым окислительным фосфо-рилированием, - объединенным процессом переноса электронов и аккумуляции энергии дыхания вследствие эстерификации неорганического фосфата в макроэргические соединения типа АТФ. Анаэробные дегидрогеназы являются двухкомпонентными ферментами и легко диссоциируют при диализе, распадаясь на более активные коферменты. Коферментами являются никотинамидаде-ниндинуклеотид (НАД) и никотинамидадениндинуклеотидфосфат (НАДФ). Эти коферменты очень реакционноспособны в окислительно-восстановительных системах. Они играют важную роль в процессе алкогольного брожения. Анаэробные дегидрогеназы являются двухкомпонентными ферментами и легко диссоциируют при диализе, распадаясь на более активные коферменты. Коферментами являются никотинамидаде-ниндинуклеотид (НАД) и никотинамидадениндинуклеотидфосфат (НАДФ). Эти коферменты очень реакционноспособны в окислительно-восстановительных системах. Они играют важную роль в процессе алкогольного брожения.
8. Глико́лиз — ферментативный процесс последовательного расщепления глюкозы в клетках, сопровождающийся синтезом АТФ. Гликолиз при аэробных условиях ведёт к образованию пировиноградной кислоты (пирувата), гликолиз в анаэробных условиях ведёт к образованию молочной кислоты (лактата). Гликолиз является основным путём катаболизма глюкозы в организме животных. Результат Результатом гликолиза является превращение одной молекулы глюкозы в две молекулы пировиноградной кислоты (ПВК) и образование двух восстановительных эквивалентов в виде кофермента НАД∙H. Полное уравнение гликолиза имеет вид: Глюкоза + 2НАД+ + 2АДФ + 2Фн = 2НАД∙Н + 2ПВК + 2АТФ + 2H2O + 2Н+. При отсутствии или недостатке в клетке кислорода пировиноградная кислота подвергается восстановлению до молочной кислоты, тогда общее уравнение гликолиза будет таким: Глюкоза + 2АДФ + 2Фн = 2лактат + 2АТФ + 2H2O. Таким образом, при анаэробном расщеплении одной молекулы глюкозы суммарный чистый выход АТФ составляет две молекулы, полученные в реакциях субстратного фосфорилирования АДФ. У аэробных организмов конечные продукты гликолиза подвергаются дальнейшим превращениям в биохимических циклах, относящихся к клеточному дыханию. В итоге после полного окисления всех метаболитов одной молекулы глюкозы на последнем этапе клеточного дыхания — окислительном фосфорилировании, происходящем на митохондриальной дыхательной цепи в присутствии кислорода, — дополнительно синтезируются ещё 34 или 36 молекулы АТФ на каждую молекулу глюкозы. Значение Гликолиз — катаболический путь исключительной важности. Он обеспечивает энергией клеточные реакции, в том числе и синтез белка. Промежуточные продукты гликолиза используются при синтезе жиров. Пируват также может быть использован для синтеза аланина, аспартата и других соединений. Благодаря гликолизу производительность митохондрий и доступность кислорода не ограничивают мощность мышц при кратковременных предельных нагрузках.
9. Глюкозо-лактатный цикл (цикл Кори) - Начинается с образования лактата в мышцах в результате анаэробного гликолиза (особенно в белых мышечных волокнах, которые бедны митохондриями по сравнению с красными). Лактат переносится кровью в печень, где в процессе глюконеогенеза превращается в глюкозу, которая затем с током крови может возвращаться в работающую мышцу. Итак печень снабжает мышцу глюкозой и, следовательно, энергией для сокращений. В печени часть лактата может окисляться до СО2 и Н2О, превращаясь в пируват и далее в общих путях катаболизма. Аланин (2-аминопропановая кислота) — алифатическая аминокислота. α-Аланин входит в состав многих белков, β-аланин — в состав ряда биологически активных соединений. Аланин легко превращается в печени в глюкозу и наоборот. Этот процесс носит название глюкозо-аланинового цикла и является одним из основных путей глюконеогенеза в печени. Химические свойства взаимодействие с основаниями NH2-C2H4-COOH + NaOH → NH2-C2H4-COONa + H2O взаимодействие с кислотами NH2-C2H4-COOH + HCl → HOOC-C2H4-NH2•HCl взаимодействие со спиртами NH2-C2H4-COOH + C2H5OH → NH2-C2H4-CO-С2Н5 + H2O образование пептидной связи NH2-C2H4-COOH + NH2-C2H4-COOH → NH2-C2H4-CO-NH-C2H4-COOH + H2O
16. Холестери́н — органическое соединение, природный жирный (липофильный) спирт, содержащийся в клеточных мембранах всех живых организмов за исключением безъядерных. Нерастворим в воде, растворим в жирах и органических растворителях. Около 80 % холестерина вырабатывается самим организмом, остальные 20 % поступают с пищей. В организме находится 80 % свободного и 20 % связанного холестерина. Холестерин обеспечивает стабильность клеточных мембран в широком интервале температур. Он необходим для выработки витамина D, выработки надпочечниками различных стероидных гормонов, включая кортизол,кортизон, альдостерон, женских половых гормонов эстрогенов и прогестерона, мужского полового гормона тестостерона, а по последним данным — играет важную роль в деятельности синапсов головного мозга и иммунной системы, включая защиту от рака.[2] Биосинтез холестеринаХолестерин может как образовываться в животном организме, так и поступать с пищей. Ступени:1.Превращение трёх молекул активного ацетата в пятиуглеродный мевалонат. Происходит в ГЭПР.2.Превращение мевалоната в активный изопреноид — изопентенилпирофосфат. 3.Образование тридцатиуглеродного изопреноида сквалена из шести молекул изопентенилдифосфата.4.Циклизация сквалена в ланостерин.5.Последующее превращение ланостерина в холестерин. Биологическая роль:Холестерин в составе клеточной плазматической мембраны играет роль модификатора бислоя, придавая ему определенную жесткость за счет увеличения плотности «упаковки» молекул фосфолипидов. Таким образом, холестерин- стабилизатор текучести плазматической мембраны. Холестерин открывает цепь биосинтеза стероидных половых гормонов и кортикостероидов, служит основой для образования жёлчных кислот и витаминов группы D, участвует в регулировании проницаемости клеток и предохраняет эритроциты крови от действия гемолитических ядов. Ацетил-КоА+Ацетил-Коаацетоацетил-КоаВ-гидрокси-В-метил-глутарил-КоаМеталоновая кислоталаностеринхолестерин Регуляция: Ферментограничивающий скорость синтеза- ГМГ-КоА- редуктаза. Аллостерическим ингибиторомявляется холестерин. Инсулин стимулирует этот фермент путём дефосфорилирования.
20.Реакции декарбоксилирования. Процесс отщепления карбоксильной группы аминокислот в виде СО2 получил название декарбоксилирования. В животных тканях установлено декарбоксилирование следующих аминокислот и их производных: тирозина, триптофана, 5-окситриптофана, валина, серина, гистидина, глу-таминовой и γ-оксиглутаминовой кислот, 3,4-диоксифенилаланина, цис-теина, аргинина, орнитина, S-аденозилметионина и α-аминомалоновой кислоты. В клинической практике широко используется, кроме того, продукт α-декарбоксилирования глутаминовой кислоты – γ-аминомасляная кислота (ГАМК). Фермент, катализирующий эту реакцию (глутаматдекарбокси-лаза), является высокоспецифичным:
Одним из хорошо изученных ферментов является декарбоксилаза ароматических аминокислот. Она не обладает строгой субстратной специфичностью и катализирует декарбок-силирование L-изомеров триптофана, 5-окситриптофана и 3,4-диоксифе-нилаланина (ДОФА); продуктами реакций, помимо СО2, являются соответственно триптамин, серотонин и диоксифенилэтиламин (дофамин)
24. Метионин — алифатическая серосодержащая α-аминокислота, бесцветые кристаллы со специфическим неприятным запахом, растворимые в воде, входит в число незаменимых аминокислот. Содержится во многих белках и пептидах (метионин-энкефалин, метионин-окситоцин). Значительное количество метионина содержится в казеине. Свойства и синтез Метионин по своим свойствам является типичной алифатической аминокислотой, метилсульфидный фрагмент при восстановлении красным фосфором в йодистоводородной кислоте деметилируется с образованием гомоцистеина; в мягких условиях окисляется до метионинсульфоксида, под действием перекиси водорода, хлорной кислоты и других сильных окислителей — до соответствующего сульфона. Первоначально в промышленности метионин выделяли из гидролизатов казеина, однако в настоящее время метионин получают синтетически. Промышленный синтез DL-метионина осуществляют исходя из акролеина. На первой стадии присоединением метилмеркаптана к акролеину синтезируют 3-метилтиопропионовый альдегид: CH3SH + H2C=CH-CHO CH3SCH2CH2CHO который далее используется в качестве карбонильного компонента синтеза Штреккера: CH3SCH2CH2CHO + HCN + NH3 CH3SCH2CH2CH(NH2)CN CH3SCH2CH2CH(NH2)CN + H2O CH3SCH2CH2CH(NH2)COOH
28. Глюкагон — гормон альфа-клеток островков Лангерганса поджелудочной железы. По химическому строению глюкагон является пептидным гормоном.Молекула глюкагона состоит из 29 аминокислот и имеет молекулярный вес 3485 дальтон. Глюкагон является одним из антагонистов инсулина, способствует образованию глюкозы в печени. Нормальная секреция гормона обеспечивает надежный контроль за поддержанием постоянства уровня глюкозы крови. Недостаток инсулина при сахарном диабете сопровождается избытком глюкагона, который, собственно, и является причиной гипергликемии. Главные влияния глюкагона на метаболизм глюкозы заключаются в: (1) расщеплении гликогена печени (гликогенолиз); (2) увеличении глюконеогенеза в печени. Оба этих эффекта приводят к существенному увеличению глюкозы в других органах.
32.РЕГУЛЯЦИЯ БИОЛОГИЧЕСКАЯ, поддержание функциональных параметров биологически системы в заданных границах.Обеспечивает гомеостаз организма — сохранение постоянства параметров внутренней среды, а также условий его развития (эпигенез). Гомеостаз обеспечивается на всех уровнях организации организма отрицательными, эпигенез — положительными обратными связями (см. Обратная связь). Организм высшего растения, в т. ч. винограда, представляет собой сложную самоуправляющуюся систему. Он включает несколько органов и порядка 30 специализированных тканей, выполняющих различные физиологические функции. Скачано с dsmahelp.org.ua .Успешное функционирование растительного организма, построенного на основе дифференциации и специализации структурно-функциональных элементов, происходит по принципу соподчинения частей целому, их интеграции. Под контролем регуляторных механизмов находятся не все ферменты, а в основном ключевые, катализирующие самые медленные реакции, а также ферменты, функционирующие в точках разветвления метаболических путей. Вследствие конкуренции за субстрат в этих местах происходит замедление одних путей метаболизма и ускорение других.
36.Зв’язок ПФШ з синтезом нуклеотидів, жирних кислот, мікросомальним окисленням Значение метаболического пути для различных тканей можно оценить по его активности. Пентозофосфатный путь активно протекает в печени, жировой ткани , коре надпочечников , щитовидной железе , эритроцитах , семенниках и в молочных железах в период лактации; он неактивен в нелактирующей молочной железе и малоактивен в скелетных мышцах . Все ткани, в которых активность данного пути высока, используют в реакциях восстановительного синтеза NADPH , например в реакциях синтеза жирных кислот , стероид ов, аминокислот (с участием глутаматдегидрогеназы ) или восстановленного глутатион а в эритроцитах. Вероятно, в условиях активного липогенез а или при наличии любой системы, утилизирующей NADPH, возрастает активная деградация глюкозы по пентозофосфатному пути в связи с увеличением отношения NADP:NADPH . В условиях, которые возникают после приема пищи, может индуцироваться синтез глюкозо-6-фосфатдегидрогеназы и фосфоглюконатдегидрогеназы . Пентозофосфатный путь поставляет рибозу для синтеза нуклеотидов и синтеза нуклеиновых кислот . Источником рибозы является интермедиат рибозо-5-фосфат , который в реакции с ATP образует PRPP , используемый в биосинтезе нуклеотидов. Мышечная ткань содержит очень малые количества глюкозо-6-фосфатдегидрогеназы и 6-фосфоглюконатдегидрогеназы. Тем не менее скелетная мышца способна синтезировать рибозу. Вероятно, это осуществляется при обращении неокислительной фазы пентозофосфатного пути, утилизирующей фруктозо-6-фосфат. Таким образом, синтез рибозы может осуществляться в ткани, если в ней протекает часть реакций пентозофосфатного пути. Микросомальное окисление - совокупность реакций первой фазы биотрансформации ксенобиотиков и эндогенных соединений, катализирующихся ферментными системами мембран эндоплазматического ретикулума гепатоцитов при участии цитохрома Р-450. При дифференциальном центрифугировании эндоплазматический ретикулум оказывается в микросомальной фракции, поэтому эти реакции получили название микросомальных, а соответствующие ферменты - микросомальных оксигеназ. Суть реакций заключается в гидроксилировании вещества типа R-H с использованием одного атома молекулы кислорода О2, второй атом соединяется с протонами водорода H+ с образованием воды. Донором протонов водорода является восстановленный NADPH + H+. Таким образом, меняется структура исходного вещества, а значит и его свойства, причём они могут как угнетаться, так и наоборот, усиливаться. Гидроксилирование позволяет перейти процессу обезвреживания ко второй фазе — реакциям конъюгации, в ходе которых к созданной функциональной группе будут присоединяться другие молекулы эндогенного происхождения. Уравнение реакции: RH + O2 + NADPH + H+ → ROH + H2O + NADP+
40.Гем является небелковой частью многих гемопротеинов:
Строение и синтез гема Синтез гема в основном идет в предшественниках эритроцитов, клетках печени, почек, слизистой кишечника, и в остальных тканях. Первая реакция синтеза с участием δ-аминолевулинат-синтазы происходит в митохондриях. Следующая реакция при участии аминолевулинатдегидратазы (порфобилиноген-синтазы) протекает в цитозоле. После синтеза порфобилиногена четыре его молекулы конденсируются в тетрапиррол. Различают два вида тетрапирролов - уропорфириноген типа I и уропорфириноген типа III. В синтезе обоих видов порфиринов принимает участие уропорфириноген I-синтаза, в образования уропорфириногена III дополнительно принимает участие фермент уропорфириноген III-косинтаза. Далее уропорфириногены превращаются в соответствующие копропорфириногены. Копропорфириноген III окисляется в протопорфириноген IX и далее в протопорфирин IX. Последний после связывания с железом образует гем, реакцию катализирует феррохелатаза (гемсинтаза). Регуляция синтеза гемма Скорость синтеза глобиновых цепей зависит от наличия гема, он ускоряет биосинтез "своих" белков.Основным регуляторным ферментом синтеза гема является аминолевулинатсинтаза. Положительным модулятором аминолевулинатсинтазы служит гипоксия тканей, которая в эритропоэтических тканях индуцирует синтез фермента.В печени повышение активности аминолевулинатсинтазы вызывают соединения, усиливающие работу микросомальной системы окисления (жирорастворимые токсины, стероиды) – при этом возрастает потребление гема для образования цитохрома Р450, что снижает внутриклеточную концентрацию свободного гема. В результате происходит дерепрессия синтеза фермента.
|



 ацетил-КоА
и дегидролипоевой кислоты:
ацетил-КоА
и дегидролипоевой кислоты:

 2,3дифосфоргицерата
2,3дифосфоргицерата



