
Лекция 3 фазовые диаграммы равновесия сплавов
(1. Правило фаз. 2. Понятия о фазовых диаграммах равновесия. 3. Правило отрезков. 4. Диаграмма состояния III рода)
1. Правило фаз
При изменении температуры или концентрации компонентов система (сплав) может находиться в различных состояниях. В процессе перехода из одного состояния в другое в нем совершаются фазовые превращения – появляются новые или исчезают существующие фазы.
Возможность изменения состояния системы, т. е. числа и химического состава фаз, определяется ее вариантностью – числом степеней свободы.
Определение. Число степеней свободы системы — это число внешних (температура, давление) и внутренних (концентрация) факторов, которое можно изменять без изменения числа фаз системы.
Уравнение правила фаз (закон Гиббса) для системы при постоянном давлении, образованной несколькими компонентами, имеет вид
С = К – Ф + 1, (3.1)
где С – число степеней свободы (вариантность системы); К – число компонентов; Ф – число фаз.
Так как число степеней свободы всегда больше или равно нулю, т.е. С 0, то между числом компонентов и фаз выполняется условие
Ф К + 1, (3.2)
устанавливающее максимально возможное число равновесных фаз в сплавах.
2. Понятия о фазовых диаграммах равновесия
Фазовые диаграммы равновесия (диаграммы состояния) используются при исследовании структуры сплавов, выборе режимов их термообработки и др.
Фазовая диаграмма равновесия показывает, какие фазы существуют при заданных условиях (концентрация компонентов и температура) в равновесных условиях. По диаграмме можно определить агрегатное состояние, количество и химический состав фаз, а также структурно-фазовое состояние сплава в зависимости от температуры и концентрации образующих его компонентов.
Фазовая диаграмма равновесия представляет собой «график», на оси абсцисс которого отложена концентрация компонентов (суммарное содержание компонентов в любом сплаве равно 100 %), а по оси ординат – температура. Крайние точки (левая и правая) на оси абсцисс диаграммы соответствуют чистым компонентам. Любая другая точка на этой оси отвечает определенной концентрации компонентов сплава.
Например, для двухкомпонентного сплава (рис. 3.1) точка А соответствует чистому, т.е. содержащему 100 %, компоненту А, точка В – чистому компоненту В, точка С – сплаву, содержащему 75 % А и 25 % В, точка D – сплаву, содержащему 75 % В и 25 % А. На оси концентраций указывается изменение содержания одного из компонентов (на рис. 3.1 – компонента В).
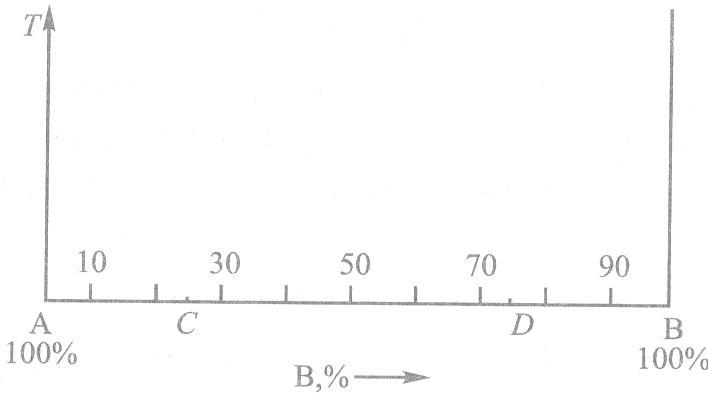
Рис. 3.1 – Координаты фазовой диаграммы равновесия
Для построения диаграмм состояния исследуют сплавы различного состава при разных температурах. Традиционным методом построения диаграмм является метод термического анализа, который позволяет получать кривые охлаждения сплавов в координатах «температура – время» – кривые охлаждения (сплавов).
Охлаждение сплавов производят с очень низкой скоростью, т. е. в условиях, приближенных к равновесным.
Построение диаграмм охлаждения выполняют в следующей последовательности:
-
в координатах «температура – концентрация» проводят вертикальные линии, соответствующие сплавам исследованных составов (чем меньше шаг по концентрации, тем точнее диаграмма);
-
для этих сплавов строят кривые охлаждения;
-
на вертикальных линиях точками наносят температуру, при которой изменяется агрегатное состояние или строение сплавов;
-
точки одинаковых превращений разных сплавов соединяют линиями, которые ограничивают области одинаковых состояний системы.
Такие построения мы выполняли в лабораторной работе № 1 при построении диаграммы состояния «цинк – олово» («Zn – Sn»).
Вид диаграммы зависит от того, как взаимодействуют между собой компоненты в твердом и жидком состояниях.
Простейшими диаграммами являются бинарные (двойные или двухкомпонентные) системы (многокомпонентные системы могут быть сведены к ним при фиксированных значениях «избыточных» компонентов), к основным видам которых относятся диаграммы состояния для сплавов, представляющих собой в твердом состоянии (при нормальной температуре):
а) механические смеси из чистых компонентов (I рода);
б) сплавы с неограниченной растворимостью компонентов (II рода);
в) сплавы с ограниченной растворимостью компонентов (III рода);
г) сплавы с образованием химического соединения (IV рода).
В лекции рассмотрим построение фазовых диаграмм равновесия на примере диаграммы состояния III рода – сплава с ограниченной растворимостью компонентов (остальные виды диаграмм рассмотрены на лабораторных работах).
Но предварительно обсудим важное для анализа подобных диаграмм правило отрезков (рычага).
